不同生境人参茎叶总皂苷对心律失常小鼠的作用比较
娄云云,房庆伟,李坤,叶冠
(上海医药集团股份有限公司中央研究院,上海 201203)
心律失常是一种严重的心血管疾病,室性早搏(VPBs)和室性心动过速(VT)等室性心律失常可导致心源性猝死[1]。临床抗心律失常药物根据其动作电位的不同阶段分为四类,包括Na+通道阻滞剂(Ⅰ类)、β受体阻滞剂(Ⅱ类)、K+通道阻滞剂(Ⅲ类)和Ca2+通道阻滞剂(Ⅳ类)。它们中的大多数药物都具有严重的副作用,并且它们的治疗和毒性作用之间的窗口很窄[2]。天然产物具有多靶点、疗效显著、安全性和结构新颖等优点,具有广泛的临床应用前景。
人参为五加科(Araliaceae)多年生草本植物人参(PanaxginsengC.A.Mey.)的干燥根及根茎。根据其播种方式及生长环境的不同,把人工播种栽培的人参称为“园参”;把人工播种并任其在山林野生状态下自然生长的称为“林下山参”,习称“籽海”[3]。目前临床上使用的人参药用部位大多为其根及根茎,但该药用部位收获周期较长、价格昂贵。而对于人参茎叶这个部位来说,该部位每年采收、价格低廉,而且研究发现林下山参茎叶中的总皂苷含量远大于其根及根茎[4],具有良好的利用价值。目前,《中国药典》2020年版也已收录关于人参茎叶总皂苷提取物的质量标准[3],其中园参茎叶是生产该提取物的主要原料。目前关于人参茎叶总皂苷对心律失常作用的研究报道较少[5-6],其抗心律失常的作用机理也有待阐明。目前尚无林下山参茎叶总皂苷在心律失常方向上的研究报道。在本文中,我们研究比较了园参茎叶总皂苷(GSLS)和林下山参茎叶总皂苷(MSLS)对氯化钡致心律失常小鼠Ⅱ导联心电图的影响,并测定了小鼠心肌Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶的表达;探讨了不同生境人参茎叶总皂苷对氯化钡致心律失常小鼠的改善作用及其可能机制,为后期林下山参茎叶资源在心律失常上的更好应用提供理论依据。
1 材料与仪器
1.1 实验动物 SPF级BALB/c小鼠80只,雌雄各半,体重16~18 g,由常州卡文斯实验动物有限公司提供,实验动物生产许可证号:SCXK(苏)2016-0010;实验动物使用许可证号:SYXK(苏)2017-0040。实验室通风状况良好,环境温度22 ℃左右,环境湿度40%左右,12 h明暗循环。实验过程符合《实验动物管理条例》的相关规定。
1.2 药物与试剂 GSLS(人参茎叶总皂苷含量77.37%,人参皂苷Rg1、Re、Rd含量之和为34.06%),MSLS(人参茎叶总皂苷含量77.07%,人参皂苷Rg1、Re、Rd含量之和为37.46%),均为实验室自制,其制法参考《中国药典》2020年版[3]。实验用园参茎叶及林下参茎叶样品经叶冠教授级高级工程师鉴定为五加科植物人参(PanaxginsengC.A.Mey.)的干燥茎叶。无水乙醇AR(国药集团化学试剂有限公司,批号:20181225);水合氯醛(上海阿拉丁生化科技股份有限公司,批号:F2103036);氯化钡(上海沃凯生物技术有限公司,批号:20200509);ATP酶测试盒(南京建成生物工程研究所,批号:20201201)。
1.3 主要仪器设备 YF116B型打粉机(瑞安永历制药机械);BSA 224S电子天平(德国赛多利斯公司);Multiskan FC酶标仪(美国Thermo公司);D3024R型台式高速冷冻离心机(美国SCILOGEX公司);恒温金属浴(美国Thermo公司);MD3000-C型生物信号采集处理系统(安徽正华生物仪器设备有限公司)。
2 方法
2.1 动物分组 SPF级BALB/c小鼠80只,体重约16 ~ 18 g,共分为8组:正常组、模型组、GSLS-L(10 mg·kg-1)、GSLS-M(20 mg·kg-1)、GSLS-H(40 mg·kg-1)、MSLS-L(10 mg·kg-1)、MSLS-M(20 mg·kg-1)、MSLS-H(40 mg·kg-1)剂量组,每组10只。
2.2 模型制备 用0.1%水合氯醛对小鼠进行麻醉,连接生物信号采集处理系统,然后通过小鼠尾静脉注射0.4%氯化钡溶液(0.2 mL/20 g)造模,并于4 s内注射完,注射后立即出现心律失常,随即用生物信号采集处理系统监测每组小鼠Ⅱ导联心电图。
2.3 药物制备 分别精密称取GSLS和MSLS皂苷14、28、56 mg,用100 μL DMSO充分溶解,用生理盐水稀释至14 mL,分别得到GSLS和MSLS低(10 mg·kg-1)、中(20 mg·kg-1)、高(40 mg·kg-1)剂量组。
2.4 药物干预及取材 各给药组小鼠预先每天灌胃受试药物,给药体积为10 mL·kg-1体重,连续给药7 d。正常组及模型组灌胃等体积的溶媒。末次给药后1.5 h,除正常组外,模型组及给药组动物按“2.2”项下方法进行模型制备。并于氯化钡造模后1.0 h处死小鼠,解剖取各组小鼠非梗死区心肌组织。
2.5 心律失常持续时间的测定及对心电图相关波段的影响 用生物信号采集处理系统监测并采集每组小鼠Ⅱ导联心电图,观察小鼠心电图P波、QRS波以及PQ间期的改善情况。
2.6 小鼠心肌ATP酶的测定 取保存于-80 ℃的非梗死区心肌组织100 mg,应用ATP酶测试盒检测该组织中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力值。
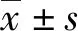
3 实验结果
3.1 GSLS与MSLS对模型小鼠心律失常的影响 与正常组比较,模型组小鼠出现持续性快速心律失常;与模型组比较,GSLS-L、GSLS-M、GSLS-H、MSLS-L、MSLS-M、MSLS-H组心律失常持续时间均有所降低(P<0.01);GSLS和MSLS各同等剂量组比较未见统计学差异。此外,GSLS与MSLS对氯化钡致心律失常小鼠心电图的P波、QRS波和PQ间期均具有明显改善作用,结果见表1和表2。
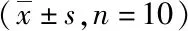
表1 小鼠快速性心律失常持续时间
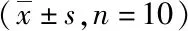
表2 小鼠Ⅱ导联心电图的P波、QRS波及PQ间期情况
3.2 GSLS与MSLS对模型小鼠心肌组织中ATP酶活力的影响 与正常组相比,模型组小鼠心肌组织中Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶活力水平显著降低(P<0.01)。与模型组相比,GSLS-L、GSLS-M、GSLS-H、MSLS-L、MSLS-M、MSLS-H组Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶活力水平均有所升高,其中GSLS-M、GSLS-H、MSLS-M、MSLS-H组具有统计学意义(P<0.05,P<0.01)。GSLS和MSLS各同等剂量组比较未见统计学差异;而GSLS和MSLS对ATP酶活力的影响呈现出剂量依赖性,结果见表3。
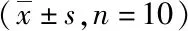
表3 小鼠心肌组织Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的变化情况
4 讨论
心电图导联分为肢体导联(Ⅰ、Ⅱ、Ⅲ、avL、avR、avF)和胸前导联(V1、V2、V3、V4、V5、V6)。正常心脏除极方向与Ⅱ导联方向相似,所以Ⅱ导联上的P波最明显。非窦性心律及心律失常在Ⅱ导联上易于识别,因此临床上最常选择Ⅱ导联作为常规监测。P波是由窦房结激动心房引起的,右心房的激动通过P波的前部反映出来,而后部代表左心房的激动。QRS波反映快速心室去极化过程,一般认为Q波是室间隔电兴奋过程,R波和S波是左右心室自由壁的兴奋过程。P波、QRS波的时限和振幅改变对心律失常的诊断具有重要意义。PR(PQ)间期代表由窦房结产生的兴奋经由心房、房室交界和房室束到达心室并引起心室肌收缩所需要的时间,故也称为房室传导时间。当发生房室传导阻滞时,PR间期延长[7]。在此次研究中我们发现,与模型组比较,GSLS-L、GSLS-M、GSLS-H、MSLS-L、MSLS-M、MSLS-H组心律失常持续时间均有所降低。而GSLS和MSLS各同等剂量组比较未见统计学差异。进一步对其Ⅱ导联心电图分析发现,GSLS与MSLS对模型小鼠心电图的P波、QRS波和PQ间期均具有明显改善作用,表明GSLS与MSLS均可通过调整心房和心室的收缩以及房室传导时间来改善氯化钡致小鼠心律失常。
Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶是介导Na+、K+、Ca2+等离子穿过包括心肌细胞在内的膜蛋白[8-9]。Na+-K+-ATP酶是实现Na+和K+的逆电化学梯度跨膜转运的关键酶,它可以把动作电位去极化过程内流的Na+转运到细胞外,把复极化过程外流的K+运回细胞内。Ca2+-Mg2+-ATP酶则在Ca2+升高到一定程度时被激活,ATP水解供能使细胞内的Ca2+浓度降低。以上两种ATP酶对于调节心肌细胞的收缩、舒张功能有着很重要的作用。当心肌细胞Na+-K+-ATP酶活性降低时,细胞内Na+增多,K+减少,细胞内Ca2+过多,除引起Ca2+超负荷损伤外,还使细胞内明显缺K+,导致心肌细胞自律性增高,传导速度减慢,易致心律失常。同时,细胞膜和肌浆网中Ca2+-Mg2+-ATP酶的功能也发生障碍,使胞内Ca2+超载,这进一步为触发心律失常奠定了基础。因此,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶可作为心律失常的合适生物标志物[10-12]。在此次研究中我们发现,模型组小鼠Na+-K+-ATP酶[(0.40±0.39)μmol·(mg·h)-1]和Ca2+-Mg2+-ATP酶[(0.78±0.48)μmol·(mg·h)-1]的平均值显著低于正常组,该结果表明心律失常模型小鼠的成功建立。而GSLS和MSLS给药组小鼠的两个ATP酶活性较模型组而言均存在不同程度的升高,并且存在剂量依赖性。其中低剂量组(10 mg·kg-1)较模型组有升高,但是没有显著性差异;而中剂量组(20 mg·kg-1)和高剂量组(40 mg·kg-1)较模型组有显著性升高,其中高剂量组最佳。然而GSLS和MSLS各等同剂量组比较未见统计学差异。
人参是一种生长缓慢的多年生植物,其根及根茎在中国已经有几千年的药用历史,现代药理和化学研究表明其中最主要的生物活性成分为人参皂苷[13]。人参茎叶作为人参的非药用部位,其资源丰富、生长周期短、价格低廉、皂苷含量丰富,随着近年来对人参皂苷需求的不断增加,对于人参茎叶皂苷相关的研究也需进一步加强。Wang等[14]通过HPLC-IT-TOF-MS技术发现了由5个色谱峰组成的特征峰模式可用于区分野生人参、林下山参和园参。与园参相比,林下山参皂苷含量和色谱指纹图谱与野生人参更接近,而野生人参、林下山参和园参之间的差异主要是由于生长周期的不同造成的。以此类推,我们从化学成分的角度来分析本研究中GSLS和MSLS各等同剂量间没有显著性差异的可能原因。首先,林下山参茎叶和园参茎叶不存在生长周期的不同,茎叶每年采收一次,与传统药用部位的采收期有明显不同;第二,此次研究用的是人参茎叶总皂苷提取物,其总皂苷含量相近并且达到了《中国药典》2020年版人参茎叶总皂苷标准,只是在部分单体化合物的化学组成和含量上的差异;最后,人参茎叶总皂苷提取物通过多靶点、多通路发挥药效,整体的药效结果没有显著性差异,但是发挥作用的机制可能是千差万别,需要后期的进一步研究验证。
综上所知,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性测定联合Ⅱ导联心电图分析对氯化钡致心律失常小鼠模型的预后和治疗具有重要意义,本研究也为后期不同生境人参茎叶资源在心律失常相关疾病上的利用提供理论依据。

