马铃薯StWRKY转录因子的克隆和生物信息学分析
刘子刚,田佩耕,王 宁,翟鑫娜,张云帅,刘毅强,武佳颖,田再民,魏 东,2
(1.河北北方学院,河北 张家口 075000;2.河北北方学院河北省农产品食品质量安全分析检测重点实验室,河北 张家口 075000)
【研究意义】马铃薯是全球第四大重要的粮食作物,马铃薯的生产受到多种环境胁迫的影响,如极端温度、水涝及高盐胁迫是影响植株生长发育的重要因素。随着分子生物学的发展,植物抗逆机理的研究逐渐步进入分子水平。转录因子(Transcription factor)又称反式作用因子,是一种DNA结合蛋白,它可以与基因5′端上游特定序列特异性结合[1]。它对目的基因的转录起着增强和阻遏的作用[2],因此对转录因子的研究是从分子层次上认识植物抗逆机制的基础。WRKY转录因子是高等植物中最大的转录因子家族之一,在植物响应非生物病害及非生物胁迫的调控途径中发挥着重要的作用[3]。【前人研究进展】WRKY蛋白结构基本含有1~2个WRKY结构域,该结构域约由60个高度保守的氨基酸残基组成,包括位于N端的WRKYGQK七肽序列和位于C端的锌指结构。因其位于N末端的WRKYGQK保守核心序列而得名,位于C端的序列由 C2H2或 C2HC 型锌指结构组成[4]。研究发现,WRKY基因在植物体内受许多胁迫因子诱导表达,且具有组织特异性[5-6]。WRKY转录因子能够结合目的基因W-box的WRKY结构域,W-box主要位于植物抗逆、损伤和衰老相关基因的启动子区[7-8],因此WRKY转录因子能够参与植物体内生物与非生物胁迫应答机制。经NaCl胁迫处理及qRT-PCR 显示,拟南芥根中有18个AtWRKY基因诱导表达[9],转录组分析表明水稻中的41个OsWRKY基因、拟南芥中的20个AtWRKY基因和油菜中的74个BnWRKY基因参与植物非生物胁迫应答机制,但其诱导表达模式存在差异,说明这些WRKY转录因子在各种逆境胁迫应答机制中发挥不同的生物学功能[10-11]。【本研究切入点】目前对WRKY转录因子的研究在多个模式植物中较多,但在马铃薯WRKY转录因子在非生物胁迫中的作用及下游蛋白的调控等方面研究较少。【拟解决的关键问题】本文从马铃薯中克隆获得StWRKY基因,对其进行生物信息学分析,并利用PCR分析在不同组织中的表达,进一步通过盐胁迫和干旱胁迫试验初步鉴定了StWRKY基因的功能,本试验初步阐明了StWRKY基因在胁迫应答中的作用,该研究对进一步认识马铃薯WRKY转录因子有着重要意义。
1 材料与方法
1.1 试验材料
冀张薯12号马铃薯组培苗。
1.2 试验方法
总RNA的提取和cDNA第一条链的合成: 取幼嫩的组培苗叶片0.5 g,采用黄国文等[12]的方法提取总RNA。以马铃薯总RNA为模版,参考诺唯赞cDNA第一链的合成说明书,加入3 μL的反转录酶,3 μL模板RNA (终浓度1500 ng),7 μL RT reaction buffer,加ddH2O定容至20 μL。然后进行离心后,于PCR仪中42 ℃,15 min。
马铃薯StWRKY和StWRKY6基因PCR扩增程序: ①马铃薯WRKY基因的引物设计。利用Primer 5.0软件设计引物。StWRKY-F的引物序列(5′-3′)为CTCTCCACTTTTACATTCTCAG;StWRKY-R的引物序列(5′-3′)为GCCTTACTAGGCATTGAAAG。②马铃薯WRKY基因PCR扩增程序。扩增总体积为50 μL,其中2×Vazyme Lamp Master Mix 25 μL,模板DNA 1 μL,StWRKY-F(10 μmol/L) 2 μL,StWRKY-R (10 μmol/L) 2 μL,ddH2O 20 μL。PCR扩增程序为94 ℃下预变性5 min;然后进入循环,94 ℃变性30 s,在50 ℃ 30 s,72 ℃ 30 s,持续35个循环后;将其在72 ℃下延伸7 min,最后4 ℃保存。
马铃薯WRKY基因扩增产物的检测:利用1%琼脂糖凝胶电泳的方法进行检测。
生物信息学分析:使用NCBI完成WRKY基因的ORF查找和氨基酸序列的分析;用ProtParam工具完成蛋白分子量和理论等电点的分析;用DNAMAN软件进行蛋白同源性比对并构建系统进化树;用Expasy工具完成蛋白疏水性分析;使用TMHMM Server完成蛋白质跨膜结构域预测;使用SOPMA构建蛋白质二级结构;用Expasy工具构建蛋白质三级结构。
实时定量PCR:利用 Primer Premier 5.0 设计的荧光定量上游引物和下游引物,引物序列如下:StWRKY-F:5′-CTAATGGCAAGCATGGAAACTCCAA-3′,StWRKY-R :5′-CTTGGCTCCTTGTTTGGAAAGCATA-3′;用反转录得到cDNA 稀释10倍作为荧光定量模板,内参基因为Actin,引物序列如下:Actin-F:5′-CGGTATTGTGTTGGACTCTGGTGAT-3′,Actin-R:5′-CAGCAAGGTCAAGACGGAGTATGG-3′。参照Trans Start Top Green qPCR Super Mix (Transgen)说明进行RT-qPCR分析。采用 2-ΔΔCT方法分析基因的相对表达量。
2 结果与分析
2.1 StWRKY基因的克隆和编码氨基酸序列分析
以马铃薯cDNA为模板进行PCR扩增,电泳结果显示在747 bp处有目标条带(图1)。该基因共编码了248个氨基酸(图2)。

图1 StWRKY基因PCR扩增产物Fig.1 PCR amplification product of StWRKY gene

图2 StWRKY基因cDNA序列及编码氨基酸序列Fig.2 StWRKY gene cDNA sequences and coding amino acid sequences
2.2 StWRKY蛋白序列比对和进化树的构建
在NCBI中利用BLAST查找其他物种WRKY基因编码的同源蛋白序列进行比对,马铃薯WRKY基因与潘那利番茄(Solanumpennellii)(XP015075730.1)同源性最高达到了97.1%;中华辣椒(Capsicumchinense)(PHU02980.1)同源性达到了79.1%;毛酸浆(Physalispubescens)(AZB50357.1)同源性达到了79.1%;与风铃辣椒(Capsicumccatum)(PHT34361.1)、茸毛烟草(Nicotianatomentosiformis)(XP009615508.1)、红梅(Prunusmume)(XP008222197.1)的同源性分别达到了82.4%、67.2%、62.2%。通过DNAMAN构建系统进化树,如图3所示。该进化树被分为2组(GroupsⅠ和GroupsⅡ),GroupsⅠ有7个WRKY蛋白(StWRKY、SlWRKY、SpWRKY、NtWRKY、PpWRKY、CbWRKY、CcWRKY),GroupsⅡ有一个WRKY蛋白(PmWRKY),StWRKY蛋白和GroupsⅠ中的SlWRKY蛋白相似度最高达到97.1%,且与同属茄科的SlWRKY、SpWRKY处于同一分支;反之与烟草,辣椒的系统发育距离较远[13]。通过DNAMAN构建系统进化树,其中马铃薯WRKY基因与番茄WRKY基因在同一支上,亲缘关系最近,其次是烟草、毛酸浆、辣椒,为茄科植物在一个大分支内;红梅在另一个分支内。马铃薯WRKY基因与番茄WRKY基因在同一支上,亲缘关系较近。
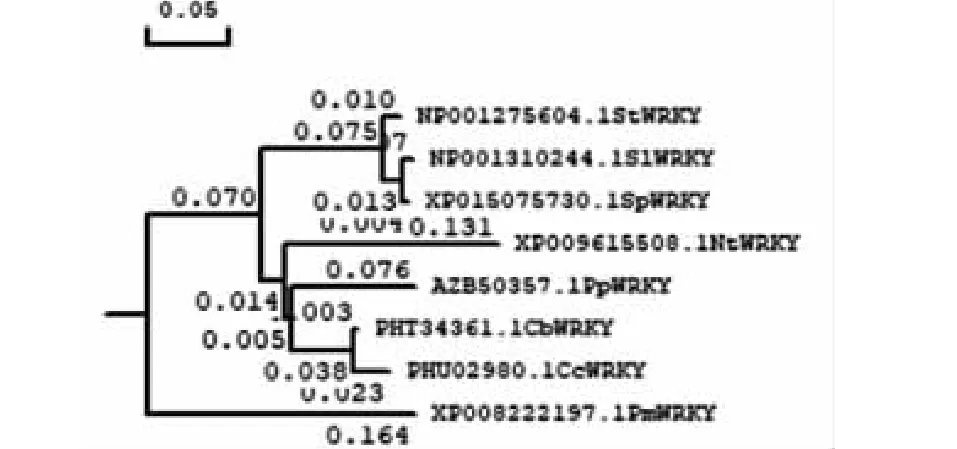
图3 StWRKY的系统进化树Fig.3 Phylogenetic tree of StWRKY
2.3 StWRKY的蛋白分子量和理论等电点分析
通过ProtParam软件(网址:http://www.expasy.org/tools/protparam.html)在线预测并分析StWRKY蛋白质的性质,分析结果表明StWRKY蛋白共有172个氨基酸,分子量19 921.58,理论等电点9.22,带负电残基总数21,带正电残基总数28,不稳定系数40.56,为不稳定蛋白。
2.4 StWRKY的蛋白亲水性和疏水性分析
利用Expasy工具(http://au.expasy.ch/tools/protscale.html)中的ProtScale软件在线分析氨基酸的亲水以及疏水性。StWRKY蛋白质的亲水性分析,由图4可知,StWRKY平均亲水系数为-0.836,为亲水性蛋白。

图4 StWRKY蛋白的亲水性分析Fig.4 Hydrophilicity analysis of StWRKY protein
2.5 StWRKY蛋白质二级结构和三级结构预测
通过SOPMA(网址:http:pbil.ibcp.fr/)进行蛋白质二级结构的预测。如图5所示,StWRKY蛋白质二级结构以无规曲线(69个)为主,占40%;其次为α-螺旋(64个),占37.3%;伸展链(26个),占15.1%;β-折叠(13个),仅占7. 6%。
通过在线网址(http://www.expasy.org/)进行蛋白质三级结构的预测,获得StWRKY蛋白质三级结构图,从图6可以看出,具有5个折叠一个螺旋。

图5 StWRKY蛋白的二级结构预测Fig.5 Secondary structure prediction of StWRKY protein

图6 StWRKY蛋白的三级结构预测Fig.6 Prediction of tertiary structure of StWRKY protein
2.6 StWRKY蛋白序列跨膜区预测
通过TMHMM工具(在线网址:www.cbs.dtu.dk/services/)进行蛋白序列跨膜区预测图,由图7显示,StWRKY蛋白的紫色线的概率趋近于1,属于非跨膜蛋白。

图7 StWRKY蛋白质跨膜结构预测Fig.7 Prediction of WRKY protein transmembrane structure in potato
2.7 StWRKY在不同组织部位的表达模式分析
利用实时荧光定量PCR技术分析StWRKY基因分别在根、茎、叶中的表达情况。由图8可知,该基因的表达量由高到低依次是叶、根、茎。
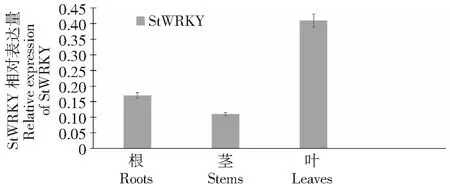
图8 StWRKY基因在不同组织部位的表达模式Fig.8 Expression pattern of StWRKY in different parts
2.8 StWRKY在胁迫下的表达分析
利用RT-qPCR分析StWRKY低温能诱导的表达情况。由图9可知,处理4 h后,StWRKY相对表达量明显增加,约为对照的2.5倍,在处理6、8 h后,相对表达量没有明显变化,说明StWRKY在低温诱导的早期响应这一生理过程。

图9 低温胁迫下StWRKY基因表达分析Fig.9 Expression analysis of StWRKY gene under low temperature stress conditions

图10 盐胁迫下StWRKY基因表达分析Fig.10 Expression analysis of StWRKY gene under salt stress conditions
利用RT-qPCR分析StWRKY在盐胁迫的诱导下的表达情况。由图10可知,处理3 h后StWRKY的相对表达量急剧上升,约为对照的6倍,处理7 h后,相对表达量到达高峰,在处理5、7、9 h后,相对表达量没有明显变化,说明StWRKY在盐诱导的早期响应这一生理过程。
3 讨 论
WRKY转录因子家族是广泛存在于植物中的一类重要蛋白,其可以在很多逆境胁迫中发挥作用减少逆境对植物带来的伤害,因此对WRKY家族的研究至关重要。本试验对马铃薯StWRKY进行了生物信息学分析。StWRKY蛋白质的二级结构以无规曲线为主,StWRKY蛋白质的二级结构预测比例为无规则卷曲>α-螺旋>伸展链>β-折叠,与番茄SpWRKY1、SpWRKY2、SpWRKY3的二级结构的比例遵循相似[14]。StWRKY基因的平均亲水系数为-0.836,为亲水蛋白,亲水蛋白中含有大量亲水氨基酸,而过表达一些亲水蛋白可以增强植株耐受干旱、低温、高盐等不利环境影响的能力[15]。
利用RT-qPCR分析发现,马铃薯StWRKY在低温处理4 h后表达量显著增加,且在处理6 h后表达量达到峰值,番茄WRKY基因在低温处理2 h后表达量达到峰值,与马铃薯两类WRKY基因的表达量均为先升后降[16],烟草NtWRKY8在低温处理6 h后表达量达到峰值,这说明WRKY基因在低温诱导的早期响应这一过程[17],也有研究表明WRKY基因在低温诱导时表达量呈现升—降—升的规律[18]。利用RT-qPCR分析发现,StWRKY在盐胁迫处理3 h后表达量显著增加,玉米ZmWRKY53基因在盐胁迫处理12h表达量达到峰值,与马铃薯StWRKY基因的表达量为先升后降,这与上述面对低温温胁迫时表达量变化较为一致[18]。通过同源蛋白比对并构建系统进化树(图3),发现马铃薯StWRKY基因与茄科作物中的番茄同源性最高,番茄SlWRKY23通过上调SlRD22和SlDREB2A的表达量提高番茄耐盐性[19],番茄转入SlWRKY53基因的植株对盐胁迫的抗性明显强于野生型[20],研究表明番茄WRKY基因具有抵抗非生物胁迫的能力,能对低温、干旱、高盐胁迫具有耐受性[21]。
实时荧光定量PCR结果表明,马铃薯StWRKY在叶和根中的表达相对较高,番茄SlWRKY23在变色期果实中的表达最高,在茎中的表达较低,根和叶比茎中的表达分别高5和7倍,这与马铃薯StWRKY基因的表达较为一致[19],大豆GmWRKY28-like在根、种子中表达量较低,在叶、花和茎尖分生组织表达量较高[22],玉米ZmWRKY53在根、叶中表达量较高[18],番茄SlWRKY53在成熟茎中的表达最高,在幼茎和幼根中的表达相对较少[20]。WRKY基因在植株不同器官间表达差异与其生物学功能有关,马铃薯StWRKY转录因子在叶中的表达较高可能与其通过调控脱落酸参与植物非生物胁迫应答有关,脱落酸是一种植物激素,可以调节植物面对非生物胁迫时的反应,研究发现脱落酸受体ABAR位于细胞质的C端能够和数个WRKY转录因子发生相互作用[23],拟南芥WRKY31受脱落酸诱导表达[24],过表达拟南芥OsWRKY45的突变体植株经水分胁迫后能够关闭更多气孔,降低植株体内水分减少的速度,使水分能够维持更好地平衡[25],WRKY57通过提高ABA水平增加拟南芥的耐旱性[26],另一方面也有可能通过改善适应性氧化物来提高植株的抗逆性[27]。
4 结 论
马铃薯StWRKY基因受低温胁迫和盐胁迫诱导表达,番茄WRKY44和WRKY1基因在盐胁迫方面起重要作用[28],SpWRKY6转录因子有提高抗烟草疫霉的功能[29],综上所述,初步证明StWRKY基因在马铃薯面对各种逆境胁迫时可以发挥重要作用,为了更好地揭示StWRKY转录因子的具体功能,未来还需进一步研究。

