靶向鞘氨醇激酶1的Jaspine B类似物的合成及抗肿瘤活性研究
王 悦, 耿双双, 陈海蛟, 智 英, 牟艳玲,姚庆强,刘 波
(山东第一医科大学(山东省医学科学院) 药学与制药科学学院, 山东 济南 250117)
鞘磷脂是细胞膜的重要成分,它可被多种生物酶催化产生神经酰胺(Ceramide, Cer)、鞘氨醇(Sphingosine, Sph)和鞘氨醇-1-磷酸(Sphingosine 1-phosphate, S1P)[1]。其中Cer 和 Sph 作为负调节因子能够抑制细胞生长和促进细胞凋亡,而S1P则可以促进细胞增殖[2]。鞘氨醇激酶(Sphingosine kinases, SphKs) 作为一种催化酶,它可以通过磷酸化 Sph 产生 S1P 来促进细胞增殖[3]。哺乳动物体内有两种SphKs,即SphK1和SphK2,它们在结构和功能上存在一定差异[4]。抑制SphK1活性将导致肿瘤细胞中Sph和Cer水平升高,而S1P水平降低,导致细胞生长抑制或凋亡。因此,SphK1的表达和活性与肿瘤细胞增殖密切相关。 一般认为SphK1的主要生物学功能是促进细胞存活和增殖,而SphK2主要与细胞凋亡有关[5]。尽管这一观点一直存在争议,但毫无疑问,抑制SphK1活性在癌症、炎症等疾病的治疗中具有重要地位[6]。
目前,研究人员已经发现并合成了多种SphK1抑制剂,如PF-543、jaspine B、 2-epi-jaspine B等(图1A)[7]。天然产物一直是药物和先导化合物的重要来源,而 Jaspine B 是一种从冲绳海绵 Pachastrissa sp和Jaspis sp中分离出来的天然存在的脱水植物鞘氨醇衍生物[8]。我们团队利用生物等排原理将四氢呋喃环替换为四氢吡咯环,对2-epi-jaspine B进行了结构修饰和活性研究,发现YHR5、YHR7和YHR17(图1A)对 SphK1具有较强的抑制活性并对肿瘤细胞有理想的抗增殖作用[9]。基于YHR5和YHR7的结构,本文通过改变疏水末端环烷烃的大小来设计、合成CHJ1(图1B)。通过分析CHJ1、YHR5、YHR7的活性结果来评估 2-epi-jaspine B 衍生物的疏水端对 SphK1 的影响。
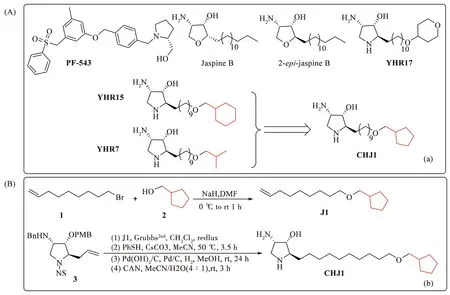
图1 SphK1 抑制剂及 CHJ1的合成路线。 (A) SphK1 抑制剂的结构。 (B) CHJ1的合成路线Fig.1 SphK1 inhibitors and the synthesis route of CHJ1. (A) Structures of SphK1 inhibitors. (B) The synthesis route of CHJ1
1 实验
1.1 仪器及试剂
所有合成试剂无需进一步纯化可直接使用。9-溴-1-壬烯 (CasNo: 89359-54-6) 和环戊烷甲醇 (CasNo: 3637-61-4) 购自 Innochem-Adamas,所有溶剂均为分析纯。YHR5、YHR7和化合物3由本课题组提供,数据见已报道的文献[9]。使用 Bruker Avance DRX600 仪器以四甲基硅烷 (TMS) 作为内标记录核磁共振氢谱和核磁共振碳谱。
1.2 CHJ1的合成
起始原料化合物3由本课题组参考Fujiwara等报道的路线合成[10]。在化合物3的基础上,我们进行了化合物CHJ1的合成,长链末端烯烃(J1)的合成基于Ohno等报道的方法[11]。在0 ℃和氮气保护下,向环戊基甲醇(4.0 moL)的DMF(7 mL)溶液中加入NaH(4.0 moL)。搅拌反应30 min后,滴加9-溴-1-壬烯(2.0 moL), 将反应混合物加热至室温并搅拌1小时。 反应完成后,用饱和氯化铵淬灭,乙醚萃取。萃取液依次用 H2O 和饱和 NaCl 溶液洗涤,然后用无水 Na2SO4干燥。有机相浓缩后,所得粗品经硅胶柱层析(石油醚∶乙酸乙酯= 40 ∶ 1)纯化得到J1。化合物CHJ1的合成方法与前期报道的YHR系列化合物的合成方法相同。在Grubbs2nd催化剂条件下,化合物3与J1发生烯烃复分解反应,在2-位连接疏水长链,然后通过去除四氢吡咯烷上的保护基团得到目标化合物CHJ1[9]。
1.3 SphKs 的抑制活性
参考文献方法进行化合物对 SphKs 的抑制活性测定[12]。使用PF-543(从 Selleck 购买)作为阳性对照。 反应体系为50 μL,包括激酶缓冲液(pH = 7.4,组成:40 mmol·L-1Tris、10 μmol·L-1ATP、0.1 g/L BSA、10 mmol·L-1MgCl2、1 mmol·L-1DTT)、10 μmol·L-1ATP、SphKs、Sph 底物和不同浓度的YHR5、YHR7、CHJ1(0.01、0.1、1、10 和 100 μmol·L-1)。 所有酶促反应均在 30 ℃ 下进行 40 min。 然后加入 ATP 测试试剂,并将混合物在室温下孵育5 min。使用微孔板分光光度计(AD 340,Beckman,USA)立即测量。最后使用Graphpad Prism 5进行数据分析。
1.4 MTT细胞活性测定
以顺铂为阳性对照,采用MTT法测试化合物CHJ1、YHR5、YHR7对5个细胞系22RV1、LOVO、A375、HepG2、HCFB(购自中国上海中科院细胞库)的抗增殖活性。 将CHJ1、YHR5、YHR7溶解于纯DMSO中,并用培养基稀释至10 mmol·L-1储备溶液中。在96孔板中以6×103/孔的密度接种5个细胞系。分别加入CHJ1、YHR5、YHR7(0.01、0.1、1、10、100 μmol·L-1)并在 37 ℃ 下孵育48 h。然后,在96孔板的每个孔中加入 10 μL MTT 溶液(PBS 中 5 g/L)。 4 h后,在酶标仪(Bio-Rad Laboratories)中在 570 nm 处读取每个孔的OD值,使用抑制率(%)= [1-供试品OD值/阴性对照组OD值]×100%公式,计算IC50值。
1.5 细胞周期
将 A375 细胞以每孔 1×106个细胞的密度接种在六孔板中,并用CHJ1(0、1、0.3、1、3 μmol·L-1)和对照组在 37 ℃下孵育 36 h。收集细胞并在 2 mL离心管中离心。然后去除上清液,用冷PBS洗涤细胞3次。然后在 -20 ℃下用 70%预冷乙醇固定细胞。然后用 RNase A 处理 A375 细胞并用碘化丙啶 (PI) 染色。最后,使用流式细胞仪(FACS Calibur,BD Biosciences)分析悬浮细胞。
1.6 细胞凋亡
人黑色素瘤细胞(A375)在 37 ℃, 5%的 CO2培养箱内培养 48 h,取指数生长期的细胞,用 0.25%胰酶消化,将密度为 1×106个细胞/孔的 A375细胞接种到六孔板的每个孔中,每孔 2 mL,放在 5%的 CO2孵箱内培养 24 h后给药。然后用CHJ1(0.1、0.3、1、3、10、33 μmol·L-1)和顺铂(10 μmol·L-1)处理细胞 48 h。未经处理的细胞作为对照组。收集细胞于2 mL离心管中并在 4 ℃下离心 5 min。然后去除上清液,并用 1 mL的冷 PBS洗涤细胞3次,再加入200 uL PBS将细胞打散。随后,缓慢加入 5 uL Annexin-V-异硫氰酸荧光素(FITC)染料将细胞在结合缓冲液中避光染色 15 min。然后再次在 4 ℃下离心 5 min以去除上清液,加入10 uL PI在 37 ℃ 避光染色 30 min,用 200目尼龙膜过滤到流式管中,使用流式细胞仪(FACSCalibur BD,美国)评估凋亡细胞。使用ModFit Lt Mac V3.0对数据进行分析。
2 结果与讨论
2.1 合成化合物的结构表征
(壬-8-烯-1-丙氧基)甲基)环戊烷(J1):无色油状物,产率72%。HRMS (ESI) calcd. for C15H28O (M+H)+: 225.221 8, found: 225.215 3。1H NMR (CDCl3, 600 MHz)δ: 5.81 (ddt,J= 16.9, 10.2, 6.7 Hz, 1H), 4.99 (dq,J= 17.1, 1.6 Hz, 1H), 4.93 (ddd,J= 10.2, 2.1, 1.1 Hz, 1H), 3.40 (t,J= 6.7 Hz, 2H), 3.26 (d,J= 7.2 Hz, 2H), 2.15 (m, 1H), 1.98~2.09 (m, 2H), 1.67~1.80 (m, 2H), 1.47~1.64 (m, 6H), 1.17~1.43 (m, 10H)。13C NMR (CDCl3, 150 MHz)δ: 139.18, 114.13, 75.57, 71.08, 39.48, 33.80, 29.73, 29.63 (2C), 29.34, 29.10, 28.89, 26.15, 25.41 (2C)。
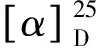
2.2 激酶抑制活性
为了探索疏水侧链的大小对激酶活性的影响,我们测试了YHR5、YHR7和新合成的化合物CHJ1对 SphK1/2 的活性。表1所示为PF-543(阳性对照)和2-epi-jaspine B衍生物CHJ1、YHR5、YHR7对SphK1/2活性的影响。从整体数据来看,烷基取代大小不同的三种化合物CHJ1、YHR5、YHR7的激酶活性没有显着差异。新合成的化合物CHJ1的激酶活性相比之前化合物活性略有提高。(IC50值在6.59 μmol·L-1左右)。
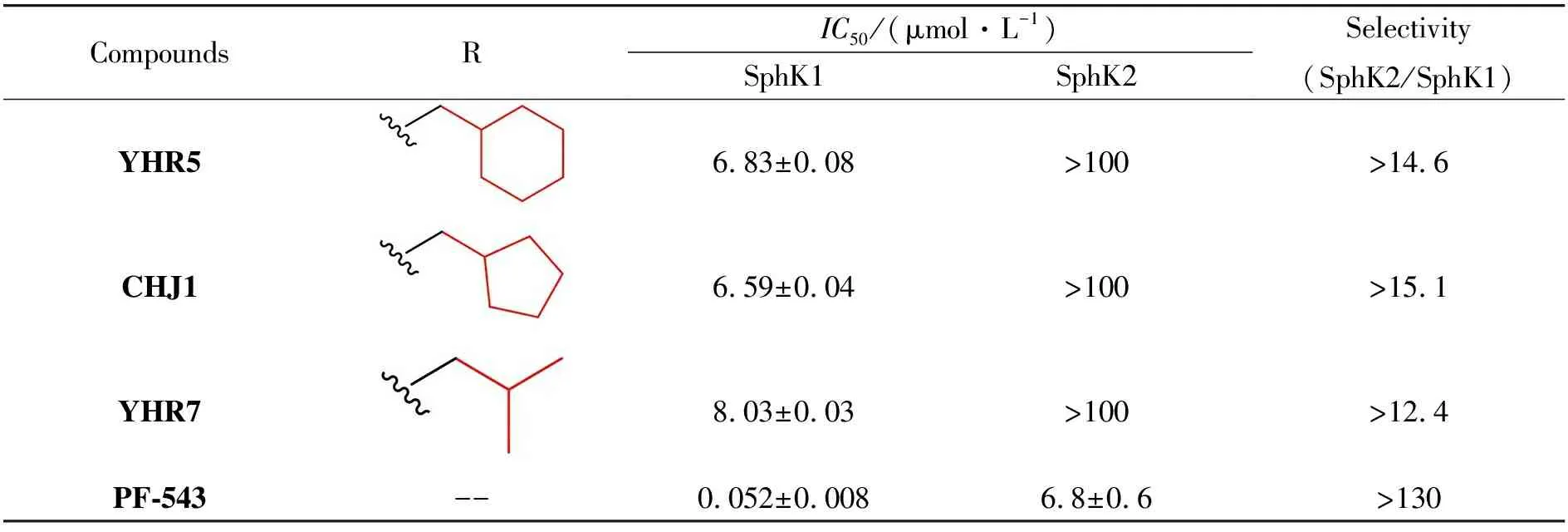
表1 CHJ1、YHR5 和 YHR7 对SphKs活性的影响(数值以Means ± SD表示)
2.3 细胞增殖试验
测定了 2-epi-jaspine B 衍生物CHJ1、YHR5、YHR7对4种肿瘤细胞的抗增殖活性。 此外,还测试了化合物对正常人心脏成纤维细胞 (HCFB) 的影响,以评估它们对正常细胞的毒性,结果见表2。结果表明,CHJ1、YHR5和YHR7对正常细胞系HCFB没有明显的细胞毒性(IC50> 100 μmol·L-1)。 除了YHR7对 HepG2 的抗增殖作用相对较小外,所有化合物对 22RV1、LOVO、A375 均显示良好的抗增殖作用。值得注意的是,这三种化合物在 22RV1 细胞中均表现出比顺铂更好的抑制活性。此外,CHJ1对A375的抗增殖作用(IC50= 0.87 μmol·L-1)也优于阳性药物顺铂(IC50= 2.1 μmol·L-1),具有进一步研究的价值。
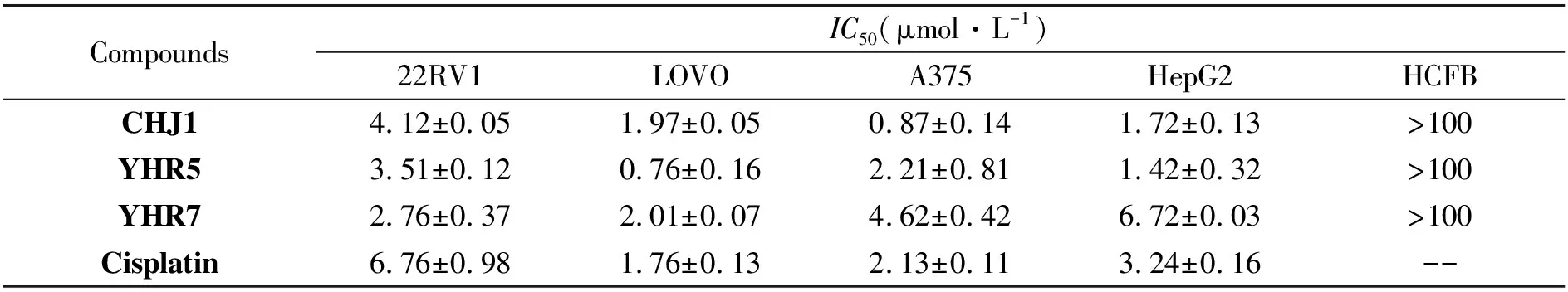
表2 CHJ1、YHR5 和 YHR7 在体外的抗增殖作用(数值报告为平均值±SD)
2.4 CHJ1在G1期阻断细胞周期
表2中的数据显示CHJ1对A375细胞系具有显著的抗增殖活性。因此,我们测定了它对 A375 细胞周期的影响。用CHJ1(0.1、0.3、1、3 μmol·L-1)或对照处理 48 h后,A375 细胞用 PI 染色并使用流式细胞术进行分析。如图2所示,随着CHJ1浓度的增加,G1期细胞与对照组相比(59.27%)大量积累,从61.03%(0.1 μmol·L-1)到75.36%(3 μmol·L-1)。同时,S期细胞从27.13%下降到11.15%,G2期细胞从11.81%上升到13.48%。基于
以上结果,CHJ1对细胞周期产生阻滞作用,将A375细胞阻滞于G1期,并呈剂量依赖性。
2.5 CHJ1阻断细胞凋亡
为了探索细胞死亡的机制,A375细胞用CHJ1(0.1、0.3、1、3、10、33 μmol·L-1)和顺铂(10 μmol·L-1)处理48 h,然后通过Annexin V-FITC/PI检测 FACS测定。如图3所示,随着CHJ1浓度的增加,A375 细胞的凋亡率显著增加,在 48 h 时内凋亡率由 18.03% 升至 67.1%。同时A375细胞凋亡率与CHJ1浓度呈剂量依赖性正相关。
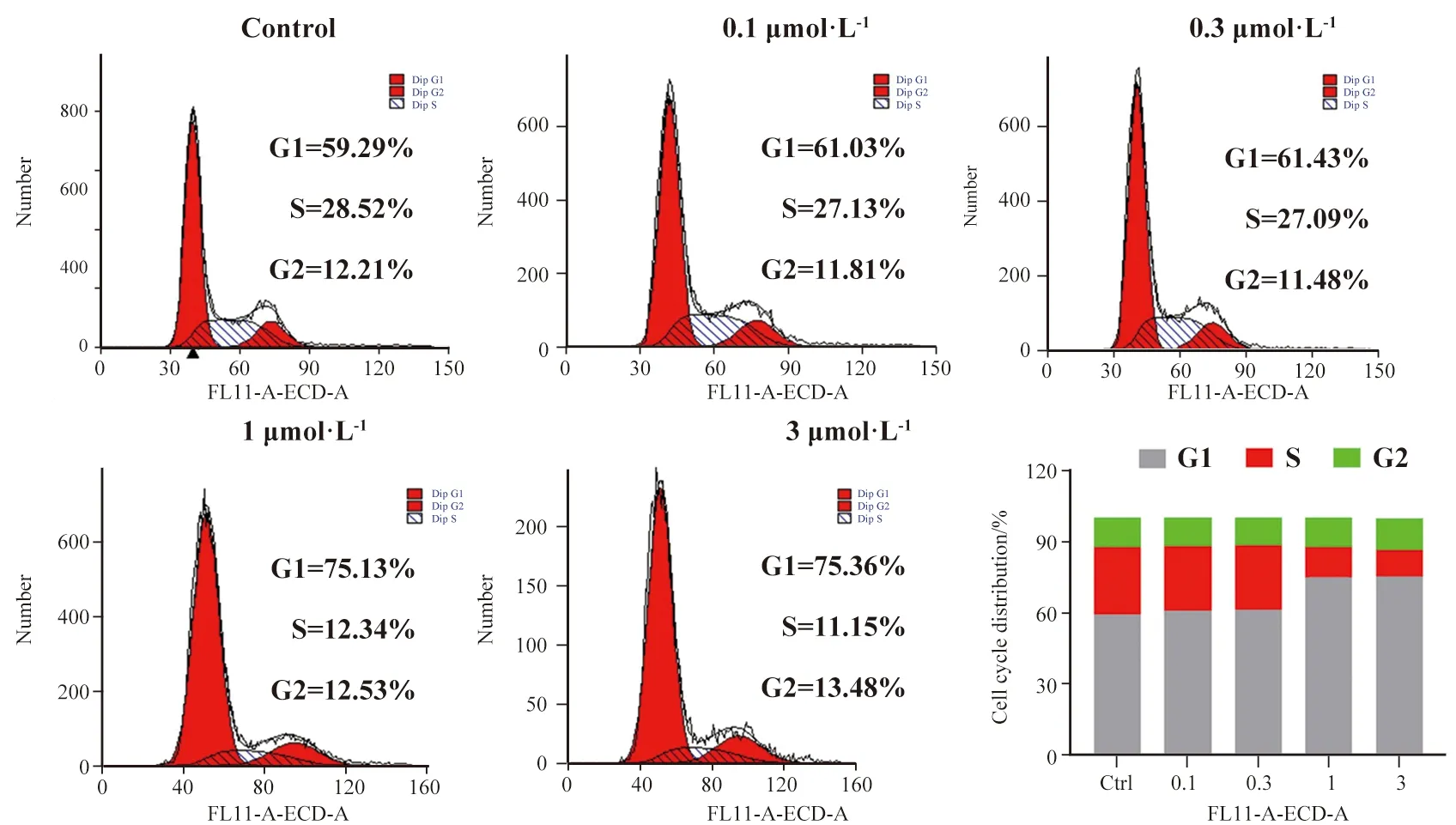
图2 化合物 CHJ1对A375细胞的影响(条形图显示了 G1、S 和 G2 期细胞的百分比 (%))Fig.2 Effect of compound CHJ1 on A375 cells. (The bar chart showed the percentage (%) of the cells in the G1, S and G2 phases)
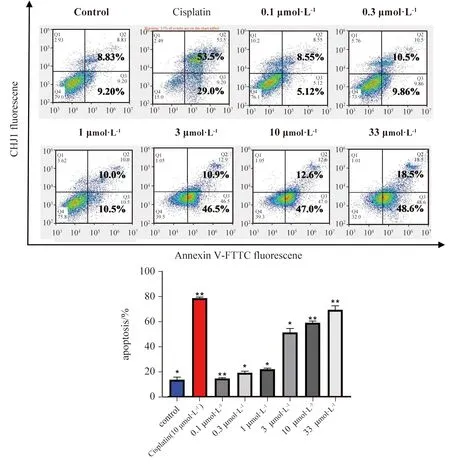
图3 化合物 CHJ1对 A375 细胞凋亡的影响(柱状图显示了重复实验的总凋亡细胞百分比的统计数据**P < 0.05,*P < 0.01,与对照组相比)Fig.3 Effect of compound CHJ1 on apoptosis of A375 cells (The bar chart shows the statistics of total apoptotic cellpercentages from duplicate experiments.**P<0.05, *P<0.01, versus the control group)
3 结论
在前期的研究中,我们对2-epi-jaspine B进行了结构修饰和抗癌活性研究,结果表明,母核结构中的四氢呋喃环被四氢吡咯烷取代后,2-epi-jaspine B衍生物的活性增强。在本研究中,我们设计、合成了侧链端基为环戊烷的衍生物CHJ1,并进行生物活性研究,测定了CHJ1、YHR5、YHR7对激酶的抑制活性,并通过与前期报道的化合物进行比较来评估疏水侧链的大小对其活性的影响。结果表明,环状烷基疏水末端的微小改变对化合物的激酶活性有所提高,而且所合成的2-epi-jaspine B衍生物依旧保持着高抗癌活性。除此之外,22RV1、A375、HepG2细胞活性研究表明,化合物CHJ1比顺铂的细胞抑制效果更好,具有更理想的抗癌活性,表明CHJ1有望成为有效的SphK1 抑制剂,这对接下来的成药性研究具有一定意义。

