氮掺杂石墨烯量子点的制备及其在细胞成像中的应用
刁娟娟, 王婷婷, 李 莉*
(1. 新疆医科大学 中心实验室,新疆 乌鲁木齐 830011; 2. 新疆医科大学 药学院, 新疆 乌鲁木齐830017)
石墨烯量子点(Graphene quantum dots, GQDs)是由二维材料石墨烯衍生出来的零维材料,具有优异的光学性质,在细胞成像[1]、分析检测[2]、光电化学、生物传感[3]、光催化等方法有良好的应用前景。石墨量子点的合成方法主要分为自上而下法(Top-down synthetic route)和自下而上法(Bottom-up synthetic route)两类[4]。自上而下法利用特殊的化学手段将石墨类材料剥离并剪切成石墨烯量子点,主要有电化学法、酸氧化法、溶剂热法、微波分解法、电子束刻蚀等方法,但产物产率和荧光量子产率都较低,严重制约该方法的实际应用[5]。自下而上法是通过分子前驱体来合成石墨烯量子点,主要有水热法、热解法、溶液化学法、热解多环芳烃法、化学气相法、富勒烯开笼法等[6]。这种方法易于调控石墨烯量子点的形貌和尺寸,从而克服了与自上而下的方法相应的非选择性问题。其中采用水热法制备石墨烯量子点具有操作简单、条件可控、稳定性好的优点。石墨烯量子点的荧光特性容易受到其表面化学状态的影响。表面掺杂化可调节石墨烯量子点电子结构和表面化学特征,从而引起石墨烯量子点的光致发光强度和发射波长的变化,主要为氮元素、硫元素、硼元素、磷元素的掺杂,其中以氮元素最为常用[7-8]。在掺杂剂中,氮被认为是石墨烯量子点中杂原子掺杂的极好候选者,因为氮原子与碳原子大小相当,并且氮原子的五个价电子可与碳原子形成强价键,从而提高荧光量子产率[9-10]。
掺杂型石墨烯量子点因具有良好的光学性能和生物相容性,合适的细胞膜渗透性和高稳定性等诸多优点,已成为体外和体内成像研究的有力工具[11-12]。目前氮掺杂石墨烯量子点已用于细胞成像[13-14]、体内生物成像[7]、癌细胞诊断[15]、活体动物中深层肿瘤组织靶向成像[16]、细菌荧光标记等研究中。
近年来因合成过程简单且荧光量子产率高,柠檬酸已成为采用自下而上的碳化路线合成石墨烯量子点最常用的分子前驱体[17]。柠檬酸和胺可通过热解法、水热法或微波辅助法可制备氮掺杂石墨烯量子点[18]。在本文中,以柠檬酸为碳源,乙二胺为氮源,通过一步水热法合成出一种高荧光量子产率的氮掺杂石墨烯量子点,具有低毒性和良好的生物相容性,进行细胞成像研究。
1 实验部分
1.1 试剂与仪器
柠檬酸购自天津盛奥化学试剂有限公司,乙二胺购自天津富宇精细化工有限公司,硫酸奎宁购自上海蓝季生物,均为分析纯。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐购自美国MP Biomedicals公司。
荧光分光光度计(RF-5301,日本岛津);紫外-可见分光光度计(UV2700,日本岛津);傅立叶变换红外光谱仪(IRPrestige-21,日本岛津);透射电子显微镜(JEM123型,日本电子株式会社);电子分析天平(AB-135S,梅特勒-托利多);激光共聚焦显微镜(C2,日本尼康);反应釜(KH-25,上海羌强仪器设备有限公司);酶标仪(1510,美国赛默飞世尔)。
1.2 氮掺杂石墨烯量子点(N-GQDs)的制备
称取0.21 g柠檬酸,向其中加入0.18 g乙二胺,剧烈搅拌混合后,定容到5 mL。将混合溶液转移到25 mL的反应釜中160 ℃下加热4 h,然后冷却至室温后得到氮掺杂石墨烯量子点(N-GQDs)。氮掺杂石墨烯量子点合成的反应原理见图1。在柠檬酸的缩合反应中有效地产生五元环稠和2-吡啶酮化合物,该化合物作为主要中间体在氢键的作用下自组装成超分子聚集体,表现出光致发光的高荧光量子产率[20-21]。

图1 N-GQDs合成的示意图Fig.1 Schematic illustration of the synthesis of N-GQDs
1.3 细胞毒性检测
通过细胞活性比色法(MTT法)检测氮掺杂石墨烯量子点的细胞毒性。将长至对数期的Hela细胞用胰蛋白酶消化完成后得到混悬细胞,将细胞加至血球计数板上,用倒置显微镜计数。通过反复调整细胞浓度,使细胞浓度在5×104/ mL,按1×104/ 孔接种至96孔培养板内,每孔200 μL,置于细胞培养箱中(37 ℃,5% CO2)培养24 h,待细胞贴壁后用终浓度分别为0、10、20、50、100、200、500、1 000、2 000、5 000 mg/L N-GQDs溶液替代原来的培养基,培养24 h以后,加入MTT溶液20 μL,培养4 h后,吸去培养液,加入DMSO溶液150 μL,用酶标仪测量570 nm处各孔的吸光度值。每个浓度设置6个复孔,实验重复3次。计算细胞存活率,按以下公式(1)计算:
cellviability(%)=(ODtreated/ODcontrol)×100%
(1)
其中ODtreated表示加入N-GQDs的OD值,ODcontrol为没有加入N-GQDs的空白培养液的OD值。
1.4 细胞成像
将长至对数期的HeLa细胞用胰蛋白酶消化完成后,得到细胞混悬液,用完全培养液稀释,使细胞浓度在5×104/mL,在玻底皿中分别加入600 μL细胞,待细胞粘附后,再加入900 μL完全培养基,培养箱中培养24 h,吸去培养液,再加入500 mg/L N-GQDs 1 mL,培养24 h,PBS清洗2次,洗去没有进入细胞的N-GQDs,激光共聚焦显微镜下观察细胞形态及荧光成像情况。
2 结果与讨论
2.1 N-GQDs制备影响因素考察
2.1.1 加热时间的考察
对于脱水聚合反应,加热时间的长短对聚合程度有一定影响,为了探究制备过程中加热时间对N-GQDs光致发光的影响,考察加热时间为2、3、4、5、6 h时,N-GQDs的荧光量子产率的变化,见图2(a)。随着加热时间的增加,荧光量子产率不断增加,当加热时间为4 h时,石墨烯量子点的荧光量子产率最高,加热时间较短时,柠檬酸与乙二胺的聚合反应才开始,N-GQDs还没有完全合成;而时间较长时,可能会发生完全的碳化聚合,量子点尺寸增大,生成的石墨烯较多而导致荧光量子产率降低。所以加热4 h反应得出的N-GQDs荧光量子产率最高,其把吸收的光转化为荧光的能力最强。
2.1.2 加热温度的考察
加热的温度对于柠檬酸和乙二胺聚合的程度是有很大影响的,考察加热温度为140、150、160、180 ℃时,N-GQDs的荧光量子产率变化,见图2(b)。温度升高,增加了原材料柠檬酸和乙二胺脱水缩合的反应速率,生成大量小尺寸的N-GQDs,但高温下,小尺寸的N-GQDs又会聚合生成大尺寸的N-GQDs,荧光量子产率降低,因此选择加热的温度为160 ℃。
2.1.3 反应物加入量的考察
反应物的加入量影响N-GQDs的荧光量子产率。考察反应中柠檬酸(CA)与乙二胺(EDA)的物质的量之比分别为1∶1、1∶2、1∶3、1∶4和1∶5时,N-GQDs的荧光量子产率变化,见图2(c)。随着乙二胺的加入量增多,荧光量子产率先增加后减少,当反应物的物质的量之比为1∶3时,荧光量子产率最大。
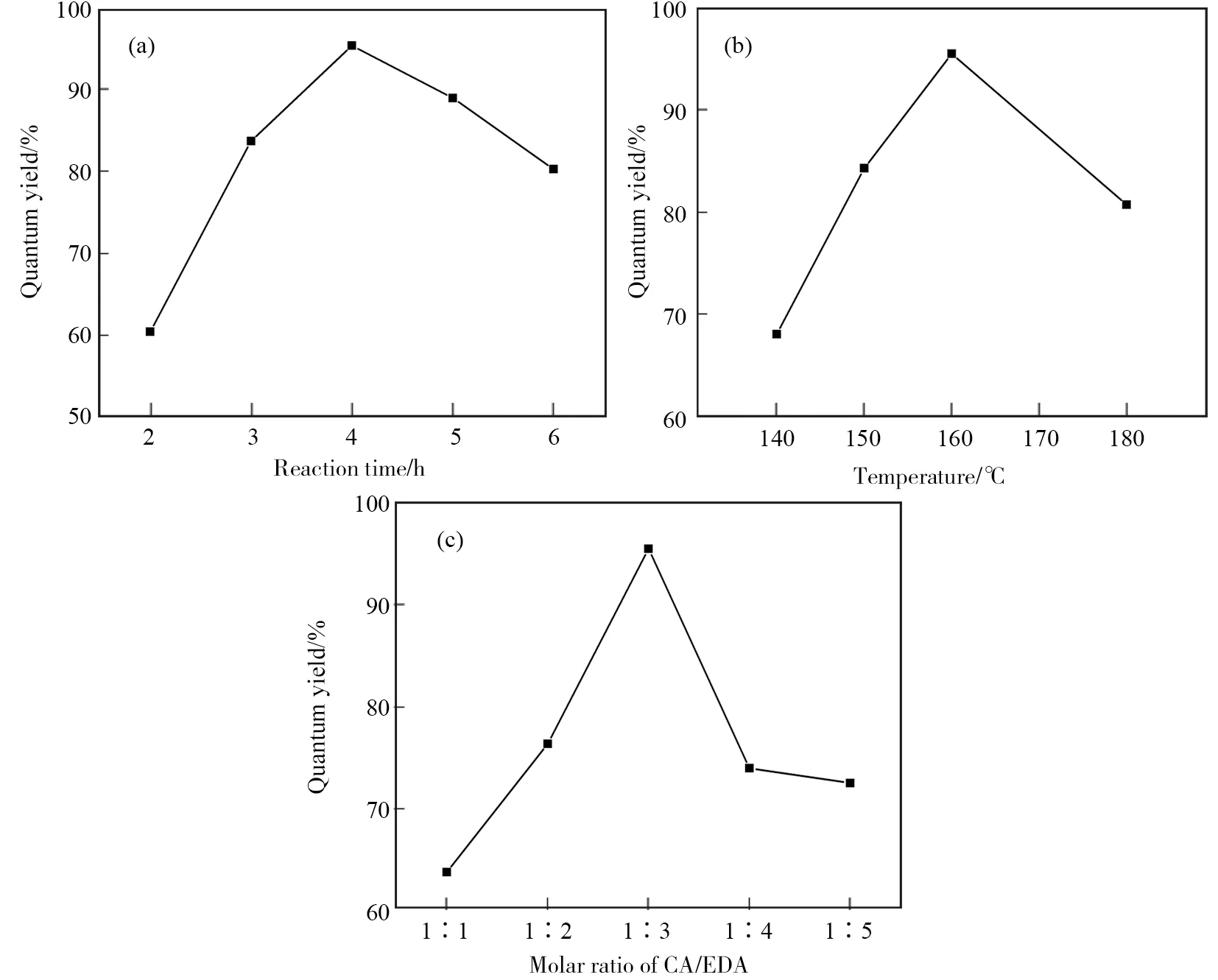
图2 加热时间(a)、加热温度(b)、柠檬酸与乙二胺的物质的量之比(c)对荧光量子产率的影响Fig.2 Effect of reaction time(a), temperature(b), molar ratio of CA/EDA (c) on quantum yield
通过单因素对N-GQDs荧光量子产率的考察,得到最佳合成条件:合成N-GQDs时,加热时间为4 h,加热温度为160 ℃,柠檬酸与乙二胺的物质的量之比为1∶3,以硫酸奎宁为参比,计算得到N-GQDs的荧光量子产率为94%。
2.2 氮掺杂石墨烯量子点的结构表征
分别采用紫外-可见吸收光谱法、荧光光谱法、透射电子显微镜法对氮掺杂石墨烯量子点进行表征,研究石墨烯量子点的形貌及光学特性。
2.2.1 N-GQDs的紫外及荧光光谱图分析
如图3(a)所示,N-GQDs的紫外可见吸收光谱在350 nm处有一个特征吸收峰,归因于C=O的n→π*跃迁,通过表面激发态的能量陷阱而产生强烈的发射,从荧光光谱图中可以看出,N-GQDs最大激发波长为390 nm,发射波长为450 nm,在365 nm紫外灯下,橘黄色的N-GQDs呈现亮蓝色荧光,说明该氮掺杂石墨烯量子点具有很好的发光性质,是一种高荧光量子产率的量子点。测定N-GQDs在不同激发波长(360、370、380、390、400、410、420 nm)下荧光谱图,如图3(b)所示。发现当N-GQDs的激发波长变化时,发射波长不发生改变,N-GQDs表现出激发波长非依赖性的荧光行为。
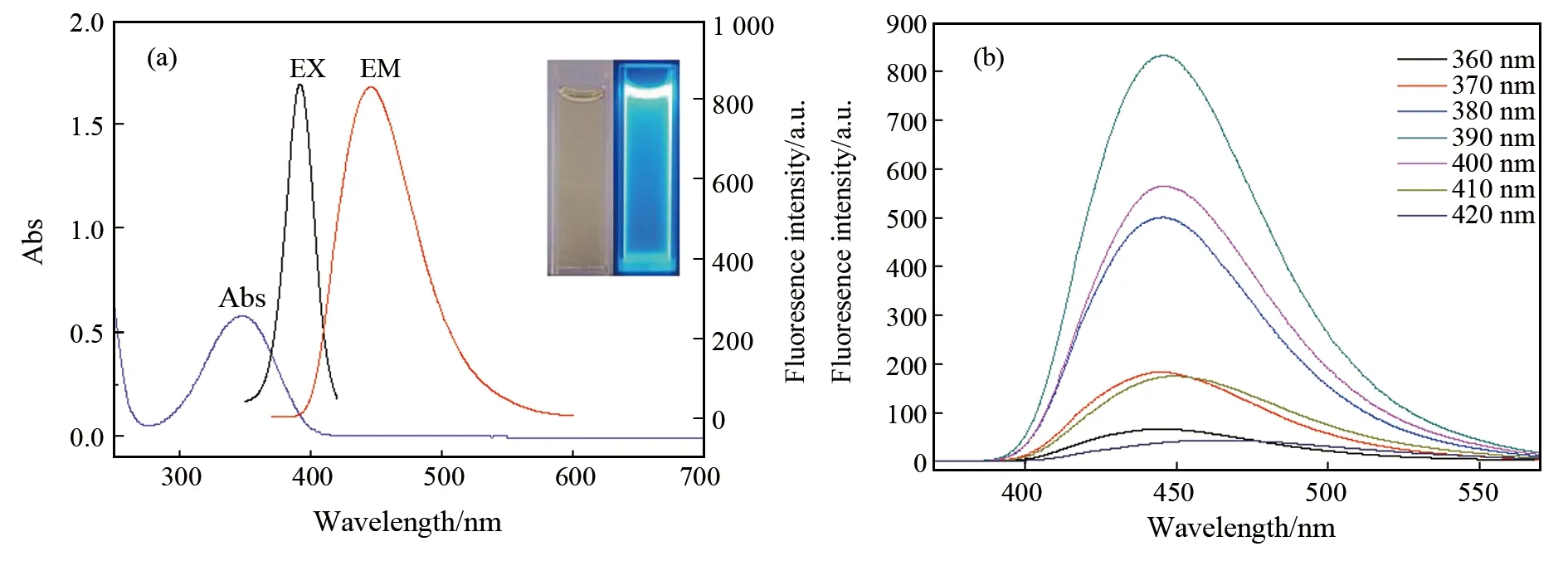
图3 (a) N-GQDs的紫外光谱、荧光光谱图(内侧为在白光和紫外光365 nm下的对比),(b)在不同波长下的荧光谱图Fig.3 (a) The UV-Vis and fluorescence spectra of N-GQDs (the inside contrast between the whitelight and UV light 365 nm), (b) Emission spectra of the N-GQDs with excitation of different wavelengthes
2.2.2 N-GQDs的傅立叶红外吸收光谱及透射电镜图
将N-GQDs溶液倒入蒸发皿中,水浴锅上40 ℃挥发蒸干,得到N-GQDs固体,加入KBr进行压片后测定红外光谱,N-GQDs的红外光谱图见图4。柠檬酸经过水热反应后,生成的N-GQDs结构发生了很大的变化,但还是保留了一些反应物的官能团,在2 930 cm-1及1 520 cm-1处出现的吸收峰分别表示-CH2伸缩振动和-C=C的伸缩振动。在3 000-3 300 cm-1处有-NH的伸缩振动,在1 120 cm-1处有-CN的伸缩振动,说明N-GQDs中乙二胺和柠檬酸发生了脱水聚合。透射电镜图谱显示N-GQDs的形状呈规则的圆形,粒径大小不一,粒径范围主要在20~40 nm之间,见图5。
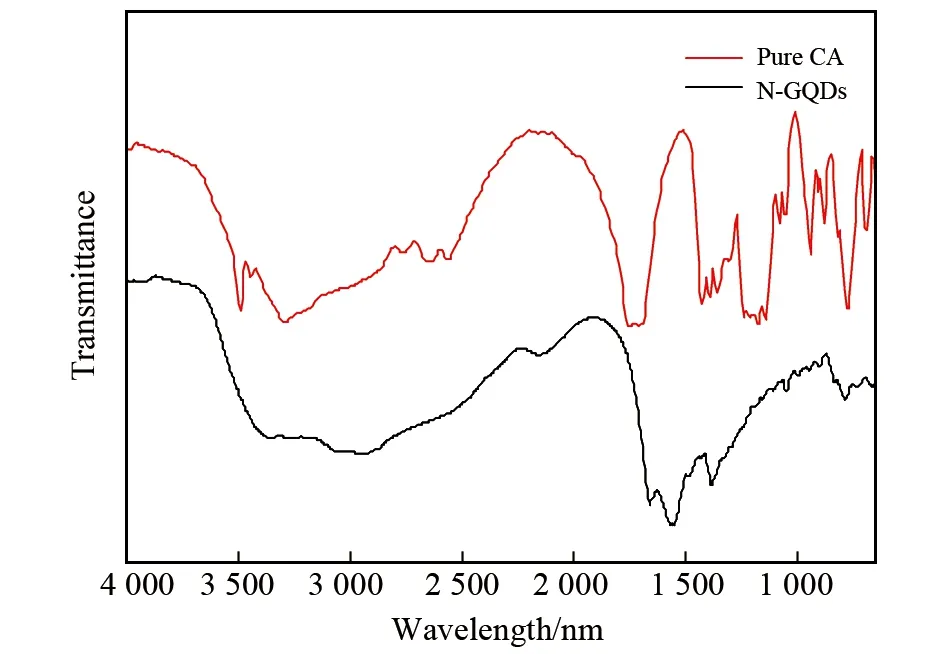
图4 N-GQDs的红外图谱Fig.4 FTIR spectra of N-GQDs

图5 N-GQDs的透射电镜图Fig.5 TEM of N-GQDs
2.3 TT法检测氮掺杂石墨烯量子点的细胞毒性
随着N-GQDs浓度的降低,细胞存活率增加,当N-GQDs浓度降到500 mg/L以下时,细胞存活率依然保持在90%以上,说明当N-GQDs的浓度达到500 mg/L时,依然具有良好的生物相容性,可以作为荧光探针应用于生物体系中(见图6)。
2.4 细胞成像
N-GQDs可成功实现HeLa细胞的荧光成像,且荧光标记效果明显。结果如图所示,图7(a)是明场条件下的细胞,图7(b)为405 nm激发光后的荧光图像,从图中可以看出,摄取N-GQDs的HeLa细胞在405 nm激发波长下,发出蓝光,N-GQDs成功地进入细胞膜,没有进入细胞核。图7(c)为明场和405 nm激发光下图的叠加,可以清楚的看到,活细胞的膜内有荧光,死细胞却没有,说明制备得到的N-GQDs可以标记活细胞,但不能标记死细胞。
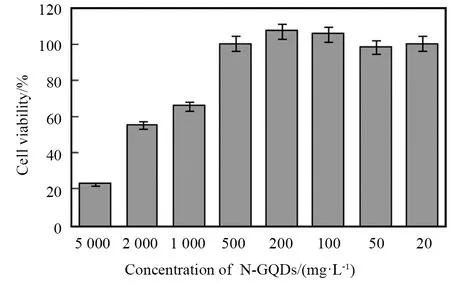
图6 MTT法检测N-GQDs的细胞毒性Fig.6 Detection of cytotoxicity of N-GQDs by MTT method

图7 HeLa细胞激光共聚焦图片(a)明场, (b)激发波长为405 nm, (c)叠加场Fig.7 Confocal fluorescence microscopy images of HeLa cell (a) bright field, (b) excitation wavelength of 405 nm, (c) applied field
3 结论
进行了氮掺杂石墨烯量子点及其在细胞成像中应用的研究。通过柠檬酸和乙二胺的水热合成,制备氮掺杂石墨烯量子点。合成方法具有简单易行,绿色环保及产率高等优点。因氮掺杂石墨烯量子点具有良好的荧光特性和低细胞毒性,应用于HeLa细胞荧光标记,进行细胞荧光成像。高荧光量子产率的氮掺杂石墨烯量子点可以作为一种很有前途的低毒性荧光标记物,在生物成像方面有着巨大的潜力。氮掺杂型石墨烯量子点若进一步功能化,结合激光共聚焦成像技术可成为检测细胞内物质的有效手段,有望应用于细胞内多种活性分子的检测。

