癌症诊疗一体化荧光成像纳米探针的研究进展
李兆阁,胡贵珍,郭文政,聂亚敏,周艳梅
(河南大学 化学化工学院,河南省环境污染控制材料国际联合实验室,河南 开封 475004)
世界卫生组织发布的《2021全球癌症报告》数据显示,2021年全球将近1 000万人死于癌症,严重摧残着人们的生命健康和阻碍着社会经济的发展。临床研究表明,癌症致死率高的主要原因,一是绝大多数癌症患者确诊时即是中晚期,二是治疗药物的靶向性差,对癌细胞和正常组织细胞没有选择性地同时杀伤。所以,同时实现癌症早期诊断与靶向治疗是提高癌症治疗率的关键。将诊断探针和治疗试剂结合在一个平台上的癌症诊疗一体化,有助于实现诊断、治疗和疗效监控于一体,不仅能够实现癌症的成像和治疗,而且可以实现对治疗效果的实时监测,为癌症的早期诊断和精准治疗提供一个全新的多功能诊治平台。如何实现癌症的诊疗一体化是目前的研究热点和难点。目前,癌症早期诊断依赖的成像方式主要有核磁共振成像(MRI)、光声成像(PAI)、光热成像(PTI)、拉曼成像(RI)和荧光成像(FLI)等,其中FLI具有灵敏度高、稳定性好、可原位无损成像等优点,获得了广大研究者的关注。目前,癌症的治疗策略包括核酸递送、化学治疗、光热治疗(PTT)、光动力治疗(PDT)、化学动力治疗(CDT)、基因治疗和放射治疗等,都已被成功地用于临床中。将FLI和一种或多种癌症治疗技术结合于一个纳米材料上,可同时实现癌症的成像和治疗,达到诊疗一体化的作用。本文中基于比较经典的金纳米粒子、DNA自组装纳米结构、金属-有机骨架材料(MOF)、碳基纳米材料 (MCBN)等纳米材料的FLI诊疗一体化进行综述讨论,总结其在诊疗一体化中的应用。
1 基于金纳米粒子的癌症诊疗一体化FLI纳米探针
金纳米粒子,主要包括金纳米颗粒(Au NPs)[1]、金纳米簇(Au NCs)[2]、金纳米棒(Au NRs)[3]、金纳米双锥体(Au NBPs)[4]、金纳米枝晶(Au NDs)[5]和金纳米花(Au NFs)[6]等,具有优异的生物相容性、独特的光学及其结构特性,被广泛应用于癌症诊疗一体化平台的构建[7]。
罗细亮课题组[8]以Au NBPs为纳米载体,往上包裹一层聚多巴胺(PDA),形成Au NBPs @PDA(如图1)。发红光的 Au NCs 标记探针1(适配体-具有靶向跨膜糖蛋白MUC1 的特殊序列)和发绿光的 Au NCs 标记探针2(单链DNA-具有靶向miRNA-21的互补序列)通过“π-π”堆积同时组装在 Au NBPs @PDA 表面,Au NBPs @PDA具有宽的全光谱吸收范围,可通过荧光共振能量转移作用(FRET)猝灭探针1和探针2的荧光。当纳米探针与癌细胞孵育后,探针1和癌细胞膜上的MUC1之间的竞争性结合导致探针1从 Au NBPs @PDA表面脱离,打开红色荧光。同样,探针2与细胞质中miRNA-21的杂交导致探针2从Au NBPs @PDA表面脱离,开启绿色荧光。因此,可以实现不同肿瘤生物标志物的同时原位多层成像。且Au NBPs @PDA具有良好的光热转换能力,可在808 nm光的照射下将光能转换成热能,有效诱导癌细胞凋亡,从而达到癌症诊断和治疗一体化的作用。
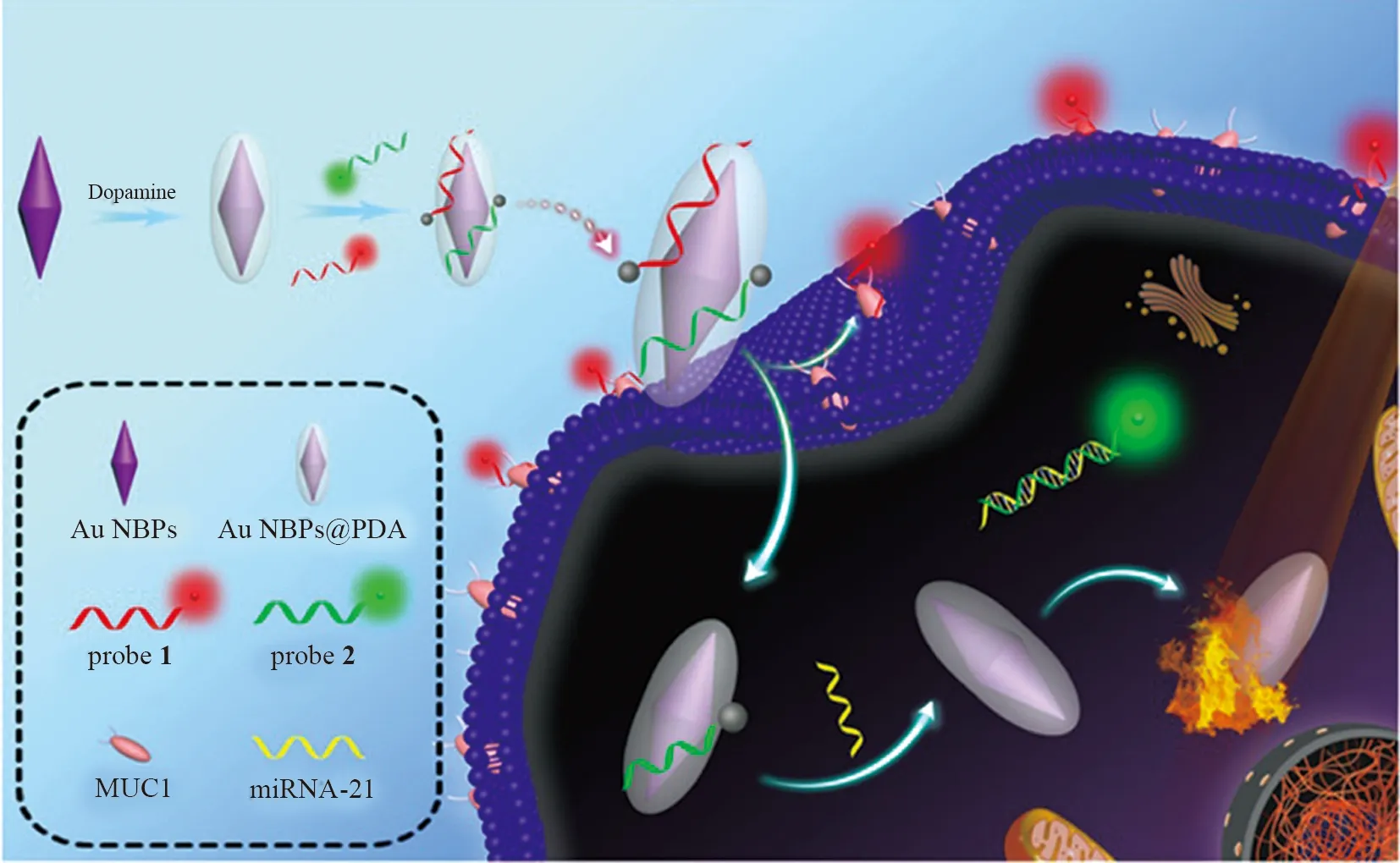
图1 基于Au NBPs @PDA/Au NCs的一体化纳米平台用于同时原位成像具有不同细胞内空间分布的双类型癌症生物标志物的图示Fig.1 Illustration of the Au NBPs @PDA/Au NCs based all-in-one nanoplatform for a simultaneousin situ imaging of dual types of cancer biomarkers with different intracellular spatial distributions
李颖课题组[9]以Au NPs为纳米载体(图2),二氢卟吩(Ce6)标记的单链DNA(Ce6-S) 和荧光团Rox标记的发夹DNA(Rox-H)通过金-硫键固定在Au NPs的表面。之后,加入Cy3修饰的MUC1特异性适体(Cy3-A)并与Rox-H杂交形成双链DNA,由于FRET作用,Cy3的荧光可以被 Au NPs 猝灭,且由于Rox与Au NP之间距离变远导致红色荧光恢复。当纳米探针与癌细胞一起孵育后,Cy3-A可以通过适体和靶标的高特异性相互作用与细胞膜上的MUC1结合并从探针上解离,打开蓝色荧光。此时Rox-H又变回发夹结构,荧光变为OFF。进入细胞后,细胞质内的miRNA-21与Rox-H杂交并打开发夹结构,荧光从OFF变为ON。固定在探针表面的光敏剂Ce6在650 nm激光照射后可被激发产生单线态氧(1O2),用于破坏肿瘤细胞进行癌症治疗,从而达到癌症诊断和治疗一体化的作用。
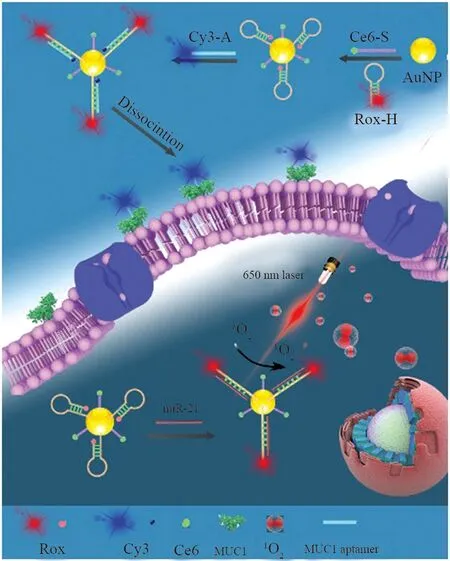
图2 以Au NPs为载体用于多种生物标志物原位多层成像和癌细胞靶向光动力治疗的负载 Ce6 纳米探针的示意图Fig.2 Schematic illustration of loaded Ce6nanoprobes using Au NPs as carriers forin situ multilayer imaging of multiple biomarkersand cancer cell-targeted photodynamic therapy
唐波课题组[10]以Au NPs为载体(如图3),同时负载荧光团Alexa Fluor 405修饰的MUC1特异性发夹DNA结构和荧光团FAM修饰的特异性识别端粒酶的探针(由3′带有较短端粒酶引物的缺口分子信标),该端粒酶探针可以通过将药物DOX与双链结合,同时作为药物载体。Alexa Fluor 405和FAM由于FRET作用被Au NPs猝灭荧光。当纳米探针和癌细胞孵育后,纳米探针的MUC1适配体与细胞表面过表达的MUC1蛋白特异性结合导致发夹结构打开,Alexa Fluor 405荧光恢复,同时遇到细胞质中的端粒酶后,端粒酶引物开始产生重复的端粒序列,因此与其杂交的分子信标结构打开,FAM的绿色荧光恢复。伴随着分子信标的结构变化,与分子信标结合的DOX被释放,达到对癌症诊疗一体化的作用。

图3 以Au NPs为载体用于诊断和治疗的原位荧光监测的载药纳米探针示意图Fig.3 Schematic diagram of drug-loaded nanoprobesusing Au NPs as carriers for in situ fluorescencemonitoring for diagnosis and therapy
刘松琴课题组[6]以金纳米花 (Au NFs)为载体,负载了银纳米粒子修饰的一条双链DNA和光敏剂血卟啉单甲醚(HMME)修饰的含有肽接头(C-肽)的caspase-3特异性识别序列,HMME的荧光被Au NFs猝灭。当纳米探针和癌细胞孵育后,Ag NPs和HMME作为凋亡诱导剂在激光照射下产生ROS,导致Ag NPs的氧化刻蚀释放Ag+显示LSPR信号变化,且含有caspase-3特异性识别序列被细胞中caspase-3切割,导致HMME与纳米探针分离荧光开启,同时纳米探针可用于癌细胞联合化学治疗(Ag+的释放)和PDT(HMME)在激光照射下可被激发产生ROS,诱导细胞凋亡,以达到对癌症诊疗一体化的作用。
2 基于DNA自组装的癌症诊疗一体化FLI纳米探针
利用DNA的高度特异性和可编程性,目前已经组装了大量具有不同尺寸和几何形状的DNA自组装纳米结构[11]。这些DNA自组装纳米结构可以很容易透过细胞膜,具有易于自组装、优异的生物相容性、高核酸酶稳定性、通过小窝蛋白依赖性途径的显著跨膜能力以及易于修饰等优点[6, 12-16]。
刘松琴课题组[17]由七个定制的单链核酸链(P5是荧光团Fam修饰的miRNA-21的antagomir-21特殊识别序列,P6、P7分别是荧光团Tamra和Cy5修饰的miRNA-122和miRNA-194的识别序列,而P1、P2、P3分别是P5、P6、P7的对应包含猝灭剂的互补链)自组装合成DNA四面体纳米结构(DTNs)(如图4)。在DTNs的三个顶点中,荧光团和猝灭剂紧密接近,诱导荧光猝灭。当DTNs和癌细胞孵育后,在存在目标 miRNA的情况下,荧光团和猝灭剂将被分离,实现荧光“OFF”到“ON”。由于独特的四面体状空间结构,DTNs显示出更好的酶消化抗性和高细胞摄取效率,并表现出同时监测三种细胞内 miRNA 的能力。DTNs不仅能有效区分肿瘤细胞和正常细胞,还能识别癌细胞亚型,避免了假阳性信号,显著提高癌症诊断的准确性。miRNA-21过表达的癌细胞中P5的antagomir-21识别序列从DTNSs分离,沉默细胞内的内源性miRNA-21,抑制癌细胞迁移和侵袭,最终诱导癌细胞凋亡,达到对癌症诊疗一体化的作用。

图4 DNA 四面体纳米结构 (DTNS) 制备和细胞进入用于准确识别癌细胞和进行有效治疗的示意图Fig.4 Schematic illustration of DNA tetrahedron nanostructures (DTNSs) preparation and cellentry for accurate cancer cell identification and effective therapy
卢春华课题组[18]利用两个Y形DNA构建单元(其中Yb中DNA的末端序列处引入端粒引物序列)和一个标记有荧光团Cy5/猝灭基团BHQ3并加载有治疗性siRNA的DNA接头自装形成了DNA纳米水凝胶(如图5)。该DNA纳米凝胶和癌细胞孵育后,DNA纳米水凝胶在肿瘤细胞中过度表达的端粒酶的响应下裂解,导致猝灭的Cy5荧光信号的恢复。这种特异性的端粒酶反应机制可以有效地实现端粒酶活性的体外检测和细胞内端粒酶的原位成像。同时,加载在纳米水凝胶中的治疗性siRNA被释放,裂解细胞中的mRNA用于基因治疗,达到对癌症诊疗一体化的作用。
郑静课题组[19]将Cy3和BHQ2分别用作荧光线粒体靶向分子和偶氮还原酶响应元件,它们共价连接到DNA发夹单体上(如图6)。然后将Cy3修饰的DNA发夹单体H1和BHQ2修饰的DNA发夹单体H2(末端富含鸟嘌呤(G)的延伸处修饰的光敏剂TMPyP4),通过杂交链反应(HCR)简单自组装制备的长的可编程DNA纳米链。Cy3的荧光和TMPyP4产生的单线态氧(1O2)被BHQ2通过荧光共振能量转移(FRET)过程在组装的纳米链中有效猝灭。此纳米链进入癌细胞,在缺氧条件下,BHQ2中的偶氮键会被偶氮还原酶的高表达还原为氨基;然后,Cy3的荧光和TMPyP4的1O2产生能力将显著恢复。此外,由于Cy3赋予的线粒体靶向特性,负载TMPyP4的纳米链会在癌细胞的线粒体中积累,然后在光照射下表现出增强的PDT功效,用于诊疗一体化。
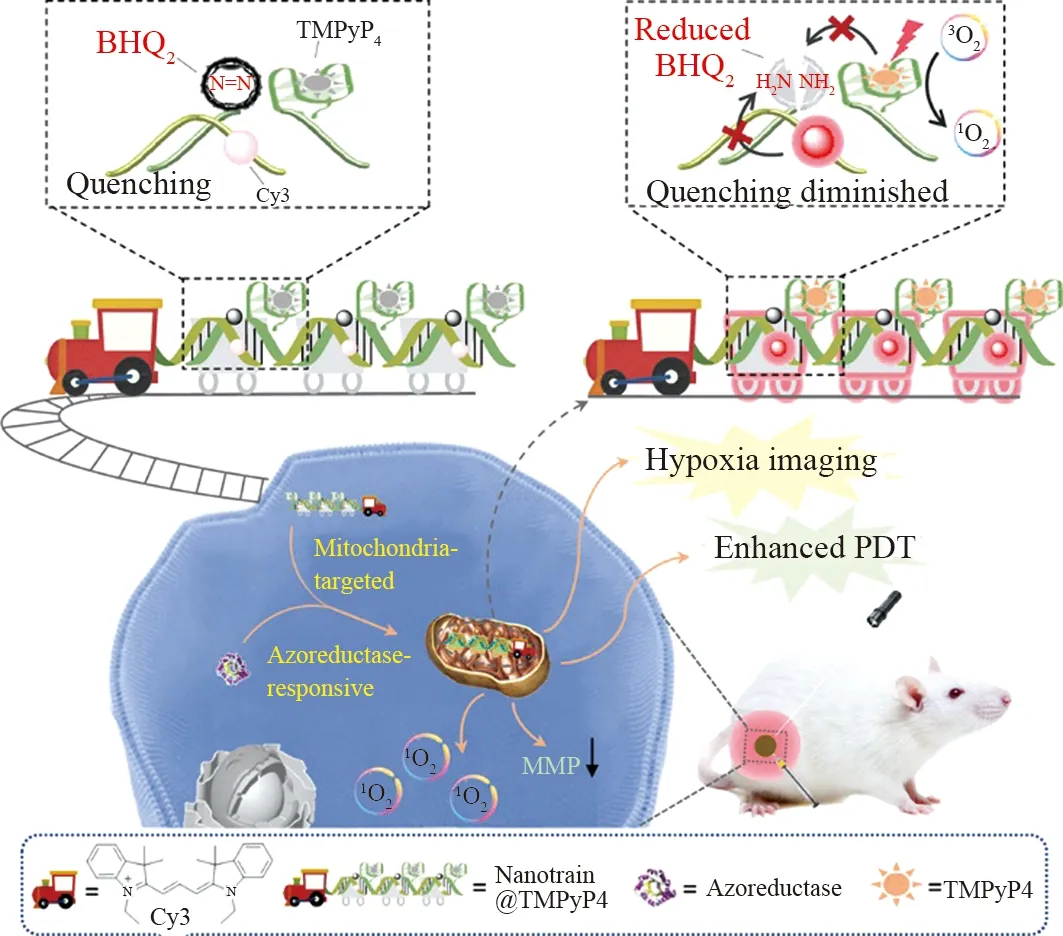
图5 用于可激活缺氧成像和增强 PDT 的偶氮还原酶响应、线粒体靶向多功能 DNA 纳米序列 (Nanotrain @TMPyP4) 示意图Fig.5 Schematic illustration of the azoreductase-responsive, mitochondrion-targeted multifunctional DNAnanotrain (Nanotrain @TMPyP4) for activatable hypoxia imaging and enhanced PDT
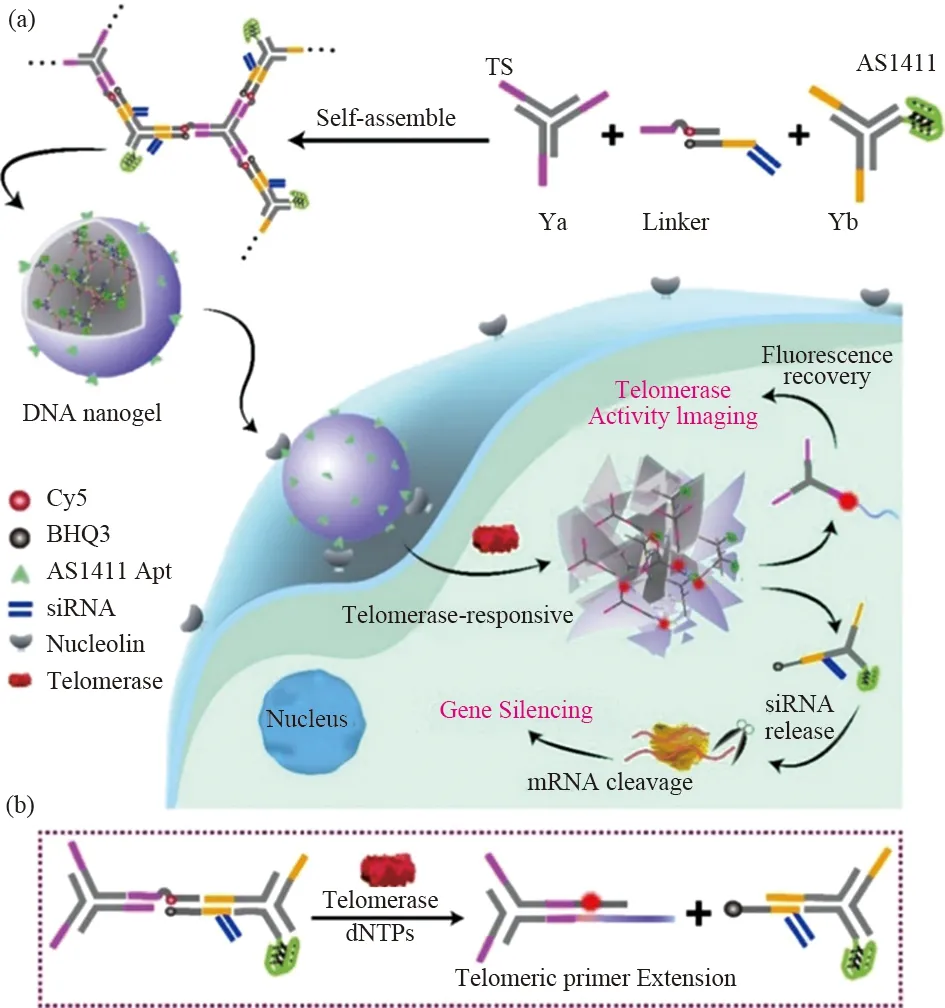
图6 用于端粒酶成像和端粒酶激活基因治疗的DNA纳米凝胶示意图Fig.6 Illustration of the DNA nanogel for telomeraseimaging and telomerase-activated gene therapy
3 基于金属有机骨架(MOF)的癌症诊疗一体化FLI纳米探针
金属有机骨架(MOF)作为新型有序多孔配位聚合物,由有机配体和无机顶点(金属离子或簇)组装而成。MOF由于其比表面积大、生物相容性好、结构可调和功能多样而在生物医学应用中越来越受到关注[20]。通过选择合适的金属离子和配体,可以合成和调节MOF以辅助癌症的诊断和治疗,充当显像剂、药物载体和癌症治疗剂等[21-26]。
尹学博课题组[27]利用Cu2+掺杂的中空MOF结构Cu/Zn-MOF,内部中空结构用于加载光敏剂吲哚菁绿(ICG),材料外面包裹MnO2合成纳米探针(如图7)。掺杂的Cu2+和表面的MnO2可氧化细胞中GSH以减少ROS的消耗并产生Mn2+离子用于“开启”磁共振成像 (MRI),且系统中聚集的ICG在808 nm的激光照射下被激活,将原位生成的O2转化为1O2用于PTT和PTI,ICG还可用作体内近红外(NIR)染料荧光成像引导治疗,可在肿瘤部位释放后实现FLI。产生的Cu+和Mn2+催化细胞内的H2O2生成·OH,用于CDT的类芬顿反应,达到对癌症诊疗一体化的作用。
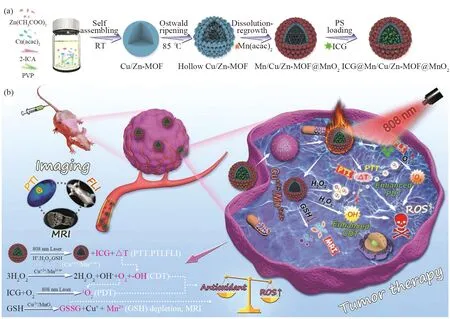
图7 ICG @Mn/Cu/Zn-MOF @MnO2的制备过程及其检测原理Fig.7 Preparation process and detection principle of ICG @Mn/Cu/Zn-MOF@MnO2
田间课题组[28]以ZIF-8为纳米载体,通过ZrCl4和四(4-羧基苯基)卟啉(TCPP)形成介孔球壳的中空卟啉金属有机骨架 (H-PMOF)纳米颗粒,往中空结构里负载DOX和ICG,并用癌细胞膜包裹形成仿生组合纳米平台,提高纳米材料的靶向性(如图8)。ICG分子具有高光热转换效率和PDT效果,能在激光照射下将光能转换为热能,且被激发产生1O2,诱导细胞凋亡,而且ICG可在肿瘤部位释放后实现FLI,达到癌症诊疗一体化的作用。
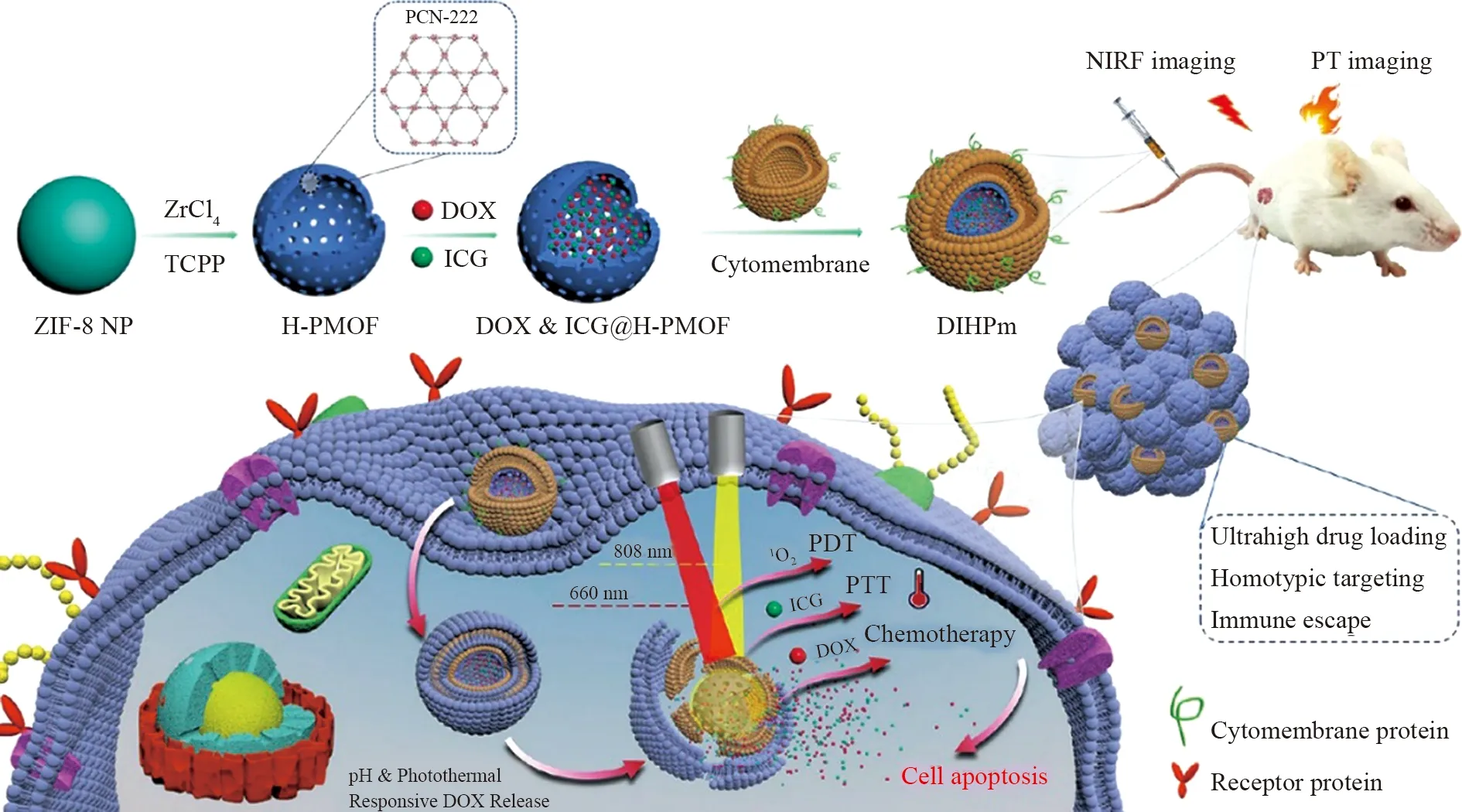
图8 通过自牺牲 ZIF-8 NP 模板策略和仿生组合纳米平台DIHPm制造HPMOF NPs的示意图Fig.8 Schematic illustration of fabricating the HPMOF NPs through a self-sacrificialZIF-8 NP template strategy and the biomimetic combined nanoplatform DIHPm
胡斌课题组[29]以Fe掺杂的MOF(NH2-MIL-101)为载体,装载了抗癌药物喜树碱(Cam),用聚乙二醇化叶酸(FA)修饰纳米材料以特异性识别癌细胞膜上的FA受体,提高递送效率。通过凋亡指示剂caspase-3的底物肽将荧光Au NCs偶联到MOFs上,由于FRET作用,Au NCs的荧光被MOF猝灭(如图9)。当纳米探针与细胞孵育后,Cam释放出来导致细胞凋亡,Cam的细胞间传递启动了细胞的程序性死亡并上调了细胞凋亡指示剂(caspase-3),从而切割了Au NCs和MOF之间的肽接头,Au NCs的荧光猝灭然后在MOF上恢复,且caspase-3的量可以通过在电感耦合等离子体质谱(ICP-MS)中检测释放的Au NCs中的Au来量化检测达到对癌症诊疗一体化的作用。
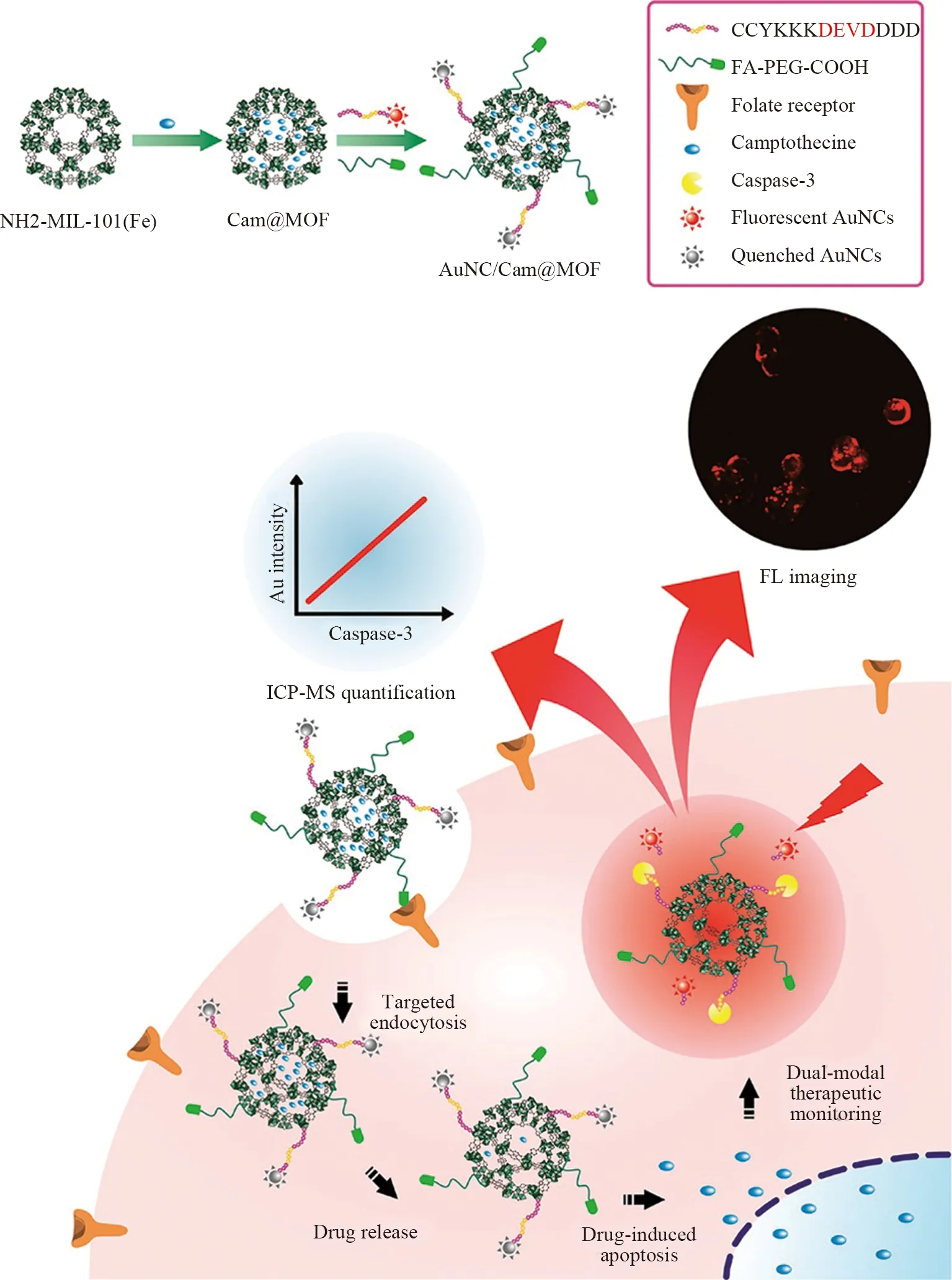
图9 多功能Au NC/Cam @MOF纳米探针的制备示意图及实验原理Fig.9 Schematic illustration of preparation of multifunctional Au NC/Cam @MOF nanoprobe and experimental principle
4 基于碳基纳米材料(MCBN)的癌症诊疗一体化FLI纳米探针
多功能碳基纳米材料(MCBN)具有良好的光学、电子和热特性,已经在生物医学领域(例如生物成像、药物输送和肿瘤治疗)中显示出了大量潜在应用,引起了越来越多的科研者关注。碳纳米材料根据其形态可分为石墨烯(GO)、碳纳米管(CNTs)、介孔碳纳米粒子(MCNs)、纳米金刚石、富勒烯和碳点(CDs)等[30]。
4.1 氧化石墨稀(GO)
GO是一种高度氧化的化学改性石墨烯,由于平面中存在大量含氧羟基、羧酸和环氧化物,因此具有良好的电学、热学、光学、力学性能[31-33]。Hwang课题组[34]以纳米级GO为纳米载体,通过酰胺化反应,装载上FA修饰的PEG,组装成纳米探针(如图10a)。该纳米平台使1O2的产生敏感以介导双峰PDT和PTT效应在超低激光剂量的近红外光激发下,即使在深部组织中也能有效损伤实体瘤。此外,纳米级GO在可见光和NIR区域表现出单光子激发波长相关的光致发光,适用于体内多色荧光成像,达到癌症诊疗一体化的作用。
4.2 介孔碳纳米粒子(MCNs)
介孔纳米粒子,尤其是介孔二氧化硅纳米粒子(MSNs)由于其高表面积、大孔体积和均匀的介孔结构而被应用于生物技术和纳米医学领域[35-38]。杨平、邢宏龙课题组[39]以MSNs为载体,使用硅烷偶联剂将其表面氨基化,并负载锌酞菁-酚醛树脂(ZnPc-PFR)纳米颗粒光敏剂,且通过DOX的羟基和MSNs的氨基之间的氢键将DOX加载到MSNs中(如图10b)。负载了(ZnPc-PFR)光敏剂,既可以提高DOX的载药率,又可以在808 nm激光照射下将光能转换为热能用于PTT,且ZnPc-PFR在肿瘤的酸性微环境下激光照射下发出蓝色的荧光,用于荧光成像。肿瘤酸性环境中过量的H+使氨基和羟基质子化,氢键被破坏,DOX迅速释放,用于化疗,达到诊疗一体化的作用。
4.3 碳点(CDs)
CDs是一种重要的荧光碳基纳米材料,尺寸小于10 nm,具有良好的水分散性、光学性能[40],且其大小与体内的蛋白质、DNA、离子通道和肾小球滤过屏障相似,它们可以将基因或药物装载和输送到特定目标,这使它们成为理想的纳米载体和纳米胶囊[41-45]。彭孝军课题组[46]选用一系列喹啉衍生物为“结构固有靶向”碳源,通过一步水热法构建靶向核酸的不同CDs(1-CDs、Cl-CDs和I-CDs),并负载FA修饰的脂质体(FA-DSPE-mPEG 2000)(如图10c)。细胞消化实验和核酸反应实验表明,CDs对RNA具有良好的选择性,且由于氮掺杂,所有制备的CDs都表现出NIR吸收和发射。在FA-DSPE-mPEG 2000的帮助下,I-CDs被主动递送至肿瘤细胞,其中I-CDs由于碘的重原子效应,表现出改善的光敏能力,可在激光照射下被激发后,将细胞中的O2转换成1O2诱导肿瘤凋亡,达到诊疗一体化的作用。
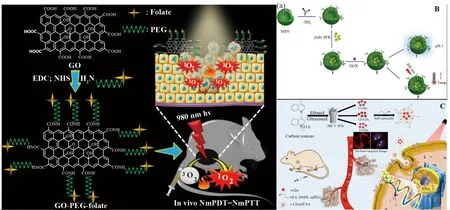
图10 合成 GO-PEG-叶酸的示意图,以促进纳米材料介导的光动力和光热治疗破坏肿瘤的结合Fig.10 Schematic representation for the synthesis of GO-PEG-folate to facilitate the combinationof nanomaterial-mediated photodynamic and photothermal therapeutic destruction of tumors
5 总结与展望
目前,用于分子影像学研究的影像学技术有很多,而FLI具有灵敏度高、选择性好、原位可视化观测、非侵入性强等优点,被更多地用于癌症成像诊断中。纳米技术的飞跃发展为集癌症成像诊断和治疗试剂于一体化提供了平台,FLI与治疗(PTT、PDT、化学治疗、基因治疗和辐射治疗等)集于一体化的纳米材料越来越多,合成简便、效果显著。目前,纳米材料的诊疗一体化在制备和应用中还存在很多需要进一步研究的问题,如:1)设计新型高效、安全多功能诊疗一体化纳米材料,实现对肿瘤的性质、尺寸、深度等精准诊断;2)制定诊疗一体化纳米材料在分散性、稳定性、生物相容性的评估体系,建立纳米材料与技术标准,促进纳米诊疗一体化技术的临床转化应用。

