肝内胆管细胞癌根治术后辅助化疗的临床应用价值
张志,李海冰
1.重庆市綦江区人民医院病理科,重庆 401420;2.重庆市綦江区人民医院肝胆外科,重庆 401420
据有关统计,近年来肝内胆管细胞癌的发病率逐年提升[1-2]。肝内胆管细胞癌的病因不明确,主要发病于50~70 岁人群,该病可能和肝胆管结石、原发性硬化性胆管炎具有密切联系,肝内胆管细胞癌患者于病情早期,主要表现为进行性黄疸,通常还会发生无痛性、进行性加重的黄疸,二便异常,大便为灰白色,呈白陶土状,尿液的颜色也会变深。临床中根据发病部位可以将肝内胆管癌分成高位胆管癌、中段胆管癌和下段胆管癌[3]。高位胆管癌指的是胆管癌发生在胆囊管开口水平以上到左右肝管以外;中段胆管癌指的是发生在胆总管十二指肠上段、十二指肠后段的肝外胆管癌;下段胆管癌指的是发生在胆总管胰腺段、十二指肠壁内段的胆管癌[4]。肝内胆管癌于临床中的主要表现为梗阻性黄疸、腹痛、胆管感染、胆囊增大以及其他症状,(体质量降低、乏力、厌食以及贫血等情况)[5]。目前,临床中一般会采用根治术手术进行治疗,但因肝脏受到双重血供的影响,术后肝内转移以及外转移率较高,长期临床疗效不佳[6]。通常来说,自然病程只有5~10 个月[7],据国外报道表明,术后五年存活率最低为17.4%,最高只有29.2%[8]。本文选择2017 年3月—2021 年7 月期间重庆市綦江区人民医院收治的60 例肝内胆管细胞癌患者为研究对象,研究肝内胆管细胞癌患者在肝内胆管细胞癌根治术治疗后辅助化疗的应用效果及其价值。现报道如下。
1 资料与方法
1.1 一般资料
选择本院收治的60 例肝内胆管细胞癌患者为研究对象,按照随机数表法分为对照组(n=30)和观察组(n=30)。观察组中男18 例,女12 例;年龄33~68 岁,平均(48.96±6.78)岁。对照组中男17 例,女13 例;年龄31~67 岁,平均(49.03±6.82)岁。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。患者及其家属于同意书上签字。本研究经院内医学伦理委员会批准。
1.2 纳入与排除标准
纳入标准:①确诊为肝内胆管细胞癌患者;②临床资料完整;③经术前强化CT 以及MRI 扫描以后,证实为单发性肿瘤,术后病理表明为肝内胆管细胞癌;④肿瘤直径在8.5 cm 以下。
排除标准:①不依从者;②存在禁忌证者;③合并其他恶性肿瘤者。
1.3 方法
对照组通过肝内胆管细胞癌根治术进行治疗。观察组通过肝内胆管细胞癌根治术治疗后,采用化疗辅助治疗。
①肝内胆管细胞癌根治术:切除肝内胆管细胞癌的肝段,做到切缘无癌,将肝门淋巴结进行清扫,排除门静脉癌栓。②化疗:手术后30 d 内做影像学检查,发现患者无复发以及转移情况,手术后使用吉西他滨、顺铂进行周期性化疗治疗,将1 000 mg/m2吉西他滨(国药准字H20163171)和100 mL 0.9%氯化钠注射液(国药准字H19994066)混合,在术后第1、8、15天通过静脉滴注,持续时间为30 min;将25 mg/m2顺铂(国药准字H20040813)加入250 mL 0.9%氯化钠溶液中,在第1、3、5 天通过静脉滴注90 min,每个周期为28 d。
1.4 观察指标
通过临床复查、电话跟踪随访,治疗后每个月通过1 次电话随访,每3 个月做1 次门诊复查。
统计患者的治疗总有效率:显效为患者临床症状明显消失,临床指标显著改善;有效为患者的临床症状部分消失,临床指标发生一定程度的改善;无效为临床症状以及治疗指标和治疗前相比,均无明显变化。治疗总有效率=(显效例数+有效例数)/总例数×100%;治疗后血清糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、谷丙转氨酶(alanine aminotransferase, ALT);平均生存时间;并发症发生率(肝功能衰竭、胆道感染、胆源性肝脓肿)。
1.5 统计方法
采用SPSS 21.0 统计学软件处理数据,计量资料符合正态分布,以(±s)表示,组间差异比较采用t检验;计数资料以频数和百分率(%)表示,组间差异比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组治疗总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者临床疗效对比
2.2 两组患者血清CA19-9、AFP、CEA、ALT 水平比较
治疗后,观察组血清CA19-9、AFP、CEA、ALT均优于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者血清CA19-9、AFP、CEA、ALT 水平对比(±s)
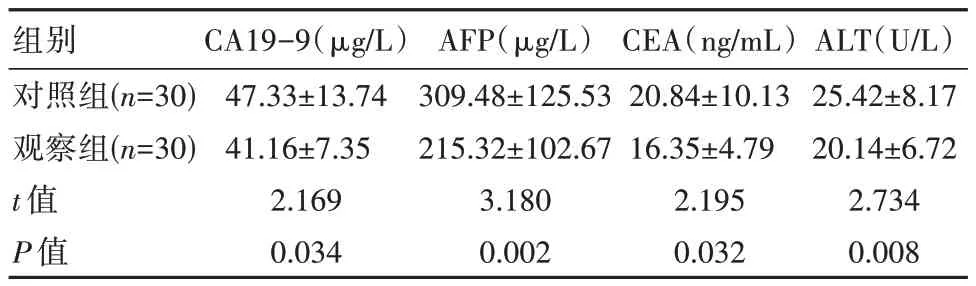
表2 两组患者血清CA19-9、AFP、CEA、ALT 水平对比(±s)
组别对照组(n=30)观察组(n=30)t 值P 值CA19-9(μg/L)47.33±13.74 41.16±7.35 2.169 0.034 AFP(μg/L)309.48±125.53 215.32±102.67 3.180 0.002 CEA(ng/mL)20.84±10.13 16.35±4.79 2.195 0.032 ALT(U/L)25.42±8.17 20.14±6.72 2.734 0.008
2.3 两组患者平均生存时间比较
观察组平均生存时间为(23.46±10.40)个月,长于对照组的(16.83±7.49)个月,差异有统计学意义(t=2.833,P<0.05)。
2.4 两组患者并发症发生率比较
观察组并发症发生率低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者并发症发生率对比
3 讨论
肝内胆管细胞癌患者于发病早期,临床症状不明显,特异性较低,临床中患者的主要临床表现为肝区胀痛、纳差、乏力、消瘦、腹胀等情况[9]。同时,肝内胆管细胞癌的特性为局部播散性,并且会存在淋巴结转移情况,在通过切除手术治疗后,复发率以及远处转移率较高,肝细胞癌患者的预后效果较差[10]。在肝内胆管细胞癌切除术治疗后,通过全身化疗,能将体内残留癌细胞进行杀灭[11]。化疗通过供血动脉注入化学药物,能够将潜在的肿瘤细胞直接杀灭,避免肿瘤复发以及发生转移,并且用药量较少,不会给患者带来较为严重的全身毒性反应[12]。另外,辅助化疗还能够对肿瘤细胞的增殖起到抑制作用,还能够对肝内胆管细胞癌经血液途径的转移进行有效的控制,从而使术后复发率有效降低,可行性较高[13]。
本研究肝内胆管细胞癌患者通过切除术治疗,术后1 个月后患者的体质基本恢复,能耐受介入创伤以及化疗的药物毒性反应。相关报道表明,患者术后半年内属于肿瘤患者的复发转移高发期[14]。因此,第2 次通过肝内胆管细胞癌切除术的最佳时期应该在术后6 个月,从而对肿瘤细胞的增殖以及扩散起到有效的抑制作用。还有研究表明,通过对患者的血清CA19-9、CEA 含量进行检测,能够对早期肝内胆管细胞癌患者的复发率进行预测[15]。其他学者表明,通过检测AFP、ALT 水平,能够对肝细胞癌患者通过根治切除术后的早期复发情况进行预测,并且预测效果良好[16]。本研究结果显示,观察组患者的血清CA19-9、AFP、CEA、ALT 水平明显降低,由此可见,肝内胆管细胞癌患者通过肝内胆管细胞癌切除术辅助化疗方法进行治疗,能有效提升临床疗效,降低血清CA19-9、AFP、CEA、ALT 水平,从而降低肝内胆管细胞癌患者的疾病复发率。
还有学者的研究表示,肝内胆管细胞肿瘤的大小、数量、淋巴结转移率、术前血清CA19-9、AFP、CEA、ALT 水平、手术切缘以及毗邻组织器官的侵犯情况,均对其预后效果起到显著的影响作用[17]。而本研究采用肝内胆管细胞癌切除术辅助化疗方法进行治疗,化疗药物包括吉西他滨以及顺铂,吉西他滨联合顺铂属于最基础的化疗方案,对于具有较高复发风险的患者来说,能有效延长其生存时间。本研究结果表明,观察组的平均生存时间为(23.46±10.40)个月。以往研究表示:患者通过单纯肝内胆管细胞肿瘤切除术治疗,其平均生存时间只有(15.55±7.86)个月,由此可见,经过肝内胆管细胞肿瘤切除术联合化疗治疗,能有效延长生存时间。胡春秀等[18]的研究表示:化疗患者的生存时间为(24.8±1.26)个月,未化疗患者生存时间为(15.8±1.03)个月。本研究结果表示:观察组患者经过治疗后,其并发症发生率为10.0%,其中肝功能衰竭1例,胆道感染1 例,胆源性肝脓肿1 例。说明患者经过肝内胆管细胞癌切除术辅助化疗进行治疗,既能够保证患者的治疗效果,还能够保证患者的治疗安全性。
综上所述,肝内胆管细胞癌患者通过肝内胆管细胞癌切除术治疗,临床疗效欠佳,辅助化疗治疗后,能够有效提升临床治疗效果,降低血清CA19-9、AFP、CEA、ALT 水平,延长患者的生存时间,临床价值高。但因为肝内胆管细胞癌的发病率较低,本研究纳入的患者数量较少,因此,肝内胆管细胞肿瘤切除术辅助术后化疗对于肝内胆管细胞癌患者的临床疗效是否确切,仍然需要增加样本数量,深入研究加以确认。

