不同血糖控制状态的2型糖尿病患者肠道菌群的差异和预测价值
闫 肃,秦 迁,陈静锋,杨 阳,闫 航,李田田,高鑫鑫,王佑翔,丁素英
1)郑州大学公共卫生学院流行病学教研室 郑州 450001 2)郑州大学第一附属医院健康管理中心 郑州 450052
随着经济水平的发展,2型糖尿病(type 2 diabetes mellitus,T2DM)的发病率逐年上升。2020年的流行病学调查[1]显示我国糖调节受损患病率达15.5%,T2DM患病率达11.2%,T2DM中血糖控制不理想者超过60%。长期处于高血糖状态会引发冠心病、脑卒中、肾动脉硬化和狭窄、肢端动脉硬化等疾病,给家庭和社会带来沉重负担[2]。但T2DM的发病机制复杂,至今尚未完全阐明。除了经典的胰岛素抵抗学说,近年来研究[3]发现“人体第二基因组”——肠道菌群,在肥胖、糖尿病等代谢疾病的发生发展中起着关键的作用。肠道菌群参与了人体的消化吸收、糖脂代谢、能量转运、免疫等过程[4],肠道菌群的紊乱还会影响代谢疾病(肥胖、糖尿病等)的发生发展[5]。目前的研究[6-9]发现T2DM患者肠道菌群中乳酸杆菌增加,而双歧杆菌减少;在服用了二甲双胍之后,肠杆菌科细菌、酵母菌减少,双歧杆菌、拟杆菌增多。以上研究主要着重于T2DM肠道菌群变化及相关的药物干预研究。本研究着重于从α多样性、β多样性以及物种差异等多方面分析不同血糖控制状态的T2DM患者肠道菌群特征,并基于差异肠道菌群数据建立T2DM患者血糖控制情况的预测模型,探讨基于肠道菌群来干预血糖代谢和强化血糖控制的可行性。
1 对象与方法
1.1 研究对象研究对象来源于2018至2019年在郑州大学第一附属医院体检的人群,参与者均已签署知情同意书,该研究由该院伦理委员会审核批准(2018-KY-90)。纳入标准:具备完整的问卷调查结果和体检结果;年龄在20~70岁;体检显示颈部血管彩超、心脏彩超、腹部彩超、泌尿系统彩超无明显异常;诊断为T2DM,糖化血红蛋白(glycosylated hemoglobin,HbA1c)大于6.5%。根据微生物α多样性计算样本量[10],以检验水准为0.05、把握度为80%,通过PASS软件计算可知至少需要60例样本。最终共纳入72例,其中27例血糖控制理想(HbA1c<7%),45例血糖控制不理想(HbA1c≥7%)。
1.2 数据收集由接受过统一培训的人员进行健康风险评估问卷调查及健康体检,收集人口学特征、病史、生活习惯、身高、体重、腰围、收缩压、舒张压等资料。禁食12 h后抽血检测空腹血糖(fasting blood-glucose,FBG)、HbA1c、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL),使用罗氏全自动生化分析仪(Cobas-8000)进行检测。采集粪便标本,单独分装后放入-80 ℃冰箱冷冻待测。
1.3 肠道菌群宏基因组测序使用粪便DNA提取试剂盒(Magen中国)提取粪便标本中微生物群落DNA。使用Qubit dsDNA BR试剂盒(美国Invitrogen公司)与Qubit荧光计对DNA进行定量,并检测提取质量。基因组DNA被超声破碎形成随机化片段并进行挑选,挑选的片段经扩增、纯化等步骤后得到单链环状DNA,格式化后形成最终文库,并通过质量控制鉴定。合格文库在BGISQ-500平台(BGI-深圳,中国)上测序。对测序数据进行定性控制,去除混杂序列,包括人体基因组序列、食物基因组序列、低质量序列等。通过Metaphlan2对测序文库进行宏基因组分类和注释,得到各层次物种的标准相对丰度值。
1.4 统计分析使用R4.0.2、STAMP2.1.3和PASS 15进行统计分析。采用两独立样本t检验或χ2检验比较2组人口学、实验室检测指标和人体测量指标的差异。使用STAMP软件分析组间菌群相对丰度的差异,2组间比较采用Mann-Whitney非参数检验,多变量校正采用Benjamini-Hochberg FDR;计算每组的菌群阳性率并去除阳性率低于10%的数据以去除可能的假阳性。根据微生物种类及其相对丰度,使用R语言“vegan”包分别计算每个样本的shannon指数和obs指数、样本间的bray距离和Spearman距离,用于分别判断α、β多样性,然后采用两独立样本t检验比较2组α多样性,采用“ade4”包进行主坐标分析比较β多样性。预测模型采用Logistic回归模型,将得到的差异菌群的相对丰度作为自变量,以血糖控制情况为因变量,采用逐步法进行Logistic回归分析,构建预测模型,利用“pROC”包绘制预测模型的ROC曲线,检验水准α=0.05。
2 结果
2.1 2组患者一般资料的比较2组患者在性别、年龄、腰围、BMI、收缩压、舒张压、TC、TG、HDL、LDL、规律饮食、饮食习惯、食用全谷物、饮用酸奶、吸烟、饮酒、运动情况、服用降糖药等方面差异均无统计学意义(P>0.05);与血糖控制理想组相比,血糖控制不理想组的FBG和HbA1c较高(P<0.05)。见表1。
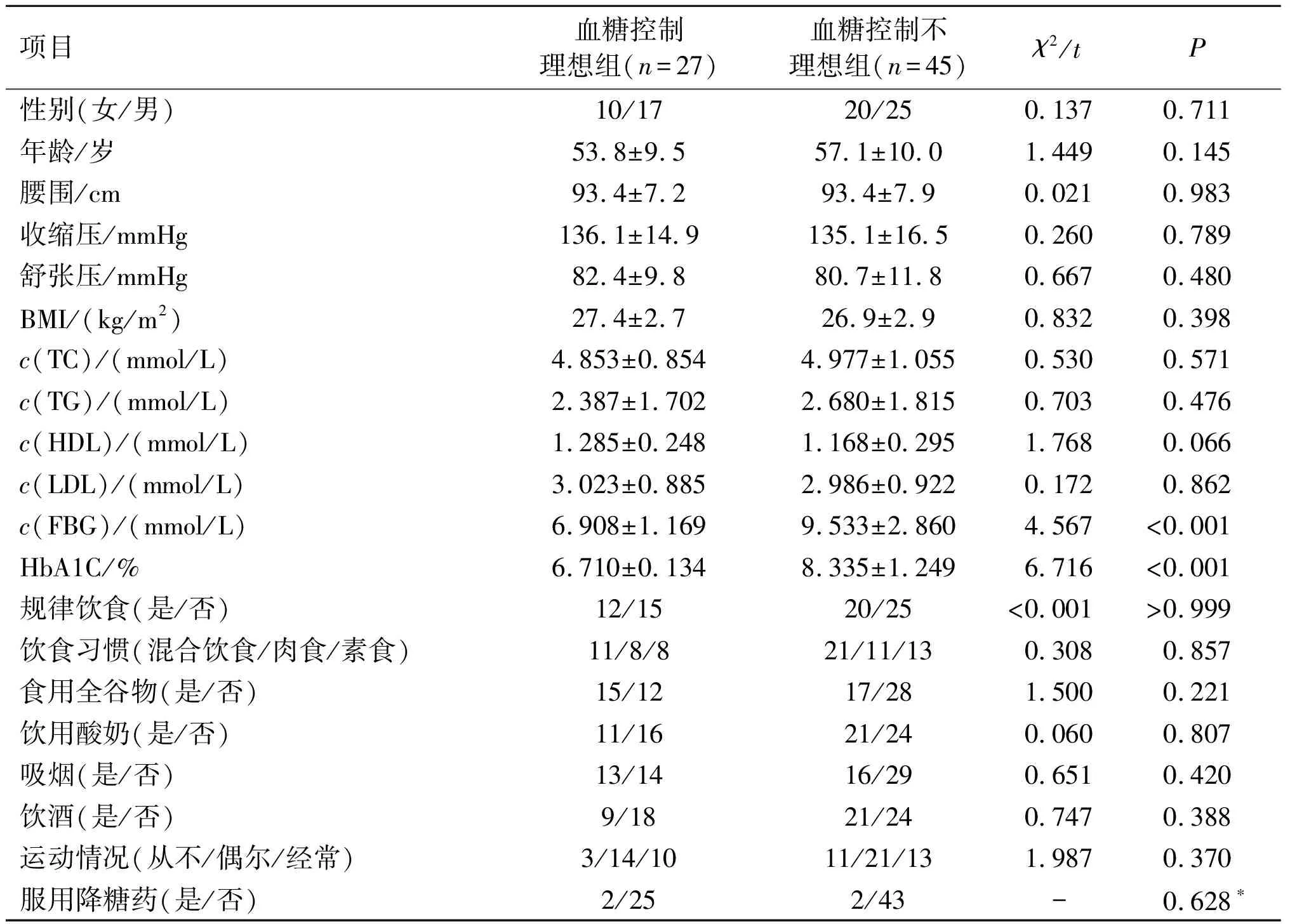
表1 2组患者一般资料的比较
2.2 2组肠道菌群多样性的差异由图1可知,在α、β多样性上,血糖控制理想组与血糖控制不理想组差异均无统计学意义(P>0.05)。
2.3 2组肠道菌群相对丰度的差异在种水平上,对比2组间菌群丰度的差异,发现有17个种的相对丰度存在差异,其中有4个种富集于血糖控制理想组,分别为Coprococcuscomes、Fusobacteriumulcerans、Bacteroidesintestinalis、Ruminococcusgnavus,13个种富集于血糖控制不理想组,分别为Mitsuokellamultacida、Acidaminococcusunclassified、Klebsiellapneumoniae、Bacteroidesfinegoldii、Bacteroidescoprophilus、Citrobacterunclassified、Parabacteroidesunclassified、Lactobacillusruminis、Megamonasrupellensis、Bacteroidesuniformis、Enterococcusfaecalis、Megamonashypermegale、Dialistersuccinatiphilus(图2)。
2.4 T2DM患者血糖控制情况预测模型的建立与评价基于前文中的差异菌群,拟合Logistic回归模型用于疾病的预测,采用逐步法,进入概率0.05,排除概率0.1,最后Ruminococcusgnavus、Bacteroidesintestinalis和Enterococcusfaecalis纳入模型。根据回归模型绘制ROC曲线,结果显示ROC曲线的AUC为0.770(95%CI:0.665~0.875),灵敏度为0.655,特异度为0.852,约登指数为0.507,见图3。
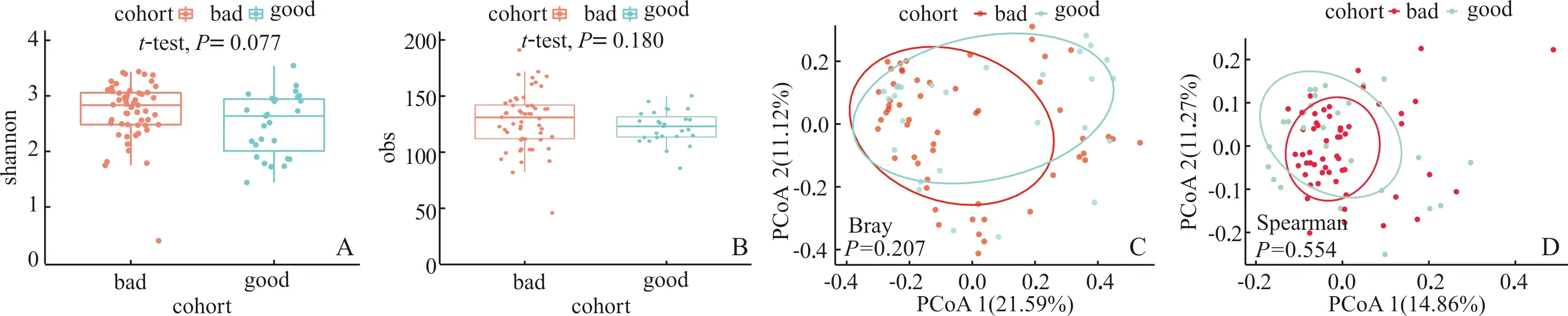
A、B:α多样性评价;C、D:β多样性评价;good:血糖控制理想组;bad:血糖控制不理想组;PCoA1(21.59%)表示第一主成分能够解释总体可变性的21.59%;PCoA2(11.12%)表示第二主成分能够解释总体可变性的11.12%
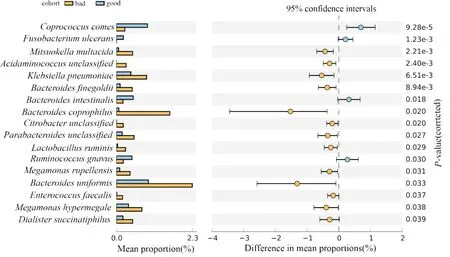
图2 2组患者菌群相对丰度的差异

图3 肠道菌群预测T2DM患者血糖控制情况的ROC曲线
3 讨论
众所周知,T2DM治疗主要依靠生活方式干预及药物治疗,但仍然有部分人群的血糖控制不理想。研究[5]表明肠道菌群可以通过影响人体的多糖分解代谢来调控血糖稳态,这为T2DM的防治提供了新思路。因此,本研究分析了T2DM人群中血糖控制情况与菌群分布情况,为调控血糖提供新的思路。
在本研究中,血糖控制理想和不理想组年龄、性别、BMI、腰围、血压、血脂、生活习惯差异无统计学意义。进一分析肠道菌群的α与β多样性,发现2组间差异也无统计学意义。本研究将优势菌定义为至少在10%的样本中出现,以去除可能的假阳性,菌群丰度分析结果表明,4个菌种富集于血糖控制理想组,13个富集于血糖控制不理想组。其中Coprococcuscomes、Ruminococcusgnavus、Bacteroidesintestinalis等富集在血糖控制理想组。Graessler等[11]发现减肥手术后患者Coprococcuscomes的丰度增加,并且伴随着血糖水平的降低与血脂的改善,这可能是由于Coprococcuscomes能够利用果糖与葡萄糖产生丁酸盐,从而增加了短链脂肪酸(short chain fatty acids,SCFA)的水平[12]。此外,有研究[13]表明富集在血糖控制理想组的Ruminococcusgnavus能够利用岩藻糖基化聚糖增加SCFA的水平。SCFA具备调节免疫、改善系统性炎症及调节血糖代谢等功能[14]。这可能是由于SCFA一方面能够抑制肿瘤坏死因子、干扰胰岛素信号通路的蛋白质,从而增加骨骼肌葡萄糖摄取[15],另一方面还可以通过促进脂肪细胞中的葡萄糖转运蛋白4基因表达来增加肝细胞对葡萄糖摄取,最终达到调节血糖的作用[16];动物研究[17]还表明,SCFA可以提高糖尿病动物胰岛素敏感性,改善血糖控制情况。在使用小麦肽和岩藻多糖组合治疗成人慢性浅表性胃炎时发现Bacteroidesintestinalis明显增加,胃痛、腹胀等症状显著减少,同时粪便中钙卫蛋白水平降低,SCFA水平增加[18]。另一项菌群培养实验[19]发现,Bacteroidesintestinalis能够降解膳食纤维中常见的阿拉伯木聚糖而产生阿魏酸。阿魏酸是一种酚类化合物,具有免疫调节、抗氧化和抗炎活性。综上可知,这些菌作为益生菌,主要是SCFA的生产者,可以改善肥胖和T2DM的宿主代谢,降低炎症反应,减轻免疫紊乱。
而在血糖控制不理想组中,Enterococcusfaecalis的丰度较血糖控制理想组高。研究[20]表明Enterococcusfaecalis可以将三甲基赖氨酸代谢为TMAVA(N,N,N-三甲基-5-氨基戊酸),从而减少SCFA的分泌,促进肝脏脂肪积累,导致肝脏脂肪变性和诱发胰岛素抵抗,提示在血糖控制不理想的状态下,Enterococcusfaecalis可能加重了胰岛素抵抗。除了降低SCFA的水平,我们在血糖控制不理想组还发现条件致病菌Bacteroidescoprophilus,Citrobacterunclassified,Lactobacillusruminis和Klebsiellapneumoniae。它们很少引起严重感染,但却是导致菌血症等疾病的机会病原体[21]。研究[22]表明:它们能够促进炎症因子表达,包括白介素1β、肿瘤坏死因子α和白介素17等;此外,还能够编码特异性抗原,刺激B淋巴细胞分泌特异性抗体与之结合从而引起肠道异常炎症变化等。值得一提的是,大约5%的健康人肠道内存在Klebsiellapneumoniae。其导致炎症反应主要是通过产生丰富的荚膜多糖(CPS),从而引起侵袭性综合征[23],而高血糖水平可能会刺激CPS生物合成和cps基因表达,进一步导致Klebsiellapneumoniae对中性粒细胞的吞噬作用耐受,最终促进侵袭性综合征的发生发展,这可能进一步辅证了T2DM血糖控制不理想容易并发各种感染性疾病及伤口不容易愈合。综上可知,富集在血糖控制不理想组的菌群一方面通过减少SCFA的分泌导致胰岛素抵抗,促进慢性炎症,导致脂肪沉积,加重脂毒性和胰岛素抵抗;另一方面,通过条件致病菌导致炎症反应,加速T2DM感染性疾病的发生发展。
最后,基于菌群差异分析的结果,采用Logistic逐步回归法构建血糖控制情况预测模型,其AUC值为0.770,这表明基于肠道菌群可以辅助预测人体血糖控制情况。
总之,本研究系统分析探究了T2DM人群中血糖控制理想者和血糖控制不理想者肠道菌群的差异,基于这些差异建立了肠道菌群血糖控制情况预测模型并取得了良好的预测效果,为基于肠道菌群精准膳食和精准医疗提供了新思路。

