Ⅱ/Ⅲ期胃癌术后患者预后预测模型的建立
李 婧,梁何俊,隋 鑫,秦艳茹
郑州大学第一附属医院肿瘤科 郑州 450052
胃癌是我国常见消化系统恶性肿瘤,在我国发病率和死亡率仍居高不下,均位列所有恶性肿瘤的第二位,严重威胁着我国人民的生命健康[1-2]。早期胃癌患者预后良好,但绝大多数患者就诊时已处于局部进展期[3]。尽管D2切除术联合围手术期化疗/化放疗的综合治疗模式已被临床广泛采用,但仍有25%~48%患者发生局部复发和远处转移,严重影响患者的长期生存[3-4]。
美国癌症联合委员会(AJCC)建立的TNM分期系统是目前最为通用的肿瘤分期系统[5],但对于Ⅱ/Ⅲ期胃癌,由于TNM分期系统中仅包含两种要素(pT分期、pN分期),其预测作用已显示出局限性。临床中观察到,即使患者分期相同,预后也具有较大差异[6]。因此,亟须建立更为精准的预后预测模型,从而更好地评估预后及指导治疗。
列线图是一种基于多因素回归分析的概率预测工具,可通过整合更多的临床病理学特征,帮助临床医生更好地评估患者的整体预后,是目前预后预测辅助工具之一[7-8]。炎症与肿瘤的发生发展密切相关,既往研究[9-12]已证实炎症指标(如淋巴细胞数目、血小板数目、C-反应蛋白等)与多种肿瘤的预后密切相关,包括食管癌、胃癌、鼻咽癌、肺癌和胰腺癌等。
近年来,已有多项研究[13-14]报道了列线图模型用于胃癌患者复发、转移以及总体生存情况的预后预测,本研究拟全面整合病理学参数、炎症指标参数以及肿瘤标志物,通过建立多参数、多维度的Ⅱ/Ⅲ期胃癌患者预后预测模型,为中国Ⅱ/Ⅲ期胃癌患者提供更精准的预后预测方法,从而帮助临床医生更好地评估预后以及指导治疗。
1 资料与方法
1.1 临床资料本研究数据集来源于2012年1月至2017年12月在郑州大学第一附属医院接受根治性手术的Ⅱ/Ⅲ期胃癌患者。病例的纳入标准:①组织病理学证实为原发性胃腺癌。②年龄>18岁且<80岁。③行胃癌根治术,术前未行任何抗肿瘤治疗。④有完整的临床以及随访资料,血液学指标均为术前1周内测量。⑤生存期≥3个月。排除标准:①非肿瘤原因死亡。②合并严重的重要器官疾病。③合并其他肿瘤。最终共有535例被纳入本研究,按4∶1比例随机分为训练集(n=428)和验证集(n=107)。本研究经医院伦理委员会批准;匿名使用患者数据,免于签署知情同意书。
收集的数据包括确诊年龄、性别、肿瘤位置、分化程度、肿瘤大小、TNM分期、肿瘤浸润深度、淋巴结转移状况、辅助化疗与否、术前1周炎症指标水平、术前1周肿瘤标志物水平。通过电话询问和最新门诊复查获得随访数据,随访截止日期为2020年10月22日。在最初的2 a中,每3个月进行1次复查;其后的3~5 a中,每6个月复查1次;之后每年复查1次,直到死亡或最后1次随访。总生存期(overall survival,OS)为确诊日期至随访截止日期或死亡的时间。无病生存期(disease-free survival,DFS)为确诊日期至肿瘤复发、死亡或随访截止日期的时间。
1.2 分类变量界限值的确定在训练集中,通过ROC曲线和最大约登指数确定影响OS和DFS的预后因素的分类界限值。在本研究中,各因素最佳截止值:确诊年龄为70岁;肿瘤直径为3.3 cm;中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)为2.02;白细胞/淋巴细胞比值(leucocyte-to-lymphocyte ratio,WLR)为3.26;血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)为137.5;纤维蛋白原淋巴细胞比值(fibrinogen-to-lymphocyte ratio,FLR)为1.94; 人血白蛋白纤维蛋白原比值(albumin-to-fibrinogen ratio,AFR)为11.84;糖链抗原-125(carbohydrate antigen 125,CA-125)为 9.4 U/mL; 糖链抗原-199(carbohydrate antigen 199,CA-199)为13.8 U/mL;癌胚抗原(carcinoembryonic antigen,CEA)为5.1 μg/L。根据获得的上述数据,年龄、肿瘤直径、炎症指标和肿瘤标志物可分为高水平组和低水平组。
1.3 统计学处理采用SPSS 26.0进行单因素和多因素Cox回归分析,以确定预后相关因素和危险因素。由R软件(4.0.2版)根据风险因素建立列线图。一致性指数(concordance index,C指数)和校准曲线用于评价列线图预测模型的预测能力和准确性。应用χ2检验比较训练集和验证集两组间各项指标的差异。检验水准α=0.05。
2 结果
2.1 训练集和验证集基线特征比较见表1。
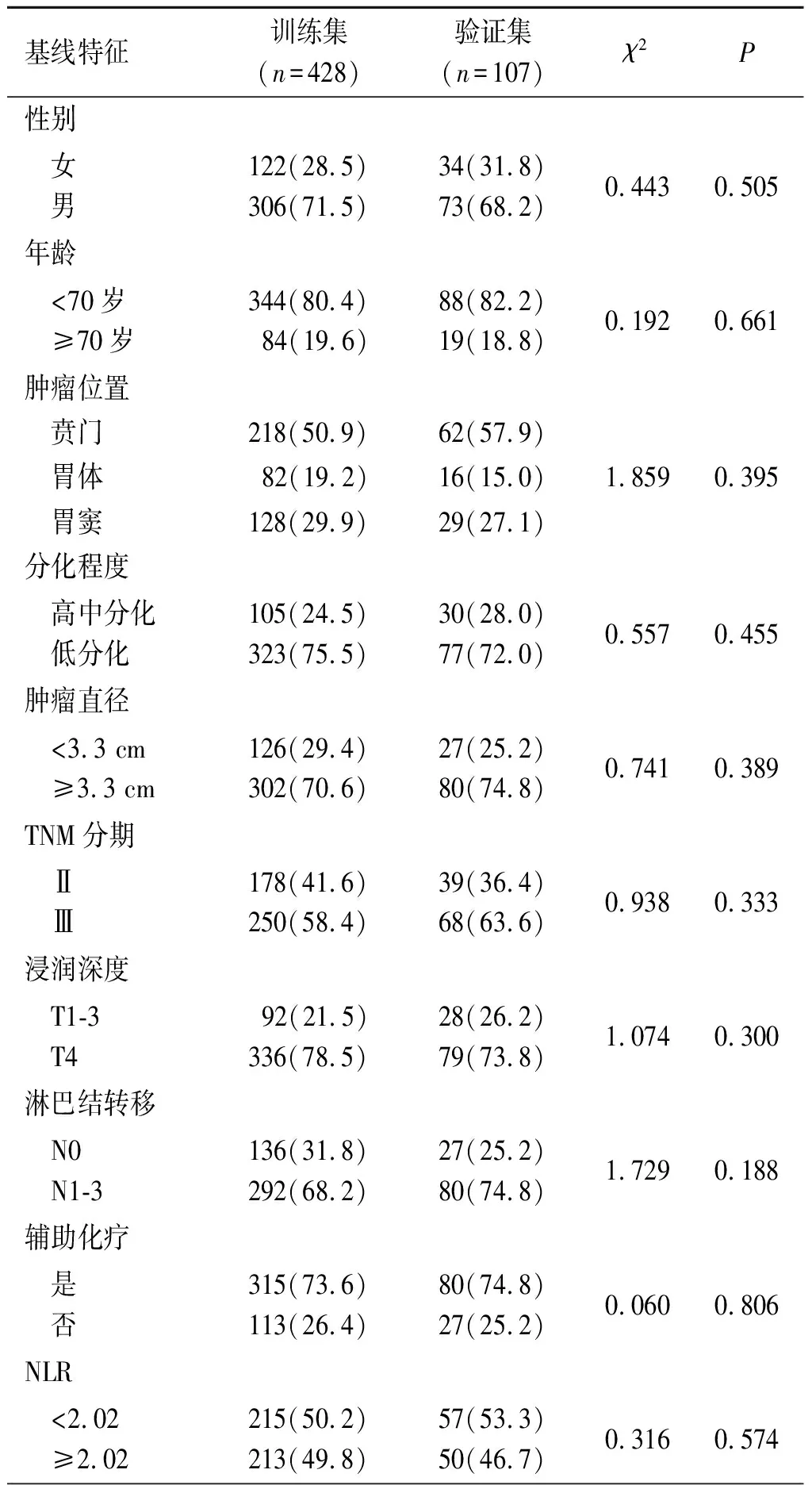
表1 训练集和验证集基线特征比较 例(%)

续表1
2.2 OS和DFS预后影响因素的Cox回归分析结果见表2、3。回归分析结果提示年龄、分化程度、浸润深度、淋巴结转移状态、AFR和CEA是OS的影响因素。分化程度、浸润深度、淋巴结转移状态、PLR和CEA为DFS的影响因素。
2.3 预测模型列线图的构建与预测效果评价基于2.2回归结果构建预测Ⅱ/Ⅲ期胃癌根治术后患者OS和DFS的列线图(图1)。训练集列线图A的C指数[HR(95%CI)为0.726(0.688~0.763)]高于第8版TNM分期系统的C指数[HR(95%CI)为0.650(0.616~0.683)],列线图B的C指数[HR(95%CI)为0.720(0.682~0.758)]高于第8版TNM分期系统的C指数[HR(95%CI)为0.649(0.615~0.683)]。在验证集中显示同样的结果,列线图A和列线图B的C指数[HR(95%CI)分别为0.746(0.678~0.814)和0.710(0.640~0.781)]高于第8版TNM分期系统的C指数[HR(95%CI)分别为0.646(0.583~0.708)和0.642(0.580~0.706)]。训练集和验证集中OS和DFS预测校准曲线与理想参考线拟合度良好,表明模型预测值和实际值具有良好的一致性(图2、3)。
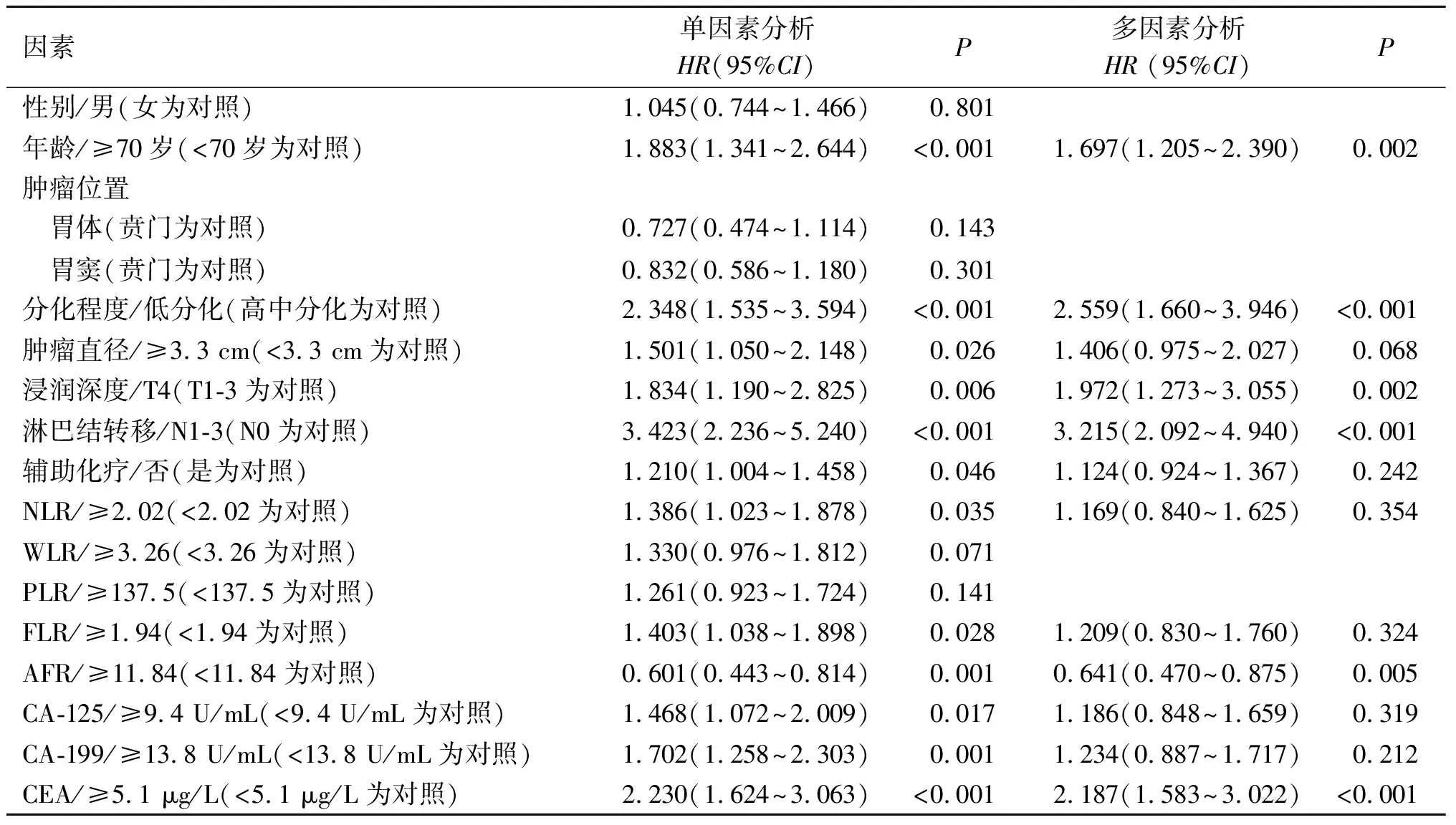
表2 OS影响因素的Cox回归分析结果
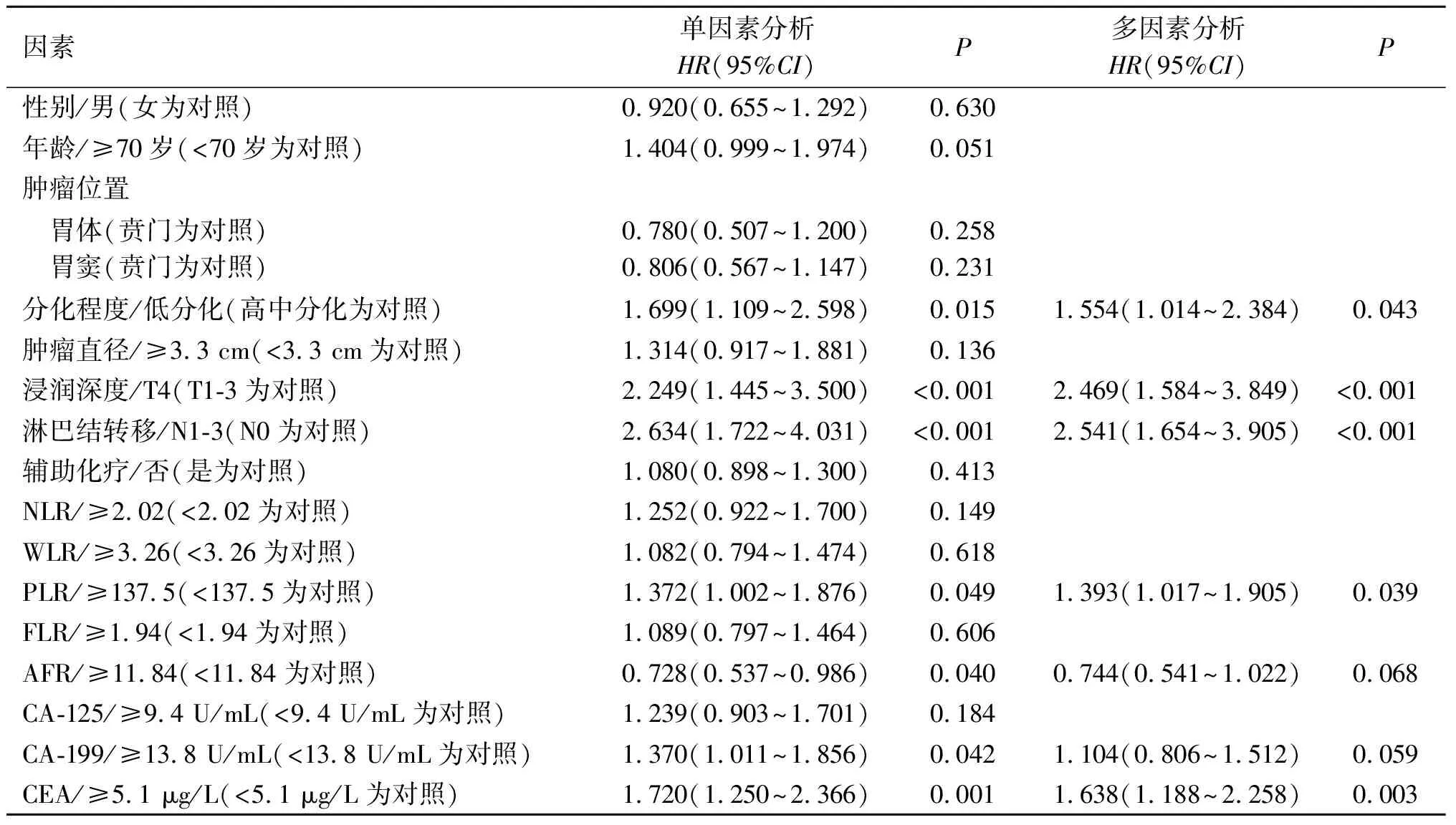
表3 DFS影响因素的Cox回归分析结果
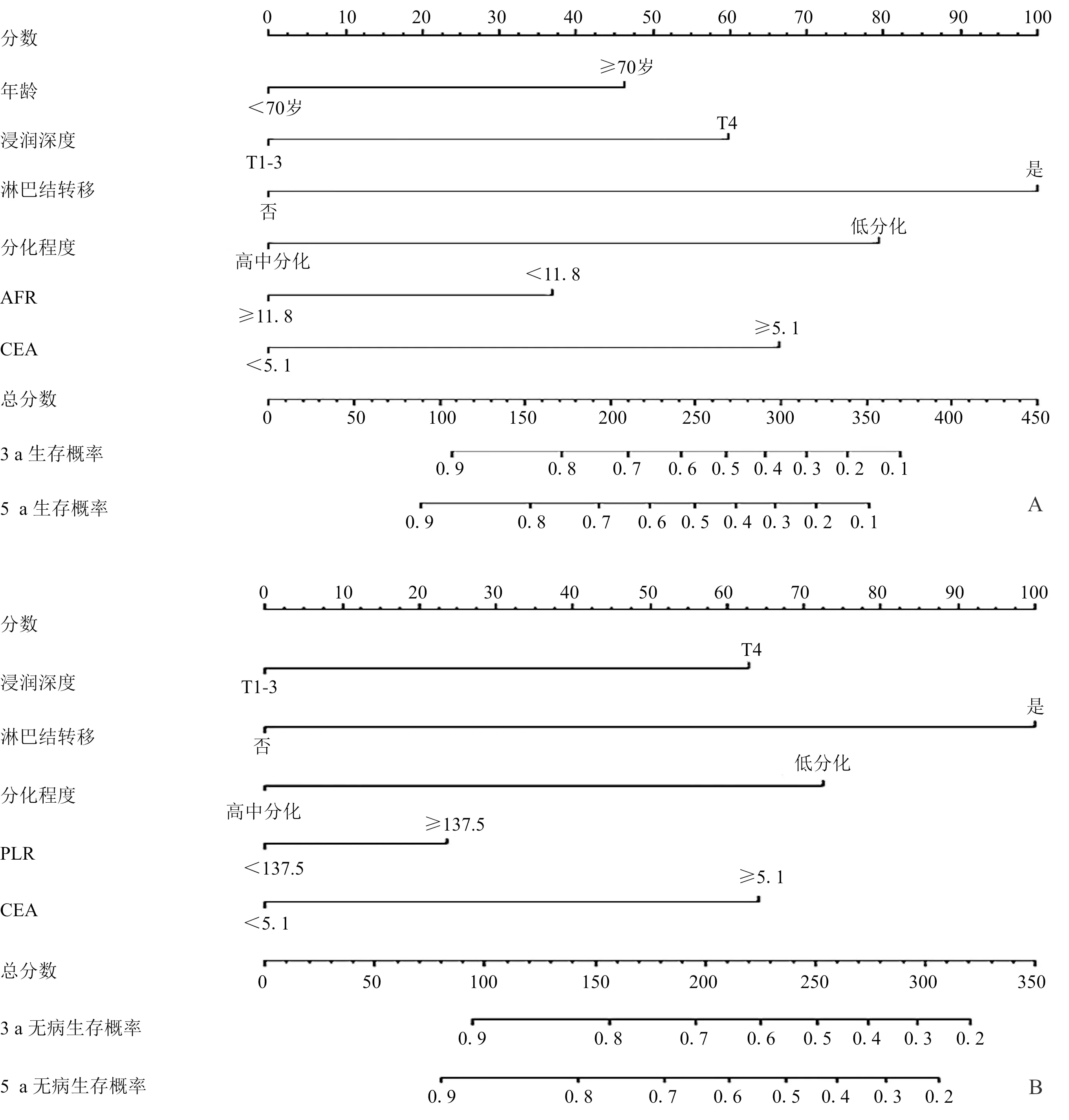
图1 预测Ⅱ/Ⅲ期胃癌术后OS(A)和DFS(B)的列线图
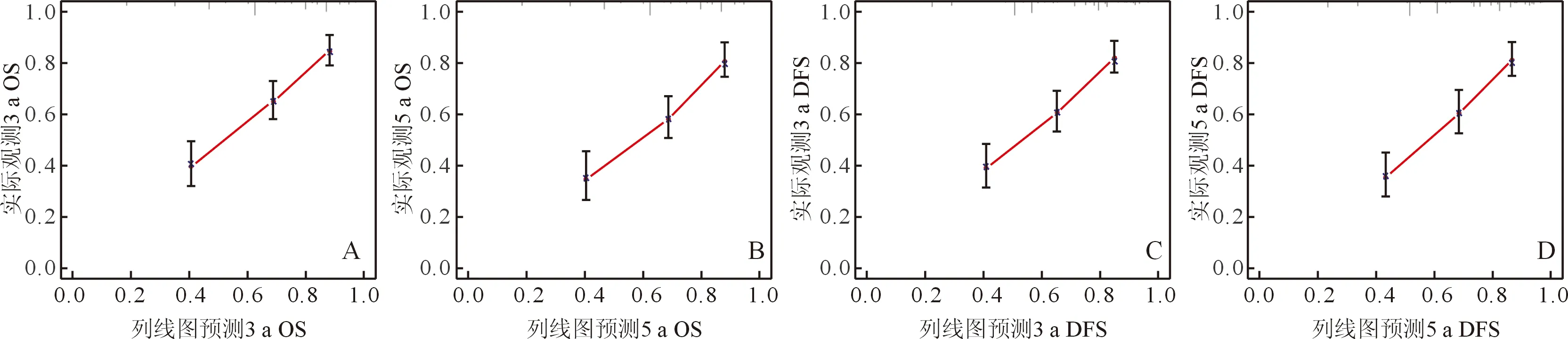
图2 训练集3 a、5 a OS(A、B)和DFS(C、D)预测校准曲线
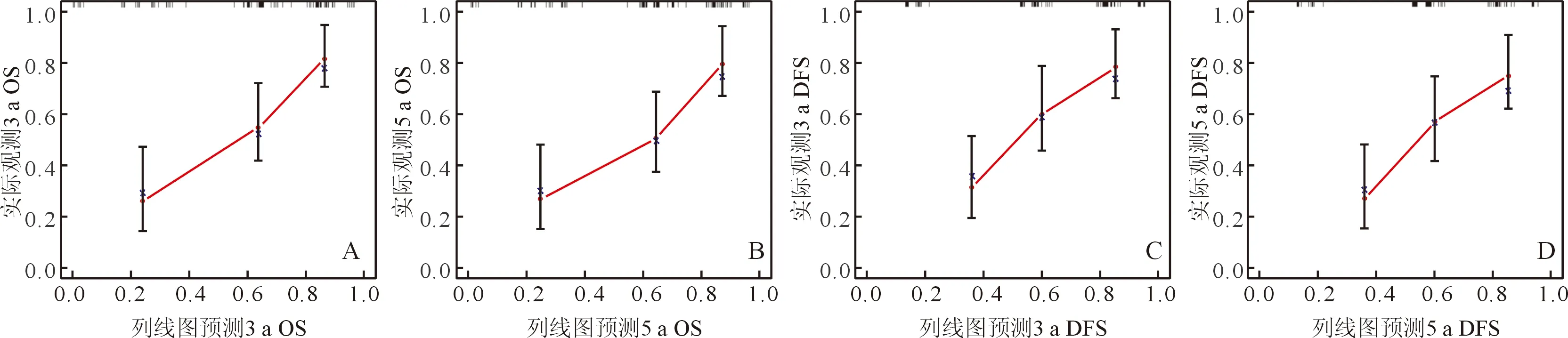
图3 验证集3 a、5 a OS(A、B)和DFS(C、D)预测校准曲线
3 讨论
本研究将临床病理学参数、基线水平炎症指标以及肿瘤标志物共同纳入Cox回归,构建了Ⅱ/Ⅲ期胃癌患者预后预测模型。较第8版AJCC-TNM分期,该列线图模型更为准确地预测了OS(C指数=0.726)与DFS(C指数=0.720)。
年龄和肿瘤分化程度常常是影响患者预后的重要因素。作为现有具有一定准确性及区分效力的预后决策辅助工具之一,列线图模型已广泛应用于多种肿瘤的预后预测研究[15-17]。该模型需结合多种预后相关因素对恶性肿瘤进行风险评估及量化,其中,年龄和分化程度常作为预后因素纳入列线图模型中。与既往研究一致,在我们的研究中,年龄和肿瘤分化程度依然影响Ⅱ/Ⅲ期胃癌患者OS的预后因素;分化程度是影响DFS的预后因素,差异有统计学意义;年龄具有临界性意义。
肿瘤标志物是临床常用检测肿瘤发生发展和评估治疗疗效的标记物[18-20]。CEA最早于1965年由Gold和Freedman发现,其可作为选择素的配体,促进肿瘤细胞的转移,是目前临床上常用的监测胃癌患者发病、评估预后及治疗疗效的肿瘤标志物。既往文献[21]报道术前及术后CEA较高的患者,预后最差,术后CEA降低水平可有效监测Ⅱ/Ⅲ期胃癌患者手术治疗疗效。Deng等[22]的一项荟萃分析纳入了41项研究的14 651例胃癌患者,结果显示,CEA阳性患者的OS、DFS及疾病特异生存期(disease-specific survival,DSS)均较CEA阴性患者差,是胃癌的预后因素。
炎症和营养状态与肿瘤的发生发展密切相关[23]。抗感染治疗及营养支持治疗可显著提高肿瘤患者的预后[24]。同时,大量国内外文献报道了炎症指标(如中性粒细胞数目、淋巴细胞数目,血小板数目以及它们的比值NLR、PLR等)及营养状况指标(如白蛋白)可有效预测患者的临床结局[12,16,25-26]。白蛋白较高的患者预后较好,术后并发症较少,OS更长[27-28]。纤维蛋白原(fibrinogen,FIB)是由肝细胞合成和分泌的糖蛋白,不仅是全身止血反应的关键蛋白,同时也是全身炎症反应和肿瘤发生发展的重要作用因子[27]。已证实,FIB可显著促进肿瘤细胞的增殖、侵袭、上皮间充质转化进程以及肿瘤的血管生成[29]。既往多项研究[30-31]显示,FIB与多种肿瘤的预后密切相关,FIB较高的患者无论总生存还是无进展生存均较短。近年来,已有多项研究证实基于炎症指标参数建立的列线图模型,其预后预测效能较第8版TNM分期更优:Shi等[16]将免疫-炎症指数、NLR等炎症指标纳入、建立胃癌列线图模型,其预测患者3 a/5 a生存的准确性更好(列线图C指数=0.74;TNM分期C指数=0.70);Cho等[32]将炎症指标(包括NLR,dNLR,淋巴细胞/单核细胞比值,PLR)纳入建立了乳腺癌列线图预后预测模型,同样显示出卓越的预测效能(C指数=0.82)。
本研究结果表明患者的年龄、浸润深度、淋巴结转移状态、分化程度、AFR及CEA与OS有关,是Ⅱ/Ⅲ期胃癌预后的预测因素;而与DFS密切相关的指标是浸润深度、淋巴结转移状态、分化程度、PLR和CEA。我们将这些因子分别纳入列线图A和列线图B中,与AJCC-TNM分期相比,均具有更高的预测效能和评估能力。并且,经内部验证,该模型的预测值与实际观察值拟合度良好。
本研究仍存在一定的局限性。首先,本研究是单中心回顾性研究,样本量相对较少,存在一定的选择性偏倚。其次,虽然我们进行了内部验证,但缺乏外部验证,而外部验证可更好地确定该模型的稳定性。第三,在中国临床实践中,对Ⅱ/Ⅲ期胃癌患者术后常采用辅助化疗或辅助放化疗,但在本研究中由于辅助治疗不是预后因素而未能纳入该模型中。因此,我们需要进行更大样本量的多中心前瞻性研究,对该预测模型进行验证。
综上所述,我们的研究建立了列线图A和列线图B,模型纳入了年龄、分化程度、浸润深度、淋巴结转移情况、炎症指标及肿瘤标志物等多种与Ⅱ/Ⅲ期胃癌相关的预后因素,具有较好的校准及区分效能(C指数>0.70)。与第8版AJCC-TNM分期相比,该模型具有更好的预后预测作用,可为胃癌患者提供更为准确的预后评估及疗效指导,具有良好的临床应用前景。

