磷肥和生物炭配施对杉木林地土壤微生物的影响
包明琢,曲雪铭,高倩倩,于姣妲,周垂帆,2*
(1.福建农林大学 林学院,福建 福州 350002;2.人工林可持续经营福建省高校工程研究中心,福建 福州 350002)
杉木是我国南方重要的速生用材树种,其人工林种植面积和蓄积量均居我国人工林首位[1],磷是植物生长发育中必不可少的元素之一,对植物生长发育具有十分重要的影响[2]。土壤全P含量较高而有效P不足,会限制林业的可持续发展[3],因此在林业生产中会施入P肥来提高有效P的含量从而促进植物的生长,但近年来土壤质量下降,杉木人工林经营普遍出现了“第2代效应”[4],多代连栽造成杉木人工林土壤有效P不足,林区土壤地力衰退问题日益严峻,林分生产力下降,制约着我国南方杉木人工林的可持续经营[5]。近几年来,国内外众多研究证实,向土壤中施加生物炭可减少对土壤中P素的固定,促进土壤中难溶态磷的活化作用[6],然而当前的研究多是短期效应,长期影响评估不足,且林庆毅[7]研究发现,在土壤环境中的生物炭会因酸雨等因素的影响而发生老化,生物炭pH因此降低,进而对酸性土壤的改良作用减弱。因此,将生物炭施入土壤后,生物炭的理化性质会随着土壤的酸化发生一定的改变,这种改变必然在一定程度上影响土壤肥力与土壤微生物。土壤微生物是土壤生态系统的重要组成部分,是土壤物质循环和能量流动的重要参与者,与土壤理化性质种类密切相关,客观反映了土壤肥力状况[8],其组成和活性对土壤肥力的保持和提高具有重要意义[9]。
鉴于此,本研究以福建南平市王台镇第2代杉木人工林林地土壤为研究对象,研究P肥施用的前提下,生物炭氧化后对土壤理化性质和土壤微生物数量以及多样性是否会发生不利影响,为评估生物炭在杉木人工林土壤改良的长期应用提供参考,为提高我国南方杉木人工林土壤质量及可持续经营提供理论依据。
1 材料与方法
1.1 材料与制备
本试验以南平市王台镇第2代杉木人工林(117°57′E,26°28′N)的酸性红壤为供试土壤,其土壤为白云母中细粒花岗岩发育的山地暗红壤,获取方法:于二代杉木人工林林分内选4个同林龄的林分样地做样方(20 m×20 m),在各样方对角地取0~20 cm土层的土样并混合,去除石块、根系等杂物,风干过2 mm筛后经自然风干后保存备用(土壤全P含量为0.069 g·kg-1、速效P含量为5.85 mg·kg-1、全N含量为2.13 g·kg-1、pH为4.31)。同时以在土壤采样点采集的杉木叶作为原材料,用去离子水洗净后在80 ℃下进行干燥,后磨碎过1 mm筛,将制备的杉木叶粉放于马弗炉中,设置600 ℃的高温,缺氧裂解4 h得到生物炭,参照林庆毅等[10]的研究方法,采用超纯水淋洗,为去除灰分物质,取80 g生物炭样品浸入到1 L超纯水中,在70 ℃下保持6 h,再用1 L的超纯水每隔2 h淋洗1次,共淋洗3次,在烘箱中烘干后称重并放于玻璃瓶中,制得水洗生物炭(WBC)。参照文方园等[11]的研究方法,取500 mL 20%的H2O2与80 g生物炭混合反应,于振荡器中振荡1 d后离心并滤出上清液,再加入等量的20% H2O2进行2 d的氧化,烘干后称重放于棕色瓶中待用,即为氧化生物炭(OBC)。供试生物炭性质见表1。
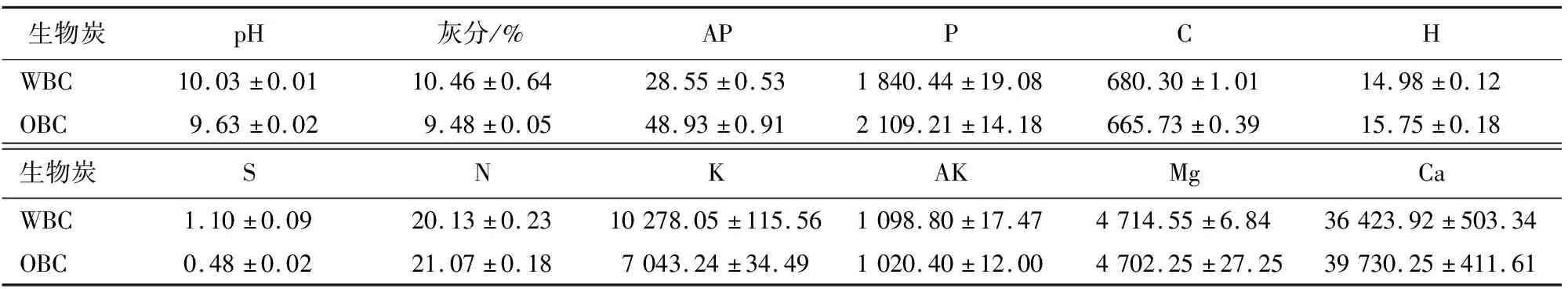
表1 供试生物炭的性质
1.2 土壤培养
试验共设置4组处理,具体为:1)原土(CK);2)原土加111.96 mg·kg-1P素(P素的用量参考赵牧秋等[12]的研究);3)原土加111.96 mg·kg-1P素和3% WBCP;4)原土加111.96 mg·kg-1P素和3% OBCP,施生物炭量参考胡华英等[13]的研究。每个处理组设3组重复。供试P肥为磷酸二氢钾,各处理的供试土壤重500 g,将样品置于25 ℃、黑暗的培养箱中进行培养,培养期间每隔2~3 d称重补水,使土壤水分保持在田间持水量的60%,待到150 d后获取新鲜土样并将其过2 mm筛,取一部分风干用于土壤理化性质的测定,另一部分新鲜土样用于土壤微生物的测定。
1.3 测定项目和方法
1.3.1 土壤理化性质的测定 称取过2 mm筛的风干土5.00 g,用原子吸收分光光度计测定有效钾(AK);称取过0.149 mm筛的风干土样200 mg,采用全自动微量分析仪(德国Elementar,Vario Macro Cubeelementar)进行土壤全碳(TC)和全氮(TN)含量的测定;称取5 g过2 mm筛的土样,采用德国elementar TOC总有机碳(总氮)分析仪(liqui TOCⅡ)测定土壤溶解性有机碳(DOC)和溶解性有机氮(DON)含量;称取2份5 g过2 mm筛的土样用连续流动化学分析仪分别测定铵态氮(NH4+-N)、硝态氮(NO3--N)以及土壤有效磷(AP)含量[12];称取0.1 g过0.15 mm筛的风干土样,用氢氟酸-高氯酸将土样消解,电感耦合等离子体发射光谱仪(ICP-OES)测定全磷(TP);称取10 g过2 mm筛的风干土样,加入25 mL不含CO2的去离子水,经震荡、静置后直接用pH计测得上清液的pH[14]。
1.3.2 土壤微生物的测定 用Illumina Miseq PE300高通量测序平台来测12个样品中的细菌与真菌序列,具体测试由北京奥维森科技有限公司完成。测定的基本流程为:对土样进行DNA提取后,使用特异性引物扩增细菌16S rDNA基因的V3-V4区以及真菌ITS1基因的ITS1-ITS2区。对细菌和真菌目标区域进行扩增使用的引物序列分别为ACTCCTACGGGAGGCAGCAG;GGACTACHV-GGGTWTCTAAT和CTTGGTCATTTAGAGG-AAGTAA;TGCGTTCTTCATCGATGC。完成PCR扩增获取扩增产物后对同一样本的产物进行混合,最后利用2%的琼脂糖凝胶电泳对混合后的产物进行检测,即可获取土样中微生物的原始序列。
1.4 数据处理
通过Illumina MiSeq平台进行Paired-end测序,测序完成后首先进行质量控制即滤掉打分小于20、碱基模糊、引物错配或测序长度小于150 bp的序列,根据barcodes归类各处理组序列信息聚类为用于物种分类的OTU(operational taxonomic units),用uparse[15](usearch v10.0.420)按照97%相似性序列进行OTU聚类,对比silva数据库,得到每个OTU对应的物种分类信息。基于OTU的丰度结果,使用Qiime软件得到样品的Shannon指数等[16],样本间群落组成差异采用主成分分析(PCA)。使用SPSS 19.0对土壤养分和主要优势微生物进行单因素方差分析,采用Duncan法分析不同处理间的显著性(P<0.05),采用Origin 8.5对试验数据进行绘图,图表中数据均为平均值±标准误差,环境因子对细菌群落结构的影响采用冗余分析(RDA)。
2 结果与分析
2.1 P肥与生物炭配施对土壤微生物群落构成影响
将测序所得的有效序列按97%的相似度进行OTU的划分后整理绘制的韦恩图(图1)。在4组处理中检测到的细菌总OTU数为2 773,其中CK处理1 832个、P处理1 794个、WBCP处理2 122个、OBCP处理2 169个,单施P肥会减少土壤细菌物种数目,而在P肥的施用下生物炭氧化前后均能促进土壤细菌物种数的增加,且氧化后的生物炭的促进作用更强。真菌OTU数共为1 856个,其中,CK处理921个、P处理1 256个、WBCP处理1 179个、OBCP处理1 159个,添加生物炭与P肥混合物能适当丰富土壤真菌物种数,只添加P肥的土壤中真菌物种数最多,表明施加P肥对土壤真菌物种数有明显的促进作用,但生物炭会抑制P对土壤真菌物种数的增加。
生物炭与P的施用对土壤微生物的影响通过Shannon-Wiener曲线可以表示(图2),Shannon值越大,说明群落多样性越高。WBCP与OBCP处理细菌Shannon值显著高于P与CK处理组,添加生物炭与P的混合物能显著提高群落中细菌多样性,提升程度相似,单施加P肥对细菌多样性无影响。CK、P、WBCP和OBCP处理真菌Shannon值差别不大,说明是否施加生物炭和P肥对真菌多样性无显著影响。
为了能够了解不同处理下微生物群落结构的差异,分别对细菌和真菌的群落结构进行PCA分析[17](图3)。不同处理组间微生物群落结构的差异以组间距离的远近来呈现,其中,距离越远表明群落结构差异越大,反之越小。由图3A可以看出,P处理与CK处理的土壤细菌群落结构的差异较小,不同生物炭处理下的土壤细菌群落结构与CK和P处理差异较大,同时OBCP和WBCP处理组间的土壤细菌结构也具有差异。图3B也反映出不同处理组间的土壤真菌群落结构均存在差异。其中,与CK处理相比,P处理、生物炭处理组中土壤的真菌群落结构发生了较大的变化,但其中OBCP处理的真菌群落结构与WBCP处理相比差异较小。
2.2 P肥与生物炭配施对土壤微生物相对丰度的影响
共检测到28个门分类水平和222个属分类水平下的细菌类群,而真菌门和属分类水平下的类群数共检测到18和387个。选取门和属分类水平下相对丰度前6的微生物类群,分析不同处理对其相对丰度的影响,并对其中差异性显著的微生物进行进一步比较(图4、图5)。试验结论证明,优势细菌门为变形菌门(Proteobacteria)(30.18%~38.85%)、酸杆菌门(Acidobacteria)(13.55%~20.81%)、绿弯菌门(Chloroflexi)(8.20%~19.18%)、放线菌门(Actinobacteria)(7.22%~14.77%)以及厚壁菌门(Firmicutes)(5.44%~10.98%)。从图4A、图4B、图4C中可以发现,与P处理组相比,WBCP和OBCP处理组中的绿弯菌门(8.20%)和放线菌门(7.22%)以及厚壁菌门(5.44%)的相对丰度均显著下降。主要优势的细菌属有嗜酸栖热菌属(Acidothermus)(1.33%~10.03%)、芽孢杆菌属(Bacillus)(1.28%~2.92%),从图4D、图4E发现,与P处理组相比,WBCP和OBCP处理组均显著降低酸性嗜热菌属的相对丰度,显著提高了芽孢杆菌属的相对丰度;在不同生物炭的处理组间,WBCP(1.33%)处理组对酸性嗜热菌属的相对丰度下降程度比OBCP(2.96%)处理组下降得更显著,下降了1.63%。而对芽孢杆菌属丰度的提高则是WBCP(2.92%)处理组更显著于OBCP(2.20%)处理组,提高了0.72%。
在真菌层次中,主要的优势真菌门为子囊菌门(Ascomycota)(49.27%~54.15%)、担子菌门(Basidiomycota)(21.58%~33.17%)和被孢霉门(Mortierellomycota)(5.06%~20.33%)。与P处理组相比,不同生物炭与磷混合物的添加培养对土壤中的被孢霉门、中壶菌门(Chytridiomycota)和担子菌门的相对丰度均无显著的影响,却显著影响了毛霉亚门(Mucoromycota)和类原生动物门(Rozellomycota)的相对丰度(图5)。在图5B、图5C中,与P处理组(1.09%)相比,不同生物炭与磷混合物处理组中均显著提升毛霉亚门相对丰度,其中WBCP处理组(1.69%)对毛霉亚门的相对丰度的提高显著高于OBCP处理组(1.12%);类原生动物门中,WBCP(1.34%)处理组含量高于P(0.87%)和OBCP(1.01%)处理组,但差异性不显著。
主要真菌属有Saitozyma(14.03%~22.37%)、被孢霉属(Mortierella)(5.04%~20.32%)、腐质霉属(Humicola)(3.54%~6.90%)、毛壳属(Chaetomium)3.02%~5.38%)和粪壳属(Sordaria)(2.46%~4.03%)。图5D、图5E、图5F中,与P处理组相比,WBCP(22.37%)处理组中Saitozyma相对丰度较P(21.07%)和OBCP(20.67%)处理组高;OBCP(3.02%)处理组中毛壳属相对丰度较P(3.89%)和WBCP(4.80%)处理组低,但三者间相比变化不显著;WBCP(3.21%)处理组和OBCP处理组中,粪壳属相对丰度均低于P(4.03%)处理组,其中OBCP(2.46%)处理组丰度降低得更显著。
2.3 P肥与生物炭配施对土壤养分的变化
不同处理下土壤主要养分含量状况如表2所示。与CK组相比,单施P肥能使土壤中的TP、AP和AK含量增加,降低NH4+-N的含量;与P处理组进行对比,在施加不同生物炭与P肥混合物土壤中TC、TN、TP和AK的含量均有显著的提高,AP和NO3--N的含量则相反,其具体表现为:WBCP和OBCP处理组中的TC、TN和TP含量显著高于P处理组,而WBCP与OBCP处理组之间差异并不显著,这说明在施加P肥的前提下,不同处理的生物炭对土壤总C、N、P含量并没有显著影响;WBCP处理和OBCP处理中AK含量显著高于P处理组,且OBPC处理组提高效果更加显著,这说明添加生物炭有提高了土壤中K的有效性,且生物炭氧化之后提升效果更明显;与P处理组相比,WBCP与OBCP处理组中的AP含量均显著降低,特别是在OBCP处理组中AP含量降低更加显著,这说明生物炭氧化后会对P有效性产生不利影响;与P处理相比,生物炭与P混合物会使得NO3--N含量显著降低,但生物炭是否氧化对其含量影响并不显著;不同的是在WBCP处理中NH4+-N的含量对比P处理是显著降低的,降低了13.05%,而在OBCP处理中NH4+-N的含量是显著提高的,提高了37.29%;而与P处理组相比不同的生物炭处理下DOC的含量没有显著的变化;试验测得CK、P、WBCP、OBCP 4组土壤的pH分别是3.49±0.01、3.91±0.03、5.98±0.01、6.00±0.03,因为生物炭本身呈碱性,加入土壤能显著提高土壤pH值;P处理组与CK处理组土壤pH值差异较小,表明外源P的添加对土壤pH值影响较小。
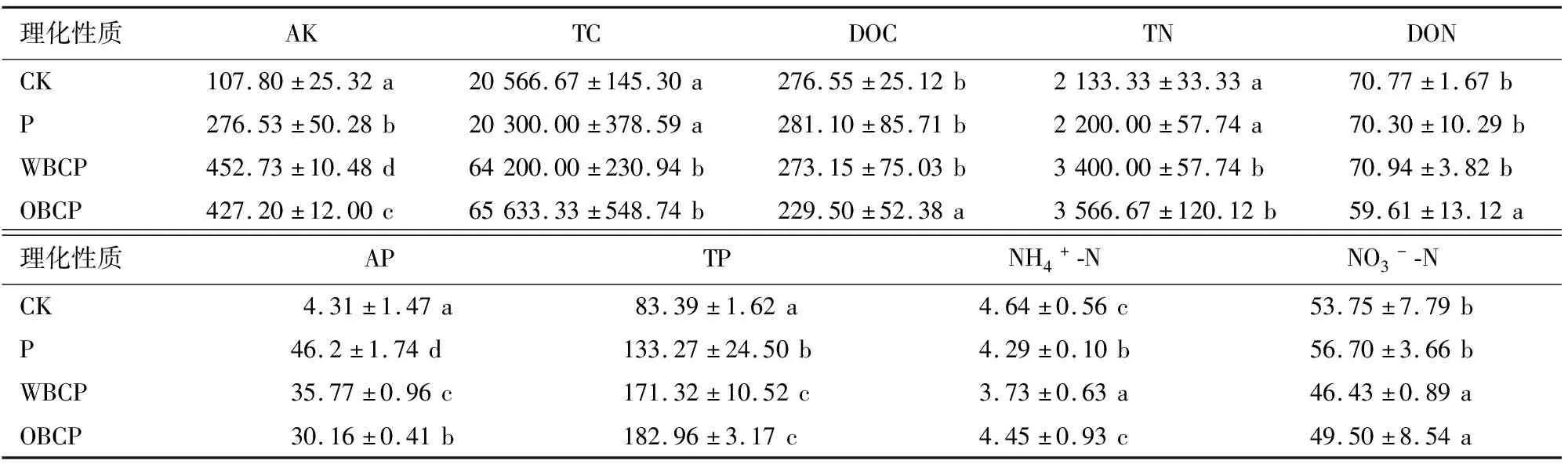
表2 土壤理化性质分析
2.4 土壤养分与微生物相对丰度的冗余分析
对土壤性质与土壤微生物优势门、属相对丰度进行RDA分析,红箭头代表土壤性质,蓝箭头代表各土壤微生物,箭头越长代表影响越显著。由图6A可以看出,酸杆菌门相对丰度与TN、TC呈现显著的正相关性而与DOC呈显著负相关,浮霉菌门(Planctomycetes)则与此相反。同时,绿弯菌门、放线菌门和厚壁菌门的相对丰度也NO3--N呈正相关性而与TN、TC和TP呈显著负相关。变形菌门与TC、AK和TN呈显著正相关,与NO3--N呈现出极显著负相关的关系。从图6B可以看出,嗜酸栖热菌属(Acidothermus)相对丰度与NO3--N呈现显著的正相关性,而与TC和TN呈显著负相关。芽孢杆菌属(Bacillus)与TP、AK、TC和TN呈现显著的正相关性,与NO3--N呈显著负相关关系。Variibacter、Candidatus_Koribacter和慢生根瘤菌属(Bradyrhizobium)与NO3--N、NH4+-N呈显著正相关。Candidatus_Koribacter与DOC和DON呈负相关关系。
从图6C可以看出,类原生动物门和担子菌门与AK、AP、TP呈现出显著的正相关性,中壶菌门与NO3--N呈显著正相关,而与TC、TC、TP和AK呈负相关关系,被孢霉门与NH4+-N呈极显著正相关与AP呈显著负相关,子囊菌门与DOC呈极显著正相关性。从图6D可以看出,被孢霉属(Mortierella)和木霉属(Trichodrerma)与NH4+-N呈极显著正相关,与AP呈负相关。Saitozyma与AP、AK和TP呈现正相关性,与NO3--N呈显著负相关关系。腐质霉属(Humicola)、Chaetomium与NO3--N呈极显著正相关,与TN、TC呈显著负相关,粪壳属(Sordaria)与DOC呈显著正相关。
3 结论与讨论
3.1 结论
本研究表明,施加P肥的条件下,在二代杉木人工林土壤中添加生物炭能够有效改善土壤养分,但生物炭氧化后会降低土壤溶解性有机C、速效K和速效P的含量,减弱了对土壤养分的改善效果。生物炭施加后促进土壤细菌物种数目与多样性,抑制真菌物种数目,其中氧化后的生物炭对土壤细菌物种数的促进效果最为明显。门和属水平下主要微生物类群的相对丰度因其不同的适宜生存环境与土壤主要养分含量呈现显著的正、负相关性,因此氧化前后的生物炭也会通过影响土壤养分来间接影响土壤微生物的结构组成,因此在人工林管理中,应考虑生物炭氧化后对土壤理化性质和土壤微生物的影响并做出合理的应对措施。本试验是基于实验室模拟进行的土壤培养,缺乏对杉木植株的培养情况与对生物炭在杉木林土壤中的长期使用效果的了解,因此需再进一步进行野外培养研究。
3.2 讨论
近年来随着可再生资源的不断减少,生物炭对土壤微生物影响的变化规律成为热门话题。与单独施加P肥的处理组相比,添加生物炭改变了土壤细菌相对丰度,提高了土壤微生物群落的多样性[18];这一结果与V.Imparato等[19]的报道相似,他们发现添加生物炭能在一定程度上改变土壤细菌丰度,一方面是由于生物炭多孔隙且比表面积较大,添加生物炭可直接为细菌群体提供合适的栖息环境[20],有提高土壤细菌丰度的可能性;另一方面是由于生物炭富含养分可以通过改善土质量和大量元素的有效性间接对细菌的丰度发挥作用[21],从而引起土壤细菌的丰度变化。而生物炭与P肥混合物处理未能促进真菌的生长,表现抑制真菌生长的现象,与韩光明[18]和姚钦[22]的结论类似,在酸性土壤中真菌数量较多,在中性或碱性土壤中细菌和放线菌数量较多,而生物炭的添加会造成土壤酸碱度朝着适宜细菌生存的方向发展,使得真菌较细菌更难在添加生物炭培养的土壤中生存[23]。
对不同分类水平下的微生物类群而言,与P处理组相比,氧化前后的生物炭不会改变主要微生物类群的优势度。土壤中的优势细菌门主要为变形菌门、酸杆菌门、绿弯菌门、放线菌门以及厚壁菌门,这与李金融等[24]对土壤细菌多样性的研究结果一致,由于其对环境具有较强的适应性,因此在氧化前后生物炭培养的土壤中与其他细菌群落相比具有较高的活性。而本研究发现氧化前后生物炭的处理对芽孢杆菌属的相对丰度有促进作用,与王晶等[25]的研究结果存在差异,这可能是生物炭制备原料、施用量、土壤性质不同造成的。施加生物炭对嗜酸栖热菌属丰度有抑制作用,可能是由于生物炭成碱性,在土壤中施加生物炭可以显著提高土壤的pH,而嗜酸栖热菌属在酸性环境中适宜生活,因此添加生物炭会降低嗜酸栖热菌属的相对丰度。对真菌的研究发现,子囊菌门和担子菌门是主要优势真菌门,这与L.C.Paungfoo等[26]对土壤真菌的研究结果是一致的,且子囊菌门的相对丰度要优于担子菌门。氧化前后的生物炭均能提高毛霉亚门的相对丰度,且生物炭氧化前对毛霉亚门相对丰度含量的提高高于氧化后,可能是由于短期施加生物炭促进土壤微生物的丰度增加主要是微生物吸收利用生物炭中可溶性炭直接引起的,而氧化前生物炭含中可溶性碳含量较氧化后含量高[27]。
由于生物炭富含矿质养分且其特殊的表面结构与吸附能力,因此生物炭的添加能够有效改变土壤养分含量[28],对土壤养分以及肥力有一定的固定保持作用[29-30]。而P是植物生长发育的必不可少的大量营养元素,参与组成植物体内许多的重要化合物。本研究发现,与单施P肥相比,生物炭的添加能够显著提高土壤TC、TN、TP和AK的含量,这与先前的研究报道结果一致,如A.B.Syuhada等[31]的研究指出生物炭的添加能够显著提高红壤中AK的含量,这主要由于生物炭的存在可以有效减少土壤中K元素的淋溶,Gao等[32]的研究也发现,土壤的pH值、TC、TN等含量因为生物炭的添加而显著提升,这是由于生物炭的添加能够有效抑制土壤有机碳的矿化,并且生物炭经氧化后,被其表面吸附的有机碳等有机质会因生物炭表面结构的破坏而释放到土壤中造成的[33]。OBCP处理组中土壤的DOC、AK含量显著低于WBCP处理组,林庆毅[7]也发现了生物炭的添加能显著增加红壤AK和DOC的含量,但生物炭氧化后,对土壤速效养分增加的趋势减弱。与之相反的是与P处理组相比,在施用生物炭后AP显著降低,其主要是由于生物炭自身独特的理化性质以及环境条件影响对P具有不同的吸附作用[34],但仍然远高于CK处理组,因为生物炭输入后不仅能自身提供P素,而且有利于提高P素的有效性[35],而OBCP处理却显著低于WBCP处理组中土壤的AP含量,这说明生物炭氧化后会对P有效性产生不利影响,可能是生物炭表面含氧官能团增多,其他官能团减少,酸性增强[36]导致pH下降引起的,顾永明等[37]和蒋柏藩[38]指出土壤的理化性质会影响土壤磷的形态、有效性以及供应能力,土壤的pH以及盐基离子是影响P素活性的重要因子,文星等[39]发现在酸性土壤中,P的固定发生较为严重,影响了土壤供P能力。
由于土壤基本养分含量与门水平下主要微生物类群具有密切的相关性,因此可以认为氧化前后生物炭的添加对微生物群落的影响主要是通过土壤理化性质的改变间接引起的[40],土壤养分促进了土壤微生物的繁殖,同时这些微生物能够起到活化土壤磷素和钾素的作用[41],而I.A.Dickie等[42]的研究表明,土壤中C、N、P等元素可以制约微生物活性。通过对土壤养分与门水平下细菌相对丰度的冗余分析发现,绿弯菌门、放线菌门、厚壁菌门与TN、TC和TP呈显著负相关关系,这与李金融等[24]研究指出的放线菌门、厚壁菌门均具有生存优势,对贫养环境具有极强的适应能力是一致的。在土壤养分与门水平下真菌相对丰度的冗余分析中,S.Fontaine等[43]的研究表明,子囊菌的生长与氮的有效性有关,并且子囊菌活性的增加也会反过来促进对碳的分解,这与本研究发现的子囊菌门与DOC呈显著正相关是一致的。通过对土壤养分与属水平下细菌相对丰度的冗余分析发现,嗜酸栖热菌属(Acidothermus)相对丰度与NO3--N呈现显著的正相关性而与TC和TN呈显著负相关,随着生物炭的施加,NO3--N减少TC增加,导致其丰度降低。而芽孢杆菌属其正好相反,由于生物炭对TP、AK、TC和TN有促进作用,所以促进芽孢杆菌属的丰度的增加。此外,毛霉亚门与AP具有正相关性,表明增加AP的含量对毛霉亚门具有促进作用。由于WBCP处理组中的AP含量高于OBCP处理组,由此导致了WBCP处理中毛霉亚门的相对丰度高于OBCP处理组。

