多房棘球蚴囊液对小鼠肝细胞凋亡与自噬影响的研究
徐 凯,尹凤娇,张耀刚,吴传玲,李文登,任 利,樊海宁,王海久,王志鑫青海大学附属医院 肝胆胰外科,青海西宁 8000; 青海省包虫病研究重点实验室,青海西宁8000; 浙江工业职业技术学院鉴湖学院 基础医学教研室,浙江绍兴 000
多房棘球蚴病是一种流行于北半球的人兽共患寄生虫病,其发病与多种因素有关,好发于畜牧业发达地区[1]。我国新疆维吾尔自治区西北地区、青藏高原东部地区、宁夏南部、甘肃中南部等为此疾病重灾区[2]。原发多房棘球蚴病灶几乎都在肝部(约99%)[3]。多房棘球蚴在中间宿主肝内主要为浸润式增殖,并产生大小不一的囊泡,囊液(hydatid cyst fluid,HCF)通过不完整且很薄的囊壁外角皮层持续渗漏,不断与肝组织接触,引起局部肝纤维化和组织坏死,晚期可出现远期继发性转移病灶,故有“虫癌”之称,临床预后极差[4-6]。国外学者采用分离的淋巴细胞进行体外细胞实验,发现加入细粒棘球蚴囊液后,细胞内FasL增高,Bax/Bcl-2表达比例增高,Caspase-3激活[7-8]。Mejri等[9]发现细粒棘球蚴囊液可抑制巨噬细胞增殖,并诱导其发生凋亡。Zhang等[10]研究发现感染多房棘球蚴的小鼠随着感染时间的延长,p53、p21和Gadd45γ基因表达及Caspase-3活性呈时间依赖性升高,晚期可出现JNK和Caspase-3激活,同时采用Tunel实验技术发现肝细胞凋亡比例也显著升高,但并未对体外细胞功能进行探讨。本研究通过观察体外多房棘球蚴囊液作用于小鼠肝细胞后对其DDIT4、增殖、自噬和凋亡的影响,并就DDIT4对AML-12细胞增殖、自噬及凋亡相关蛋白表达的影响进行初步探究。
材料与方法
1 实验细胞系 小鼠肝细胞株 (AML-12)购自中国科学院上海生命科学研究所,保存于青海大学附属医院中心实验室。
2 主要试剂和仪器 细胞培养基 DMEM/F12(武汉普诺赛生命科技有限公司);胎牛血清(依科赛生物科技有限公司);青霉素和链霉素10 000 U/mL、PBS(北京索莱宝科技有限公司);胰岛素-转铁蛋白-亚硒酸(美国Gibco公司);CCK8试剂盒、Annexin V-FITC/PI荧光双染细胞凋亡试剂盒(武汉伊莱瑞特生物科技股份有限公司);BCA蛋白浓度测定试剂盒 (美国 ThermoFisher scientific公司);β-actin抗体、辣根过氧化物酶标记的山羊抗兔IgG二抗(武汉爱博泰克生物科技有限公司);DDIT4、Beclin-1抗 体(美 国Abcam 公 司);Caspase-3、PCNA、LC3A/B 抗体 (美国 Cell Signaling Technology公司);荧光化学发光成像系统(美国GE公司,型号:GE Amersham Imager600);酶标仪 (德国Tecan公司,型号:M200);电泳仪(BIO RAD公司,型号:基础型);透射电子显微镜(日本Hitachi公司,型号:HT7700);NovoCyte流式细胞仪(美国ACEA公司,型号:NovoCyte 3110);细胞成像微孔板检测系统(美国BioTek公司,型号:Cytation 5);生物倒置显微镜系统(日本OLYMPUS公司,型号:DP27)。
3 囊液收集与处理 处死感染多房棘球蚴 3 个月以上实验用BALB/c小鼠,在无菌条件下打开腹腔,将腹腔多房棘球蚴病灶内的囊泡小心分离,用无菌PBS反复冲洗囊泡表面5次。将无坏死的囊泡转移至20 mL无菌注射器内,通过挤压将囊液分离出。囊液以 3 000 r/min 离心 30 min,用0.22 µm滤器过滤除菌后分装,并冻干-80℃备用。BCA蛋白定量法确定囊液蛋白浓度。
4 AML-12 细胞培养 将复苏后的 AML-12 细胞置于10% FBS的DMEM/F12完全培养基中,于37℃、5% CO2饱和湿度下的培养箱中常规培养。观察其培养液的颜色变化与细胞生长情况,长至对数生长期时用于实验。
5 CCK8 法检测细胞活性 (浓度选择) 将 AML-12细胞(1×104/孔)接种于96孔板内,用完全培养基培养24 h。弃去血清培养基,每孔加入100 µL含HCF与1% FBS的培养基按倍比稀释并制备终蛋白浓度为 6.4 mg/mL、3.2 mg/mL、1.6 mg/mL、0.8 mg/mL、0.4 mg/mL、0.2 mg/mL、0.1 mg/mL、0 mg/mL(对照组)的培养液,分别处理 24 h、48 h、72 h 后各孔加入 10 µL CCK8 试剂,孵育 2 h,每组4个复孔,实验重复3次。使用酶标仪测定450 nm处的OD值。计算细胞增殖抑制率,抑制率(%)=[(对照孔OD-实验孔OD)/(对照孔OD-空白孔 OD]×100%。
6 HCF 对 AML-12 细胞形态的影响 生长至对数期的AML-12细胞(3×105/孔)接种于6孔板中,用完全培养基培养24 h后弃去血清培养基,更换1%血清培养基,内含蛋白浓度0 mg/mL(对照组)、0.4 mg/mL、0.8 mg/mL HCF,分别与细胞共培养2 d后观察细胞形态。
7 流式细胞术检测细胞凋亡情况 分组与标记同“6 HCF 对 AML-12 细胞形态的影响”,用 0.25%胰酶(不含EDTA)消化并收集各组细胞,300 g下离心5 min,弃上清并用4℃预冷PBS洗涤细胞1次,离心并小心吸干PBS溶液,用500 µL的1×Binding Buffer悬浮细胞,细胞密度 1×105/mL,在细胞悬浮液中同时加入 5 µL Annexin V-FITC和 5 µL PI,混匀,室温避光孵育 15 min 后于 1 h内上流式细胞仪检测。
8 MDC 染 色 检 测 自 噬 情 况 取 生 长 对 数期AML-12细胞,以2×105/孔接种于6孔板中,分组与标记同“6 HCF 对 AML-12 细胞形态的影响”,弃培养液,1×Wash buffer清洗液洗涤2次,加入100µL MDC染色液覆盖皿底,37℃下避光染色30 min,1×Wash buffer清洗液洗涤 1 次,于荧光显微镜下拍照观察,其中激发滤光片波长355 nm,阻断滤光片波长512 nm,以细胞内出现点状染色为阳性表现。
9 Western blot法检测相关蛋白表达 取生长对数期AML-12细胞,以3×105个/孔接种于6孔板中,分组与标记同“6 HCF对AML-12细胞形态的影响”,细胞用含有PMSF蛋白酶抑制剂的RIPA缓冲液冰上裂解 30 min,4℃ 下 12 000 r/min离心10 min后取上清液,再用5×蛋白上样缓冲液稀释并在95℃水浴中煮沸10 min,BCA蛋白定量试剂盒测定蛋白样品浓度。取30 µg总蛋白进行SDS-PAGE 电泳。结束后转移至 0.2 µm PVDF 膜上,用5%脱脂奶粉室温封闭1 h。将膜与DDIT4(1∶1 000)、Caspase-3(1∶1 500)、PCNA(1∶2 000)、Beclin-1(1∶1 500)、LC3A/B(1∶ 1 500)和 β-actin(1∶1 500)一抗在4℃下孵育过夜。室温孵育1∶5 000稀释的HRP 标记二抗 1 h。使用增强型ECL化学发光系统进行印记检测,β-actin作为内参。使用Image J软件对蛋白条带进行灰度分析。
10 透 射 电 镜 观 察 超 微 结 构 取 生 长 对 数期AML-12细胞,以1×106/孔接种于35 mm的培养皿中,分组与标记同“6 HCF对AML-12细胞形态的影响”,EP管中收获培养48 h的细胞,PBS洗涤2次;2.5%戊二醛固定过夜后用1%锇酸在避光室温条件下固定2 h,用不同浓度梯度(30%、50%、70%、80%、95%、100%)乙醇进行脱水,然后浸透包埋、聚合、超薄切片,拍照,电镜下观察细胞内超微结构。
11 统计学处理 采用 GraphPad Prism 9.0 统计软件进行统计与分析,结果以±s表示,多组间比较采用 Analysis of Variance(ANOVA)分析,两两比较用LSD检验。P<0.05为差异有统计学意义。
结 果
1 HCF 对 AML-12 细胞活力的影响 用不同浓度 HCF 对 AML-12 细胞干预 24 h、48 h、72 h,其细胞活力 (光密度)见表1。48 h 后 0.4 mg/mL、0.8 mg/mL HCF可明显降低细胞活性,因此本研究选用这两个浓度进行后续实验。

表1 CCK-8法检测HCF对AML-12细胞活力的影响Tab.1 Effect of HCF on the viability of AML-12 cells by CCK-8 method
2 HCF 对 AML-12 细胞的影响 48 h 后对照组细胞形态多呈椭圆形或圆形,细胞生长密度正常,而分别经过 0.4 mg/mL、0.8 mg/mL HCF 处理后,大部分细胞形态明显拉长,细胞呈梭形,相邻细胞间连接也变得疏松,细胞生长密度较对照组减小,细胞生长明显受到抑制。见图1。

图1 不同蛋白浓度HCF共培养48 h的AML-12细胞形态(100×)Fig.1 Morphology of AML-12 cells co-cultured with different protein concentrations in HCF for 48 h (100×)
3 流式细胞术检测细胞凋亡情况 48 h 后,与对照组比较,0.4 mg/mL、0.8 mg/mL HCF 均能促进AML-12细胞凋亡,差异有统计学意义(P<0.01) ,各组凋亡(Q2+Q3象限)情况和平均凋亡率见图2。
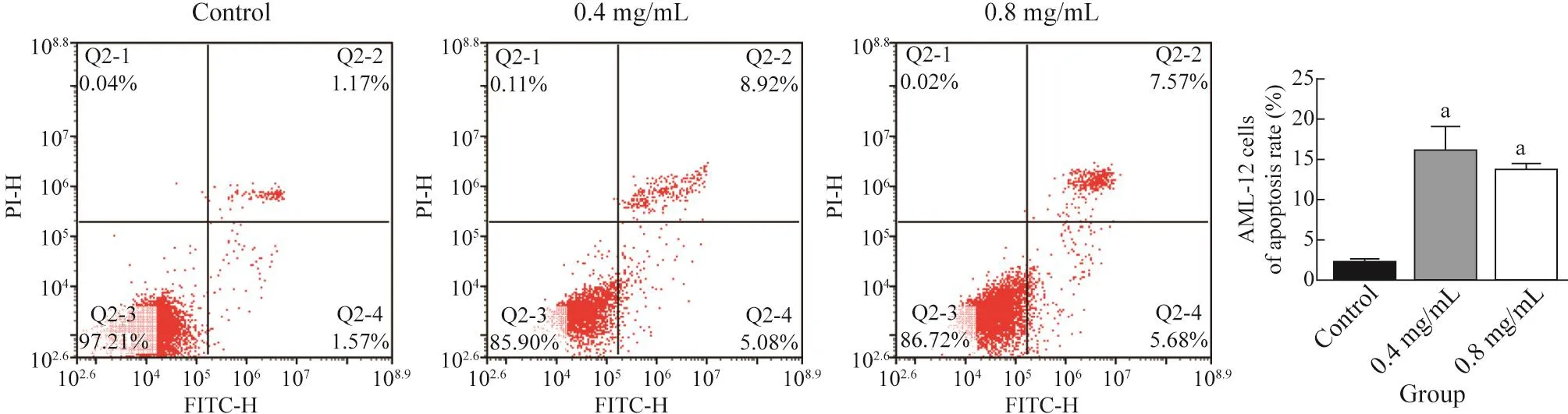
图2 流式细胞术检测AML-12细胞凋亡率(aP<0.01,vs 对照组)Fig.2 Apoptosis of AML-12 cells detected by flow cytometry (aP<0.01, vs control group)
4 MDC 染色检测自噬情况 MDC 染色后,于荧光显微镜下可见对照组细胞质被染成浅蓝色,且不明显;而加入 0.4 mg/mL、0.8 mg/mL HCF 可见大量高亮度类圆形团块,即自噬小体。与对照组相比,0.4 mg/mL、0.8 mg/mL HCF 组平均荧光强度明显升高(P<0.01)。见图3。

图3 HCF对AML-12细胞自噬水平的影响(MDC染色,200×;aP<0.01,vs 对照组;bP<0.01,vs 0.4 mg/mL)Fig.3 Effect of HCF on autophagy levels of AML-12 cells (MDC staining, 200×; aP<0.01, vs control group; bP<0.01, vs 0.4 mg/mL)
5 Western blot法检测凋亡、自噬关键蛋白的表达Western blot法检测结果显示,与对照组相比,0.4 mg/mL、0.8 mg/mL HCF 组 DDIT4、PCNA、Caspase-3、Beclin-1、LC3-Ⅱ蛋白表达显著升高(P<0.01);0.4 mg/mL HCF 组与 0.8 mg/mL HCF组LC3-Ⅱ、Beclin-1表达差异有统计学意义(P<0.05)。见图4。

图4 HCF对AML-12细胞相关蛋白水平的影响(aP<0.01, vs 对照组; bP<0.05, vs 0.4 mg/mL)Fig.4 Effect of HCF on AML-12 cell-related protein levels (aP<0.01, vs control group; bP<0.05, vs 0.4 mg/mL)
6 透射电镜观察细胞内超微结构 透射电镜观察到对照组细胞胞质未见明显肿胀,线粒体基质较均匀,嵴少量减少,自噬水平低;0.4 mg/mL组线粒体损伤程度较低,轻微肿胀,嵴少量断裂、减少,胞内可见较多自噬溶酶体;0.8 mg/mL组细胞线粒体损伤程度高,线粒体膜破损、基质外溢,嵴缺失,胞内可见较大面积自噬溶酶体。见图5。

图5 透射电镜观察各组AML-12细胞超微结构Fig.5 Ultrastructure of AML-12 cells in each group observed by TEM
讨 论
多房棘球蚴寄生于宿主肝是一个慢性过程。其囊液的持续刺激破坏了宿主肝细胞增殖与凋亡的动态平衡,使细胞周期出现紊乱,影响肝多房棘球蚴病的转归[2]。多房棘球蚴导致肝细胞凋亡及自噬的机制尚不明确。王俊华等[11]研究发现,在感染多房棘球蚴的小鼠模型和肝多房棘球蚴病患者肝病灶周围的肝细胞发生显著凋亡,Fas和Caspase家族蛋白表达明显增加,提示Fas和Caspase家族介导的细胞凋亡信号通路可能参与了多房棘球蚴所致肝损伤进程。我们课题组前期研究通过检测肝多房棘球蚴病患者病灶边缘带肝组织发现自噬和凋亡相关蛋白显著上调,且DDIT4表达显著增高,得出在肝多房棘球蚴病中凋亡和自噬可能缓慢协同并促进病灶浸润的结论[12]。
Caspase-3作为最关键的细胞凋亡执行者,在凋亡过程中起着重要作用。在细胞凋亡进程中,通过线粒体途径介导细胞色素C激活Caspase-9,进而激活Caspase-3,进展至不可逆性凋亡阶段[13-14]。细胞自噬又称Ⅱ型程序性细胞死亡,指细胞受刺激时利用溶酶体消化回收废弃的细胞成分和细胞器以实现自身代谢和能量的更新,但若自噬过度激活可促进细胞死亡,即自噬性细胞死亡,且常伴随细胞凋亡和坏死[15-16]。Beclin-1是编码调节自噬的蛋白质,在自噬中起核心作用,其表达水平可反映自噬的发生[17]。LC3是自噬小体膜上的标记蛋白,以LC3-Ⅰ和LC3-Ⅱ两种形式产生,在自噬过程中LC3-Ⅰ转化为LC3-Ⅱ并被招募为自噬小体,这是自噬小体形成的关键步骤[18]。介导微管与细胞骨架成分之间物理相互作用的DDIT4在人体正常组织广泛低表达,对多种细胞刺激均能产生应激反应,受多种细胞信号通路的调控,在细胞DNA损伤修复、调控细胞周期、自噬、凋亡等过程中发挥着重要的调节作用[19-20]。一些资料显示,高水平的DDIT4与急性髓系白血病、乳腺癌、多形性胶质母细胞瘤、结肠癌、皮肤癌、肺癌等的不良预后有关[21]。王宇飞等[22]研究发现DDIT4过表达可对HT22细胞发挥促凋亡作用。戈春城等[23]通过GSEA分析发现DDIT4可能与低氧反应、糖酵解、mTORC1信号通路、NF-κb介导的TNF-α信号通路、G2/M检查点、p53信号通路等生物学功能有关,提示DDIT4可能参与细胞自噬、应激反应和细胞凋亡的发生。感染多房棘球蚴的宿主长期受营养不良、氧气和生长因子等因素影响,导致肝细胞出现频繁的代谢应激,最终引起细胞内稳态破坏,出现预后不佳。
目前,关于DDIT4基因蛋白在棘球蚴病中的作用研究较少。本研究发现小鼠AML-12细胞经HCF作用后其细胞活性受到明显抑制,生长密度明显减小;流式细胞术检测其凋亡率较对照组明显升高;MDC荧光呈现大量高亮度类圆形自噬小体;Western blot检测示小鼠AML-12细胞经HCF作用后DDIT4呈高表达,促凋亡因子Caspase-3也呈高表达;自噬相关蛋白指标Beclin-1和LC3呈高表达;透射电镜下细胞超微结构可观察到 0.4 mg/mL HCF 组与 0.8 mg/mL HCF 组细胞损伤程度均明显增高,胞内细胞器空泡明显增多,自噬数量较多。提示感染多房棘球蚴后宿主肝细胞凋亡自噬可能与DDIT4蛋白密切相关。过表达DDIT4会抑制AML-12细胞增殖,促进其自噬并诱导凋亡。因此,在肝多房棘球蚴病中凋亡与自噬可能缓慢协调促进病情进展并导致预后不佳。
综上所述,HCF作用后的AML-12细胞DDIT4因子呈高表达,其高表达可能抑制AML-12细胞的增殖,并促进其凋亡和自噬。但相关机制及信号通路尚不清楚,与凋亡和自噬的调控基因的关系有待进一步研究。本研究为下一步DDIT4在HCF影响肝细胞转归过程中的具体作用机制研究提供了方向。

