西归粗多糖对缺氧小鼠抗氧化应激作用的研究
何舒婷,张雨源,黄 会,肖 婕,杨兴美
(1.大理大学药学院,云南大理 671000;2大理大学体育科学学院,云南大理 671003)
由于现代生活节奏的加快和生活方式的改变,处于亚健康状态的人群日益增加,从而导致各类应激性疾病的发生〔1〕。应激反应是指机体在接受应激原后,为了减缓应激原带来的压力,机体的神经、免疫、分泌系统表现出生理和心理症状的应答性反应,从而维持机体内环境稳定。缺氧是应激性疾病的一种重要应激原。中国地形复杂,海拔高低不等,空气中氧气的含量也会随之发生改变,人们因为学习、生活改变居住地时就可能出现缺氧而引起氧化应激。因此研究应激反应机制,寻觅预防及减缓应激性疾病的有效途径就显得尤为重要。
西归是伞形科凹乳芹属植物西藏凹乳芹Vicatia thibeticade Boiss的根,在云南大理作为中药当归的替代品,药食两用,又名独脚当归〔2〕。多项研究〔3-7〕发现西归具有广泛的药理活性。西归含有多糖、氨基酸及黄酮等物质〔2〕,其中西归粗多糖具有调节机体免疫功能、增强抗感染能力等作用〔8〕,且可改善力竭游泳后小鼠的氧化应激状态,具有显著抗疲劳作用〔4〕。本研究主要探讨小鼠在缺氧状态时,西归粗多糖能否有效延长小鼠的存活时间及提高小鼠的抗氧化应激能力,继而为下一步西归的研究奠定基础。
1 材料
1.1 动物SPF级昆明种小鼠128只,雌雄各半,体质量18~22 g,由昆明市艾尼莫实验动物养殖中心提供,合格证号:SCXK(滇)2016-0002。饲养3 d后进行实验。
1.2 主要试剂西归粗多糖自制;红景天苷购自南京春秋生物科技有限公司,批号:HJTG20171205;超氧化物歧化酶(SOD)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、丙二醛(MDA)测试盒、一氧化氮(NO)测试盒、乙酰胆碱酯酶(AChE)测试盒均购自南京建成生物工程研究所,批号:20181203,20181203,20181206,20181206,20180714;无水乙醇、冰醋酸均购自天津市福晨化学试剂厂,批号:20170327,20171027。
1.3 仪器 EL104型梅特勒电子天平(梅特勒-托利多仪器上海有限公司);TL-16R型台式高速冷冻离心机(上海市离心机机械研究所);EMP-168G半自动化分析仪(深圳市恩普电子技术有限公司);HH·E21·Cu600电热恒温水温箱(上海医疗器械七厂);RE-2000B型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-D型循环水真空泵(巩义市予华仪器有限责任公司)。
2 方法
2.1 西归粗多糖的制备 西归购于大理本地,由大理大学生药教研室杨月娥高级实验师鉴定。取干燥充分的西归1 kg,粉碎后按1∶10料液比用85%乙醇在室温下浸提3次,提取后的西归进行再干燥,充分干燥后按料液比1∶10加入蒸馏水,随后在85℃下加热提取3次,1 h/次,4 500 r/min离心20 min,取上清液,60℃减压浓缩至浸膏。将浸膏放入带刻度的锥形瓶中量取体积,随后与10倍体积的95%乙醇混合并搅拌均匀,室温下静置48 h,10 000 r/min离心10 min,沉淀用水溶解,浓缩,冷冻干燥后得西归粗多糖,用苯酚-硫酸法检测西归粗多糖的含量〔8〕。
2.2 小鼠缺氧环境的制备取一只250 mL的广口瓶,装入10 g钠石灰(成分:CaO 7.5 g,H2O 2.1 g,NaOH 0.3 g,KOH 0.1 g),瓶口取适量凡士林涂抹密封,并检查气密性。记录小鼠存活时间的标准是从密封瓶盖开始计时,直到小鼠死亡,即为缺氧存活时间〔9-10〕。
2.3 动物分组与给药动物实验分两批次进行:第一批次小鼠随机分成5组,每组10只,即:缺氧模型组、红景天苷组(360 mg/kg)、西归粗多糖低剂量组(100 mg/kg)、中剂量组(200 mg/kg)、高剂量组(400 mg/kg)。红景天苷组和西归粗多糖各剂量组灌胃相对应的药物7 d,1次/d,每次0.2 mL/10 g;缺氧模型组灌胃相应体积的0.9%氯化钠溶液。第二批次小鼠随机分成6组,每组13只(两批小鼠不是同时进行试验,故需从第二批小鼠中随机抽出3只,并测定这3只小鼠在缺氧环境下的存活时间,以此作为要给予小鼠缺氧时间的依据),分为正常组、缺氧模型组、红景天苷组(360 mg/kg)、西归粗多糖低剂量组(100 mg/kg)、中剂量组(200 mg/kg)、高剂量组(400 mg/kg)。红景天苷组和西归粗多糖各剂量组灌胃相对应的药物8 d(由于此次实验对象为另外一批小鼠,其在同样密闭缺氧环境下的存活时间可能会与第一批有所不同,为保证实验严谨性,在给药第7天时需要重新测定小鼠在缺氧环境下的存活时间,故需持续给药8 d),1次/d,每次0.2 mL/10 g,正常组和缺氧模型组灌胃相应体积的0.9%氯化钠溶液作为对照。在第7天给药30 min后,除正常组外,每组随机抽取3只重复第一批次的实验,记录其存活时间,确定缺氧时间为20min。
2.4 小鼠在缺氧环境下存活时间的测定第一批小鼠末次给药30 min后,将所有小鼠放入装有10 g钠石灰(成分同上)的250 mL广口瓶中(1只/瓶),瓶口取适量凡士林密封,记录小鼠的存活时间。
2.5 氧化应激指标的测定第二批小鼠第8天给药30 min后,将除正常组以外其他各组小鼠按照平行实验的方法放入装有10 g钠石灰(成分同上)的250 mL广口瓶中(1只/瓶),瓶口取适量凡士林涂抹,密封,给予20 min缺氧时间。20 min后,将小鼠从广口瓶中取出,所有小鼠眼窦静脉丛采血,血液4℃静置30 min,分离血清(4℃,3 000 r/min,10 min)后,根据试剂盒操作说明书,分别测定血清中SOD、GSH-Px、AChE活性,MDA及NO含量。同时处死小鼠并取出肝脏,用预冷的0.9%氯化钠溶液漂洗,取其相同部位约200 mg((200±5)mg),在4℃下加0.9%氯化钠溶液1.8 mL,用玻璃匀浆器研磨成组织匀浆〔11-14〕,按各试剂盒说明书测定SOD、GSH-Px、AChE活性及MDA含量。
2.6 统计学分析采用SPSS 17.0软件进行统计分析,计量资料均以(x±s)表示,采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 西归粗多糖含量的测定制得西归粗多糖(灰白色粉末状)320 g,提取率为32.00%。经苯酚-硫酸法测得该样品中多糖的含量为727.80 mg/g,纯度为72.78%。
3.2 西归粗多糖对小鼠缺氧环境中存活时间的影响红景天苷组和西归粗多糖各剂量组小鼠的存活时间均比缺氧模型组长(P<0.05),说明给药后可以延长小鼠在缺氧环境中的存活时间。西归粗多糖中剂量组小鼠存活时间与红景天苷组相近,而西归粗多糖高剂量组小鼠的存活时间远超过红景天苷组(P<0.01)。说明西归粗多糖可以延长小鼠在缺氧环境中的存活时间,且呈剂量依赖性。见表1。
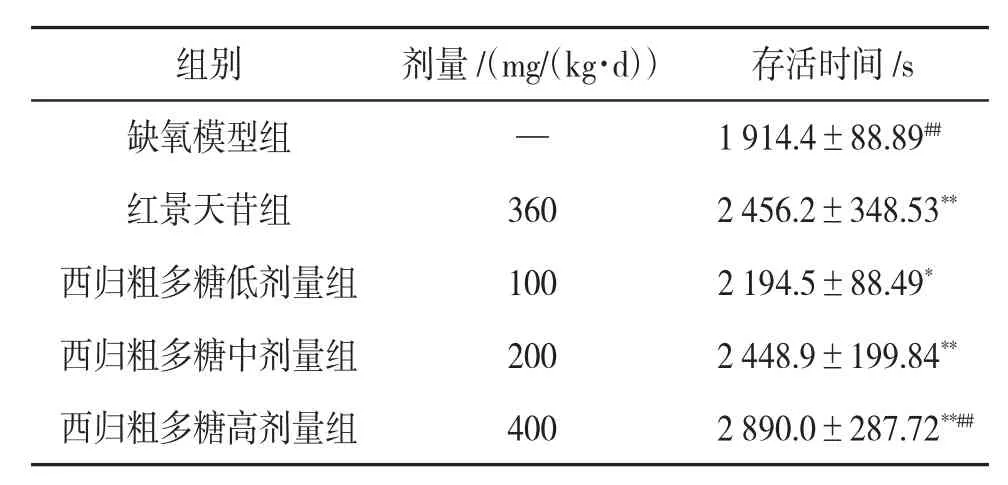
表1 西归粗多糖对小鼠缺氧环境中存活时间的影响(x±s,n=10)
3.3 西归粗多糖对小鼠血清中NO含量、AChE活性及MDA含量的影响与缺氧模型组相比,红景天苷组、西归粗多糖中、高剂量组小鼠血清中NO含量和AChE活性均下降(P<0.05);红景天苷组及西归粗多糖各剂量组小鼠血清中MDA含量均降低(P<0.01),且西归粗多糖各剂量组呈剂量依赖性降低。与红景天苷组相比,西归粗多糖各剂量组小鼠血清中NO含量有所升高(P<0.05);西归粗多糖中剂量组小鼠血清中AChE活性与红景天苷组相近,而西归粗多糖高剂量组小鼠血清中AChE活性比红景天苷组还低(P<0.05);西归粗多糖中、高剂量组小鼠血清中MDA含量比红景天苷组低(P<0.01)。结果表明西归粗多糖可有效减少小鼠血清中NO含量,降低AChE活性及MDA含量。见表2。
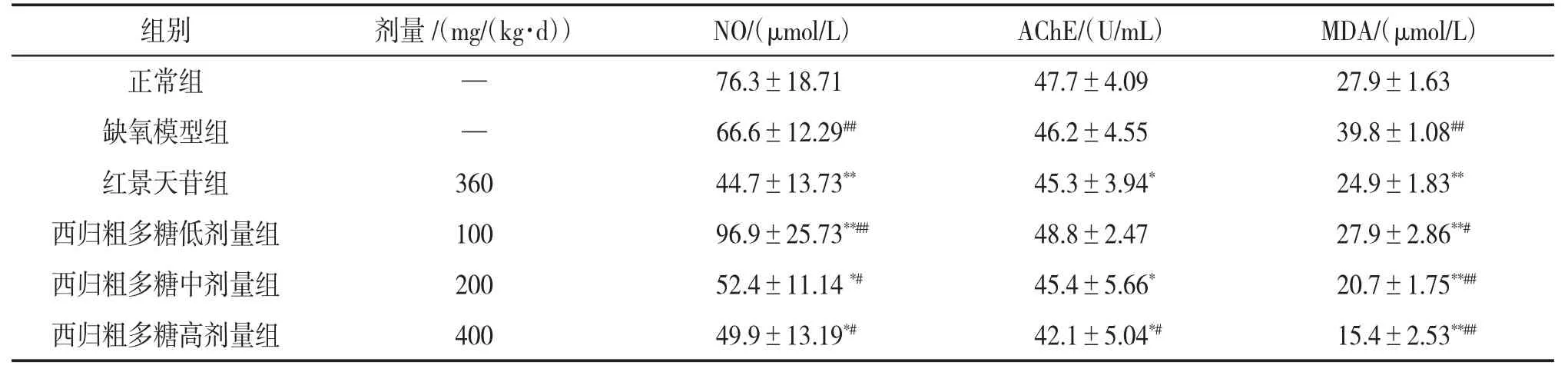
表2 西归粗多糖对小鼠血清中NO含量、AChE活性及MDA含量的影响(x±s,n=10)
3.4 西归粗多糖对小鼠血清中SOD和GSH-Px活性的影响与缺氧模型组相比,红景天苷组和西归粗多糖各剂量组均可提高小鼠血清中SOD活性,其中红景天苷组和西归粗多糖高剂量组作用明显(P<0.05);红景天苷组和西归粗多糖各剂量组均可有效提高小鼠血清中GSH-Px活性(P<0.05),且西归粗多糖各剂量组呈剂量依赖性增加。与红景天苷组相比,西归粗多糖高剂量组的SOD活性更高(P<0.05);西归粗多糖各剂量组的GSH-Px活性都比红景天苷组高(P<0.05),尤其是西归粗多糖中、高剂量组的GSH-Px活性远远高于红景天苷组。说明西归粗多糖可以提高小鼠血清中SOD和GSH-Px活性。见表3。
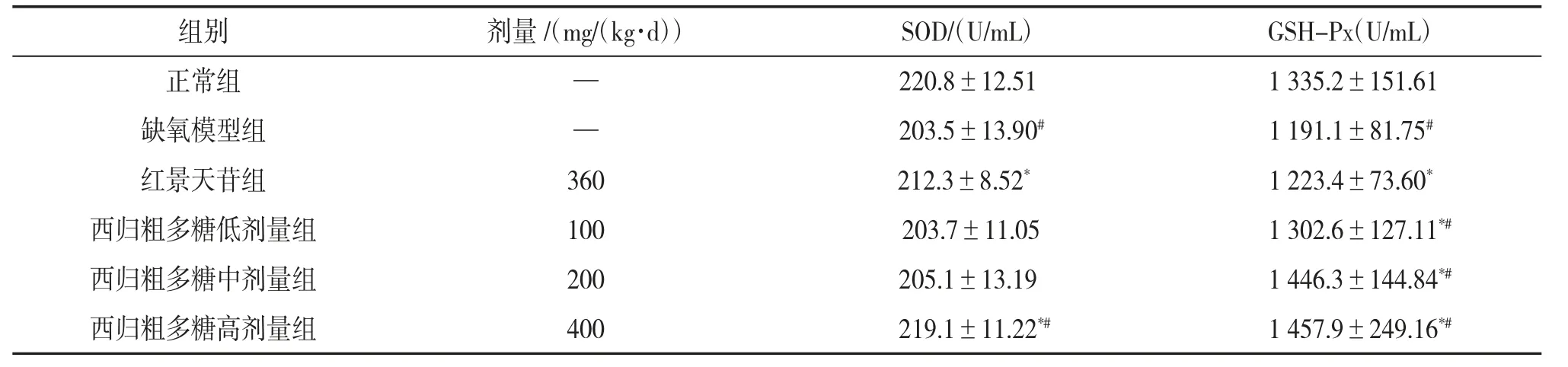
表3 西归粗多糖对小鼠血清中SOD和GSH-Px活性的影响(x±s,n=10)
3.5 西归粗多糖对小鼠肝脏组织中AChE活性及MDA含量的影响与缺氧模型组相比,西归粗多糖中剂量组小鼠肝脏组织中AChE活性降低(P<0.05);红景天苷组、西归粗多糖中、高剂量组小鼠肝脏组织中MDA含量均有所下降,且西归粗多糖高剂量组与缺氧模型组小鼠肝脏组织中MDA含量差异有统计学意义(P<0.01)。与红景天苷组相比,西归粗多糖高剂量组小鼠肝脏组织中MDA含量明显减少(P<0.05)。提示西归多糖可以降低小鼠肝脏组织中AChE活性,减少MDA含量。见表4。
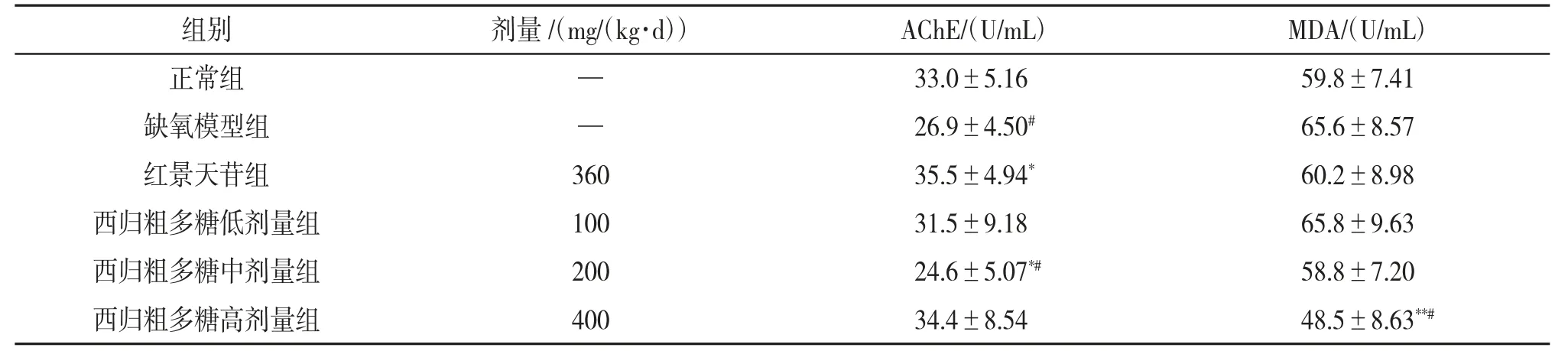
表4 西归粗多糖对小鼠肝脏组织中AChE活性及MDA含量的影响(x±s,n=10)
3.6 西归粗多糖对小鼠肝脏组织中SOD和GSHPx活性的影响与缺氧模型组相比,红景天苷组和西归粗多糖各剂量组小鼠肝脏组织中SOD活性增加,且西归粗多糖中、高剂量组与缺氧模型组小鼠肝脏组织中SOD活性差异有统计学意义(P<0.05);红景天苷组及西归粗多糖中、高剂量组小鼠肝脏组织中GSH-Px活性均增加,且西归粗多糖高剂量组与缺氧模型组小鼠肝脏组织中GSH-Px活性差异有统计学意义(P<0.01)。与红景天苷组相比,西归粗多糖中剂量组小鼠肝脏组织中SOD活性与之相近,西归粗多糖高剂量组小鼠肝脏组织中SOD活性增加更明显(P<0.05);西归粗多糖高剂量组小鼠肝脏组织中GSH-Px活性比红景天苷组更高(P<0.01)。说明西归粗多糖不仅有效提高小鼠肝脏组织中SOD活性,同时也能提高小鼠肝脏组织中的GSH-Px活性。见表5。
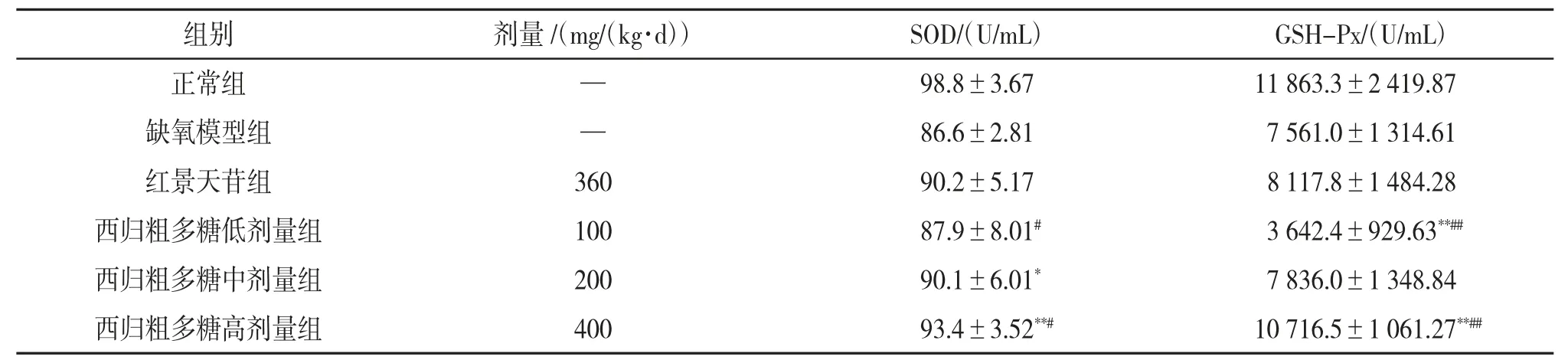
表5 西归粗多糖对小鼠肝脏组织中SOD和GSH-Px活性的影响(x±s,n=10)
4 讨论
缺氧是一种病理过程,即组织的氧气供给不足或利用阻碍都会导致组织的代谢、功能以及形态结构发生异样变化〔15〕。通过测定小鼠在缺氧环境中的存活时间可以确定小鼠对缺氧的耐受力,小鼠的存活时间与小鼠的抗缺氧能力呈正相关,小鼠存活时间长说明具有良好的抗氧化应激能力〔16〕。本研究显示,西归粗多糖各剂量组均能延长小鼠在缺氧环境下的存活时间,并且西归粗多糖高剂量组小鼠存活时间更是远超过红景天苷组,提示西归粗多糖可能具有抗缺氧作用。推测这种作用可能是小鼠在缺氧环境下对氧的利用能力被提高,用以弥补氧气供给不足或利用阻碍带来的缺陷,减缓了小鼠因缺氧而引起组织机能损伤状况的速度,提高小鼠的抗缺氧能力,进而延长小鼠在缺氧状态下的存活时间。为验证这个猜测,我们设计了接下来的一系列氧化应激指标的测定试验。
SOD可以将生物体内活性氧自由基转换为氧气和过氧化物,检测SOD的含量可以反映机体活性氧自由基的清除率〔17〕。GSH-Px是体内重要的抗氧化酶,它可阻断活性氧自由基对机体的进一步损伤〔18〕。机体缺氧会产生大量的氧自由基,从而消耗SOD及GSH-Px并抑制其活性,故发生脂质过氧化后产生大量的MDA〔14〕。因此,MDA也常常作为反映氧化损伤程度的标志物〔19-21〕,大量的MDA会破坏生物膜的完整性,加剧膜损伤。本研究表明,在缺氧状态下,用西归粗多糖预防给药后,小鼠肝脏和血清中SOD活性和GSH-Px活性均升高,而MDA的含量降低,表明西归粗多糖可有效治疗因氧化应激而引起的损伤。
研究表明,在正常情况下,NO对于神经的作用具有两面性,既可起到保护作用,又可毒害神经〔22〕。在NO高浓度下,二氧化氮自由基、羟自由基会大量产生,从而使蛋白质、核酸、细胞膜遭到破坏,线粒体损伤加剧,进而诱导细胞走向凋亡〔23〕。故此,降低NO的浓度,可明显增加抗氧化能力,从而减少氧化应激引起的损伤。本研究表明,西归粗多糖高剂量组可以有效降低小鼠血清中NO的含量,这与多项研究结果一致〔24-26〕。而低剂量组的NO含量比缺氧模型组高,这可能是小鼠缺氧时,NO含量还受到其他代偿调节作用,进而影响小鼠血清中NO的含量。
AChE是乙酰胆碱的一种水解酶。肝脏生成胆碱酶后分泌入血,所以肝受损害的程度可由胆碱酶的表达量来反映。本研究数据显示,西归粗多糖对小鼠缺氧状态下肝细胞和血清中AChE的活性有一定影响,主要是缓解小鼠在缺氧时组织细胞的损伤程度,提高氧的利用能力。另外,课题组前期的研究表明西归粗多糖也可以通过调节免疫功能和免疫平衡,减轻肝脏损伤,对运动疲劳发挥积极的免疫调节作用〔27〕,这两条对肝脏调节路径之间的相互作用还需要深入研究。
综上所述,本研究表明西归粗多糖可以通过增强缺氧小鼠SOD及GSH-Px活性,降低小鼠的AChE活性,减少MDA及NO含量,减轻小鼠体内自由基的氧化损伤,从而对缺氧条件下的小鼠提供保护。总之,西归粗多糖具有抗缺氧作用,可能与其可减轻氧化损伤的作用有关。但本研究仅仅是初步探索了西归粗多糖3个剂量组与抗氧化作用的关系,因西归粗多糖分子质量大,结构复杂,提取纯度并没有达到100%,所以具体到抗氧化作用的发挥是与西归粗多糖的哪些结构部位有关及作用于哪些生物信号等都需要进一步研究。
——题《圣山系-金巅》

