化学反应中物质过量问题的分析
张 瑞
(安徽省界首第一中学 236500)
物质过量问题是高中化学的一种常见问题.因不同物质过量可能会引发不同的化学反应,导致一些学生在分析的过程中出错率较高.为提高学生的分析能力以及解答该类问题的正确率,教学中应做好物质过量问题的分析教学,使学生掌握相关的分析思路与分析技巧,能够在解题中以不变应万变.
1 物质过量现象的判断
部分反应中某一物质的过量引发一连贯的反应,对应不同的反应现象.为使学生更好地判断物质过程的反应现象,应要求学生做好化学反应现象的总结,尤其应明确其中的原理,准确把握背后发生的化学反应.
例1下列操作中,不出现“先产生沉淀,而后沉淀溶解”现象的是____.
(1)将过量CO2通入到饱和碳酸钠溶液中.
(2)向Fe(OH)3胶体中逐滴加入过量的稀HCl.
(3)将过量CO2通入NaAlO2溶液中.
(4)向澄清石灰水中缓慢通入过量的CO2.
解析(1)碳酸钠和过量CO2反应生成碳酸氢钠,因碳酸氢钠的溶解度小于碳酸钠,因此会出现碳酸氢钠沉淀,但并不溶解.
(2)Fe(OH)3胶体会发生聚沉现象出现沉淀,当加入过量的稀HCl时发生反应生成氯化铁,沉淀溶解.
(3)NaAlO2和过量CO2反应生成Al(OH)3沉淀,但沉淀并不溶解.
(4)中先后生成CaCO3沉淀,而后生成可溶的Ca(HCO3)2,沉淀溶解.
综上符合题的有①③.
2 物质过量离子种类的分析
一些物质过量会导致一些原本不发生反应的离子发生反应.分析该类问题需要掌握物质过量对原有离子造成的影响,思考生成哪些新的物质、这些生成的物质是否与原有离子发生反应、发生怎样的反应等,从而做出准确的判断.
例2下列各组离子的溶液中,通入(加入)过量某物质后,仍能大量共存的是( ).
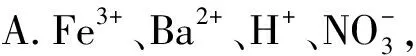
B.H+、K+、Cl-、Ca2+,通入CO2气体
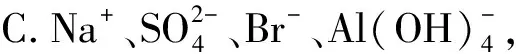
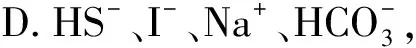
解析A项发生氧化还原反应:
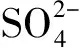
无法大量共存.D项因发生反应

离子无法大量共存.综上只有B项正确.
3 物质过量相关参数的计算
计算物质过量相关的参数时需要明确在不同阶段发生的化学反应、生成的具体物质,又要能够根据发生的化学反应现象找到相关参数之间的关系.
例3将置于空气中的NaOH固体样品溶于水中,而后向其中逐滴加入HCl至过量,生成标准状况下的CO2体积和加入HCl的体积关系如图1所示(忽略溶于水中的CO2),则以下判断错误的是( ).
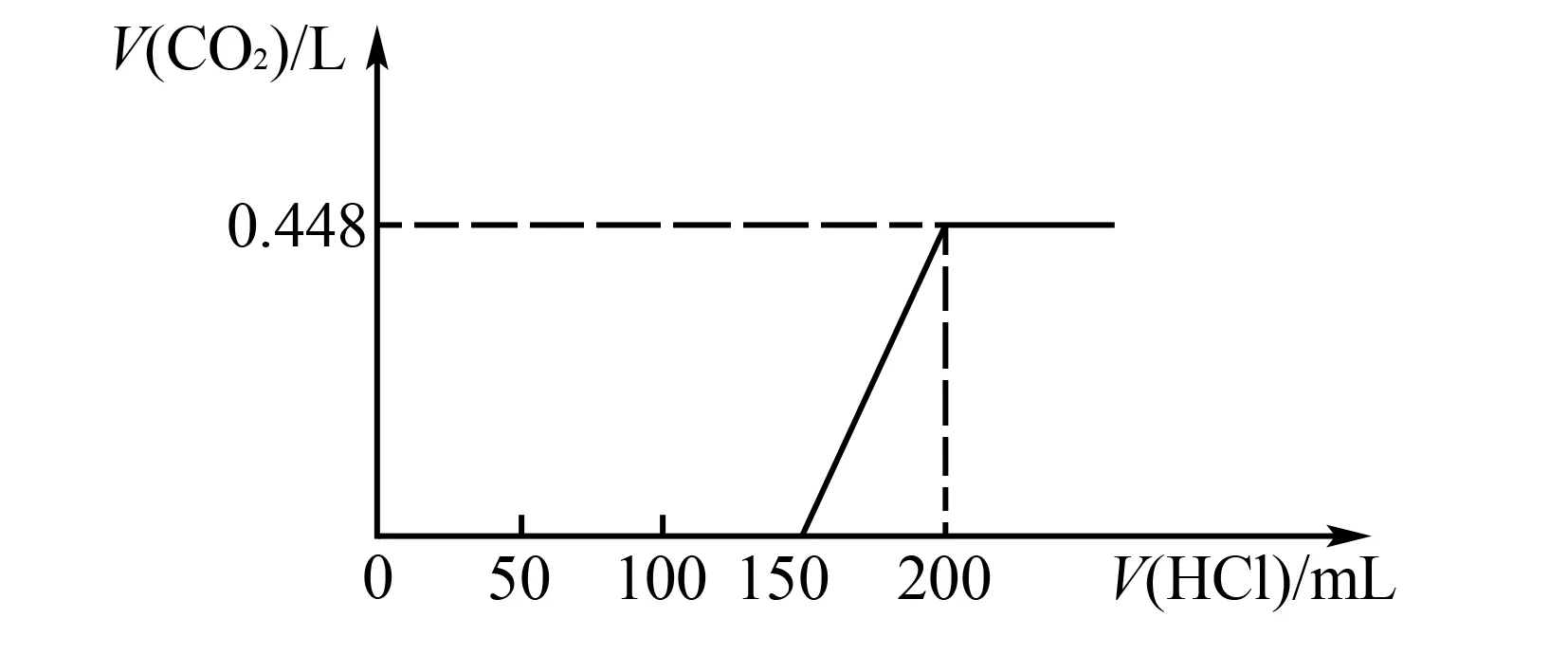
图1
A.滴加HCl 0~150mL段,发生的反应依次为

B.所有HCl的物质的量浓度为0.4mol/L
C.CO2体积不发生变化时,溶液中的溶质为NaCl
例3:某高校重大事项未严格依法依规进行决策,涉及金额681.9万元。某高校经校长办公会研究决定“同意启动新校区一至六饭堂和旧校区饭堂统一招标工作”,收取承包费。3年合计收取承包管理费 (折旧费)681.9万元。上述事项虽经集体讨论决定,但决策结果不符合教育部《关于进一步加强高等学校学生食堂工作的意见》第二点规定的高校内食堂的建筑设施由该高校统一提供,对承包经营都实行零租赁,免收管理费。
D.样品中NaOH、Na2CO3的物质的量之比为1∶2
解析由图可知HCl 0~150mL段未出现CO2气体,发生的反应依次为:

产生气体发生的反应为:
以滴加HCl 150~200mL为研究对象,容易计算出HCl的物质的量浓度为0.4mol/L.C项,CO2体积不变化时,溶液中NaHCO.刚好完全反应,溶液溶质为NaCl.当加入HCl为200mL时,溶液溶质为NaCl,n(NaCl)=0.4mol/L×0.2L=0.08mol.由碳原子守恒可得n(Na2CO3)=n(CO2)=0.02mol;由钠原子守恒可得固体中n(NaOH)=0.04mol,显然D项错误.
4 过量问题的常见题型分析
4.1 直接给出反应物的量,直接计算
此种类型的题目是最为常见、最为基本和直接的问题,解题基本没有难度,按照解题步骤进行严谨解题.在解题时,需要做好题目的综合分析,避免出现顾此失彼的情况.
例4在铁粉和硫粉的混合物中铁粉为221g,硫粉为8g,对混合物进行加热,忽略其他损失,可以生成ag硫化亚铁,将反应后的固体混合物投入到足量的稀硫酸中,可以得到标准状况下VL气体,那么a、V的值分别是( ).
A.33、8.4 B.22、5.6 C.29、8.4 D.22、8.4
解析根据题意n(Fe)=0.375mol,n(S)=0.25mol,因为
可以得出Fe过量,根据S的量进行计算,得出FeS的质量为22g,因为产生的气体是H2S和H2的混合气体,计算得出气体的体积是8.4.
4.2 固体反应物过量,做出定性判断
在化学反应中,部分反应要求液体是高浓度,当固体反应物过量的情况下,随着化学反应的进行,溶液的浓度开始降低,使得反应停止,或者出现其他反应.对这样的问题,不能够选择不足量的物质做出计算,需要借助动态化思想,做出定性判断.如Cu、Ag等金属和浓硫酸反应、二氧化锰和浓盐酸反应.在Zn和浓硫酸的反应中,浓度下降之后,还原产物也从二氧化硫变成氢气.
例5在100mL 18mol/L的H2SO4中,加入64g铜片,并且对其进行加热,被还原的H2SO4的物质的量是( ).
A.等于1.8mol B.等于1mol
C.等于0.9mol D.小于0.9mol
解析通过对题目进行分析,可以看出Cu是明显过量的,如果直接进行选量计算,得出的结果是C,很明显是一个错误的答案.根据题意进行深入分析,随着化学反应的进行,生成的水使得H2SO4溶液的浓度降低,因此,H2SO4被还原的物质的量应当小于0.9,选择D项.
4.3 混合物与某物质反应过量,做好转化计算
在化学反应中,涉及到混合物和某物质的过量问题,将混合物抽象转化成单一部分,做出相应的判断之后,在对其进行计算.
例6 在25℃和101kPa的条件下,CO和H2的混合气体10L,将其通入到15L的O2中,使其完全燃烧,干燥后恢复到原来的条件,求解:
(1)如果剩余气体体积是15L,那么原有混合气体中CO的体积是____,H2的体积是____.
(2)如果剩余气体的体积是aL,那么原有混合气体中CO和H2的体积比是____.
(3)如果剩余气体的体积是aL,那么a的取值范围是____.
解析此题在解题时,用到的是学生初中阶段熟悉的知识,一氧化碳和氧气以及氢气和氧气的燃烧反应,在3个问题中,从数字到字母,题目难度增加,虽然解题方式比较多,但解题的突破点是对过量问题的讨论.根据化学反应的特点进行分析,可以得出氧气的消耗是5L,剩余氧气体积是10L,所有得到的二氧化碳的体积是5L,根据碳原子守恒定定律可以得出CO的体积是5L,H2的体积是10L.结合(1)的分析,将其中的数字转化成字母,得出CO的体积是a-10,H2的体积是20-a,计算出混合气体中两种气体的体积比.(3)题解答中,利用极值思想,假设混合气体全部是H2,剩余气体是O2,所以a=10,假设混合气体全部是CO,a=20,因此得出a的取值范围是10 在活泼金属和水直接反应的问题中,不能够简单地按照溶质的量做出计算,需要对其进行分析,做好量的选择. 例7 在1 L 0.1mol/L的3份稀盐酸中,分别放入Na、Mg、Al各0.2mol,产生氢气的物质的量的比是( ). A.1∶2∶3 B.3∶2∶1 C.2∶1∶1 D.1∶1∶1 解析在解题时,如果不考虑过量的情况,按照金属进行计算,得到的答案是A,但却是错误的答案,根据3种金属和稀盐酸的化学反应,分析可知盐酸对于3种金属都是不足量,计算时可能会出现错误选项D.在分析时,让学生对Na和稀盐酸的反应进行分析,在反应时,钠和水发生化学反应,钠不仅不会剩余,还会产生0.2mol的H2,因此,Na和稀盐酸的反应中生成的氢气是Mg、Al的2倍,正确答案是C. 化学反应中某种物质过量意味着另一种与之发生反应的物质完全参加反应,在书写相关的化学方程式时应引起足够的重视.同时,针对逐渐添加某种物质至过量的问题,应搞清楚各个阶段参加反应的物质以及对应的化学方程式.4.4 溶质不足溶剂继续反应,应当慎重选量

