羟自由基和高铁肌红蛋白氧化体系对牦牛肉肌原纤维蛋白氨基酸含量变化的影响
布鑫荣,王惠惠,宋艳艳,余群力,韩 玲,张 丽,*,郭兆斌,陈 骋
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.陕西双汇食品有限公司,陕西 咸阳 712000)
蛋白质氧化是由血红素色素、金属催化剂和其他氧化剂作用引起的一个复杂的生理生化过程[1-2],经常发生在肉类、牛奶和鸡蛋等富含蛋白质的食物中[3]。引起肉类和肉制品蛋白氧化的3 种途径(羟自由基氧化、高铁肌红蛋白氧化和脂质氧化)中,羟自由基氧化和高铁肌红蛋白氧化是直接影响蛋白质氧化的两种主要途径[1,4-6]。此外,不同氧化途径和强度会对肌原纤维蛋白的氨基酸组成和含量产生不同程度的影响[7-11]。肉类是人体必需氨基酸(essential amino acid,EAA)的重要来源[12],然而,肉和肉制品在宰后成熟、运输和贮存等过程中因发生不可避免的蛋白氧化反应而破坏肌肉中的氨基酸,促使氨基酸侧链结构发生氧化修饰,进而导致肉类蛋白质营养价值的损失[13-15]。
氨基酸侧链基团的氧化修饰是蛋白质氧化的主要结果之一[14]。蛋白质中几乎所有的氨基酸侧链都可以被氧化修饰,例如脂肪族和芳香族氨基酸的羟基化、芳香族氨基酸残基的硝基化、甲硫氨酰残基的磺化氧化、巯基的亚硝酰化,以及一些氨基酸残基如精氨酸、赖氨酸、脯氨酸和苏氨酸的羰基化等[3,16-17]。已有研究表明,蛋白质中游离氨基酸和氨基酸残基极易被一种或多种活性物质氧化[16],且不同氧化体系对氨基酸的氧化具有选择性[18-20]。Park等[21]通过研究3 种不同的氧化体系对猪肉肌原纤维蛋白氨基酸的氧化修饰发现,在3 种氧化体系中,含硫氨基酸如半胱氨酸和蛋氨酸最容易被氧化;半胱氨酸、蛋氨酸和酪氨酸在羟自由基氧化体系(ironcatalyzed oxidizing system,IOS)中更易被氧化;而在高铁肌红蛋白氧化体系(metmyoglobin oxidizing system,MOS)中则是丙氨酸、半胱氨酸、甘氨酸、组氨酸、亮氨酸和赖氨酸较易发生氧化。李银等[22]研究也发现,猪肉肌原纤维蛋白的半胱氨酸、蛋氨酸及酪氨酸等敏感性氨基酸在IOS中易被氧化。而Refsgaard等[23]却发现,将牛血清白蛋白(bovine serum albumin,BSA)孵育在IOS中,赖氨酸、半胱氨酸和组氨酸易发生氧化修饰。此外,Dorta等[24]研究过氧化自由基诱导的牛肉肌原纤维蛋白氧化对氨基酸产生的影响发现,氧化4 h后,酪氨酸、色氨酸、蛋氨酸和赖氨酸含量显著下降。综上所述,自由基攻击氨基酸的偏好和选择不仅取决于氧化体系,而且和动物种属有关。肉类在宰后自然成熟过程中,氧化也可能使蛋白质发生降解或聚集,进而导致EAA的损失等[8],目前,有关不同氧化体系及牦牛肉成熟过程中因氧化引起的氨基酸含量变化的研究较少,且主要集中于不同氧化体系和成熟过程中牦牛肉生化特性的研究。
因此,本实验研究在IOS和MOS下,不同氧化强度对牦牛肉肌原纤维蛋白氨基酸含量的影响,并探究在不同氧化强度下牦牛肉成熟过程中肌原纤维蛋白氨基酸含量的变化,以期为探索氧化对牦牛肉品质的影响提供一定的科学理论依据。
1 材料与方法
1.1 材料与试剂
本实验选用甘肃省甘南藏族自治州3~4 岁(体质量约(300±50)kg)、健康无病的公牦牛6 头。在商业屠宰厂屠宰后,于30 min内取背最长肌(第12胸椎至第5腰椎),剔除表面筋膜、脂肪,切成3 cm×3 cm×3 cm大小的肉块。样品立即用液氮速冻;左侧背最长肌分别注射不同浓度的氧化剂,真空包装,于4 ℃条件成熟1、5、7、14 d(原位肉实验);右侧背最长肌-80 ℃下冻藏,并在不同氧化强度的IOS和MOS中进行孵育(体外实验)。
KCl、K2HPO4、KH2PO4、NaCl、乙二醇-双-(2-氨基乙醚)四乙酸(ethylene glycol bis(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、FeCl3、H2O2、抗坏血酸(vitamin C,VC)、哌嗪-N,N’-双(2-乙磺酸) 天津市光复科技发展有限公司;标准BSA、肌红蛋白 美国Sigma公司;其他试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
TGL-16PC台式高速冷冻离心机 湖南湘仪集团;SP-756P紫外-可见分光光度计 上海美谱达仪器有限公司;L-8900氨基酸自动分析仪 日本日立公司。
1.3 方法
1.3.1 原位模型构建
前期研究发现,H2O2浓度分别为50 mmol/L(低浓度)、200 mmol/L(中浓度)和500 mmol/L(高浓度)时,牦牛肉肌原纤维蛋白羰基含量差异显著(P<0.05)。本实验选取左侧背最长肌,部分样品立即用液氮速冻,将剩余样品随机分成4 份,分别注射0 mmol/L H2O2和5 mmol/L NaCl(对照组)、50 mmol/L H2O2和5 mmol/L NaCl、200 mmol/L H2O2和5 mmol/L NaCl以及500 mmol/L H2O2和5 mmol/L NaCl,注射量为肉质量的5%,真空包装,在4 ℃成熟1、5、7、14 d取样,用铝箔纸包裹,-80 ℃保存,用于构建原位模型。
1.3.2 体外模型构建
在原位模型基础上,测定不同浓度(50、200、500 mmol/L)H2O2处理后肌原纤维蛋白羰基含量,用羰基含量分别逆向确定IOS和MOS中的H2O2浓度。其中,IOS中,H2O2浓度分别为0.3、0.4 mmol/L和0.5 mmol/L,MOS中,高铁肌红蛋白(metmyoglobin,MetMb)和H2O2浓度均为0.01、0.03 mmol/L和0.05 mmol/L。
1.3.3 肌原纤维蛋白的提取
参考Park等[21]的方法并略作修改。称取1 g肉样,加10 倍体积标准盐溶液(20 mmol/L磷酸钾缓冲液、0.1 mol/L KCl、2 mmol/L EGTA、2 mmol/L MgCl2、pH 6.8)均质,于1 000×g条件下离心10 min(4 ℃),弃去上清液,沉淀用8 倍体积标准盐溶液溶解后,4 ℃离心10 min弃上清液,重复两次。沉淀用8 倍体积100 mmol/L KCl溶液溶解后,4 ℃离心10 min弃上清液,重复两次。采用双缩脲法定量蛋白,以吸光度为横坐标,以牛血清蛋白质量浓度为纵坐标作标准曲线,方程为y=0.061 3x-0.000 6(R2=0.999 7)。
1.3.4 体外氧化体系的建立
取置于-80℃冻藏的牦牛肉右侧背最长肌,按1.3.3节的方法提取肌原纤维蛋白用于体外孵化,建立体外氧化体系。
1.3.4.1 IOS的建立
参考Xiong Youling L.等[1]的方法并略作修改。将肌原纤维蛋白悬浮于H2O2浓度分别为0.3、0.4 mmol/L和0.5 mmol/L的15 mmol/L 1,4-哌嗪二乙磺酸(1,4-piperazinediethane sulfonic acid,PIPES)缓冲液(含0.6 mol/L NaCl、0.01 mmol/L FeCl3、0.1 mmol/L VC、pH 6.0)中,将蛋白质量浓度调至15 mg/mL,置于4 ℃下氧化24 h,用1 mmol/L EDTA终止反应,于2 000×g离心15 min(4 ℃),弃上清液。沉淀用孵育缓冲液洗涤两次,最后得到的沉淀重新悬浮在孵育缓冲液中,然后采用双缩脲法测定蛋白质量浓度。对照组为未加氧化剂直接于4 ℃放置24 h的肌原纤维蛋白。
1.3.4.2 MOS的建立
参考Park等[7]的方法略作修改。将肌原纤维蛋白悬浮于MetMb/H2O2浓度分别为0.01、0.03 mmol/L和0.05 mmol/L的15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl、pH 6.0)中,将蛋白质量浓度调至5 mg/mL,置于4 ℃氧化2 h,用1 mmol/L EDTA终止反应,于2 000×g离心15 min(4 ℃),弃上清液。沉淀用孵育缓冲液洗涤两次,最后得到的沉淀重新悬浮在孵育缓冲液中,然后采用双缩脲法测定蛋白质量浓度。对照组为未加氧化剂直接于4 ℃放置24 h的肌原纤维蛋白。
1.3.5 氨基酸含量的测定
参考GB 5009.124-2016《食品中氨基酸的测定》[25]和Park等[26]的方法测定氨基酸含量。在原位模型中,分别在肉样中注射0 mmol/L H2O2和5 mmol/L NaCl(对照组)、50 mmol/L H2O2和5 mmol/L NaCl、200 mmol/L H2O2和5 mmol/L NaCl以及500 mmol/L H2O2和5 mmol/L NaCl的氧化剂后提取肌原纤维蛋白,并取2 mL 10 mg/mL肌原纤维蛋白溶液和8 mL 6 mol/L HCl溶液混合后,缓慢加入水解管中,在体外模型中,从体外肉样提取肌原纤维蛋白,并将肌原纤维蛋白分别置于IOS(0.3、0.4 mmol/L和0.5 mmol/L的H2O2)和MOS(0.01、0.03 mmol/L和0.05 mmol/L的MetMb/H2O2)孵育,并分别取2 mL 10 mg/mL孵育后的肌原纤维蛋白溶液和8 mL 6 mol/L HCl溶液混合后,缓慢加入水解管中。后将原位和体外模型的水解样品均置于恒温箱中(110 ℃)水解24 h,冷却至室温。将水解液转移到50 mL容量瓶中,去离子水定容。之后分别经双层滤纸和0.22 μm水系微孔滤头过滤,并取滤液2 mL,采用氨基酸分析仪分别测定其原位和体外氨基酸组成。牦牛肉肌原纤维蛋白氨基酸含量单位为g/100 g pro。
1.3.6 氨基酸营养价值评价
1.3.6.1 氨基酸评分
依据联合国粮农组织/世界卫生组织(United Nations Food Agriculture Organization/World Health Organization,FAO/WHO)修订的人体EAA模式[27]进行比较,按公式(1)计算氨基酸评分(amino acid score,AAS)。

1.3.6.2 化学评分
采用FAO推荐的方法[28],按公式(2)计算化学评分(chemical score,CS)。

式中:Ai为待评蛋白质中某一EAA的含量/(g/100 g pro);Aj为待评蛋白质中EAA的总含量/(g/100 g pro);Ei为标准鸡蛋白中相应某一EAA的含量/(mg/g);Ej为标准全鸡蛋蛋白中EAA的总含量/(mg/g)。
1.3.6.3 必需氨基酸指数
采用FAO的方法[28],按公式(3)计算必需氨基酸指数(essential amino acid index,EAAI)。

式中:n为被比较的EAA个数;At、Bt、Ct、…、Zt为牦牛肉肌原纤维蛋白EAA含量/(g/100 g pro);As、Bs、Cs、…、Zs为全鸡蛋蛋白质的EAA含量/(mg/g)。
1.4 数据处理与分析
采用Excel 2010软件对数据进行分析,利用SPSS 21.0软件采用Duncan’s法对数据进行多重比较分析,以P<0.05作为差异显著性判断标准,选用因子分析对数据进行交互作用分析和主成分分析,并运用Origin 2017软件绘制主成分分析的载荷图和因子得分图。
2 结果与分析
2.1 不同氧化强度下牦牛肉成熟过程中肌原纤维蛋白氨基酸含量的变化
2.1.1 不同氧化强度下牦牛肉成熟过程中氨基酸含量的变化
肉中氨基酸的种类和数量是评价蛋白质营养价值高低的重要指标[29]。不同氧化强度下牦牛肉成熟过程中氨基酸含量差异显著,且氧化强度与成熟时间二者有交互作用,分析结果如表1所示。

表1 不同氧化强度下牦牛肉成熟过程中氨基酸含量的变化Table 1 Changes in amino acid contents during aging process of yak meat with different oxidation intensities

续表1
由表1可知,在同一氧化强度下,随着成熟时间的延长,所检出的17 种氨基酸中苏氨酸、甘氨酸、半胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、酪氨酸和赖氨酸的含量均显著下降(P<0.05),且依次下降约50%、19%、42%、10%、8%、38%、8%和7%;而在成熟的第0~5天时,丝氨酸、亮氨酸和组氨酸含量呈上升趋势,随后逐渐下降。此外,同一成熟时间,随氧化强度的增加,丝氨酸、甘氨酸、缬氨酸和酪氨酸含量均极显著下降(P<0.01)。同时,不同氧化强度和成熟时间二因素的交互作用对苏氨酸、丝氨酸、甘氨酸、丙氨酸、异亮氨酸、亮氨酸、组氨酸、精氨酸和脯氨酸均有极显著的影响(P<0.01)。
同一氧化强度下,随成熟时间的延长,总氨基酸含量、呈味氨基酸总量以及鲜味和甜味氨基酸含量均显著下降(P<0.05)(表1、2)。且在成熟的第0~5天时,EAA总量显著上升(P<0.05),而非EAA总量显著下降(P<0.05)。此外,在成熟的第14天,随氧化强度的增加,总氨基酸含量、EAA、NEAA和呈味氨基酸总量均显著下降。同时,不同氧化强度和成熟时间的交互作用对EAA、呈味氨基酸总量以及各呈味氨基酸(鲜味、甜味和苦味氨基酸)含量均有显著的影响(P<0.05)(表1、2)。根据FAO/WHO标准,优质蛋白质的EAA/TAA在40%左右,EAA/NEAA在60%以上[31-32],本实验各处理组EAA/TAA均大于40%,且在成熟5 d后EAA/NEAA也均大于60%,满足FAO/WHO标准。
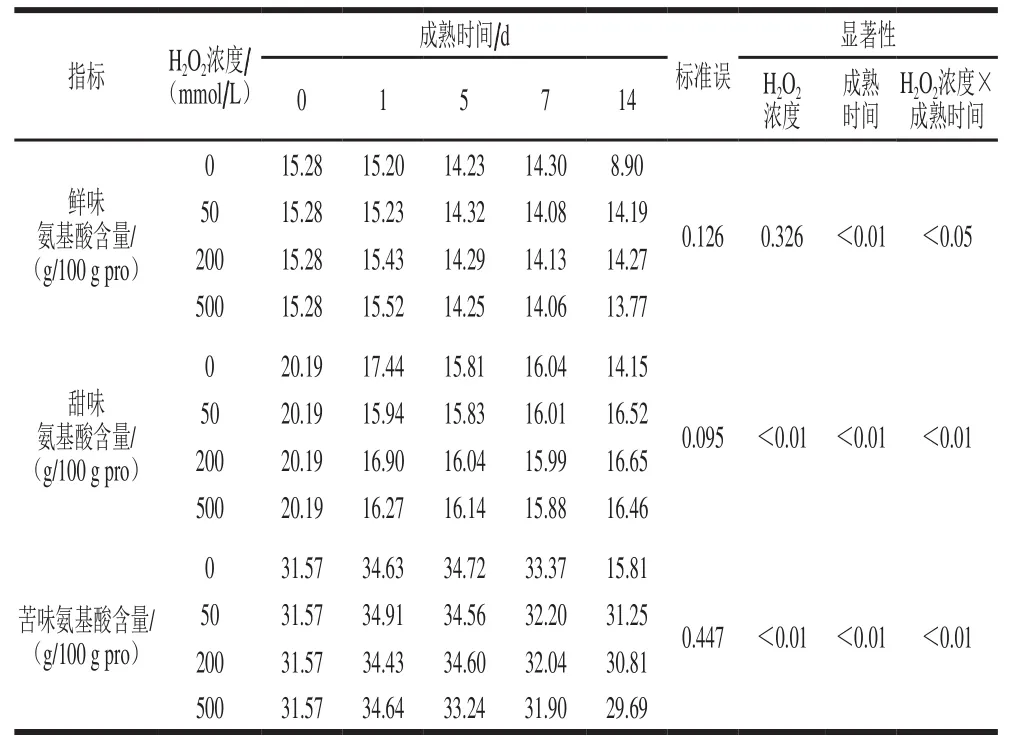
表2 牦牛肉成熟过程中呈味氨基酸含量的变化Table 2 Changes in taste-active amino acid contents during aging process of yak meat
2.1.2 两种氧化体系下不同氧化强度对牦牛肉肌原纤维蛋白氨基酸含量的影响
两种氧化体系、不同氧化强度处理牦牛肉肌原纤维蛋白氨基酸含量变化如表3所示。在两种氧化体系下,牦牛肉肌原纤维蛋白中苏氨酸、半胱氨酸和精氨酸的含量均随氧化强度的增加而显著降低(P<0.05),其中,与对照组相比,在高氧化强度下,苏氨酸、精氨酸和半胱氨酸含量在IOS中分别下降50.63%、47.05%和21.50%,而在MOS中苏氨酸、精氨酸和半胱氨酸含量分别下降33.28%、47.88%和62.00%。本研究还发现,蛋氨酸、酪氨酸、甘氨酸、亮氨酸和赖氨酸的含量在两个氧化体系中的变化不同,其中,在IOS中,蛋氨酸和酪氨酸含量随氧化强度的增加而显著下降(P<0.05),而在MOS中这两种氨基酸含量无显著差异(P<0.05)。与之相反的是,在MOS中,甘氨酸、亮氨酸和赖氨酸含量随氧化强度的增加而显著降低(P<0.05),而在IOS中三者变化不显著(P>0.05)。以上结果表明,蛋氨酸和酪氨酸在IOS中敏感而亮氨酸和赖氨酸在MOS中敏感。此外,在同一氧化强度下,不同氧化体系对天冬氨酸、苏氨酸、丝氨酸、甘氨酸、丙氨酸、半胱氨酸、蛋氨酸、亮氨酸和赖氨酸有显著影响(P<0.05)。同时,两种氧化体系和不同氧化强度的交互作用对天冬氨酸、苏氨酸、丝氨酸、丙氨酸、半胱氨酸、蛋氨酸、亮氨酸和赖氨酸含量均有显著影响(P<0.05)。
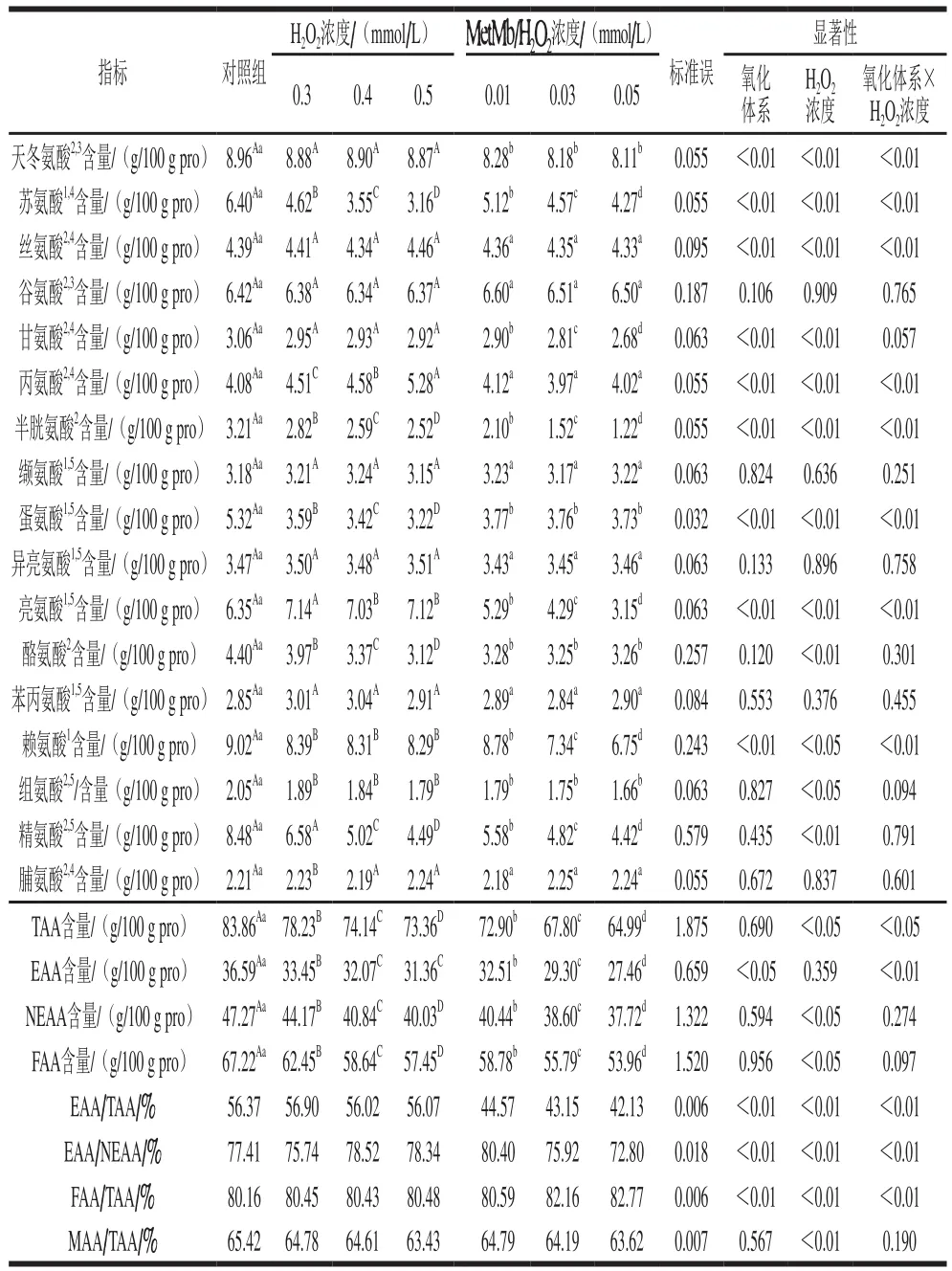
表3 两种氧化体系不同氧化强度下牦牛肉肌原纤维蛋白的氨基酸组成Table 3 Amino acid composition of yak meat myofibrillar protein as a function of oxidation intensity in two oxidizing systems
在同一氧化体系中,随着氧化强度的增加,氨基酸总量、EAA、NEAA和呈味氨基酸总量以及各呈味氨基酸含量(鲜味、甜味和苦味氨基酸)均显著下降(P<0.05)(表3、4),并且在相同氧化强度下,MOS中氨基酸总量、EAA、NEAA和呈味氨基酸含量均显著低于IOS。此外,两种氧化体系和不同强度二因素对总氨基酸含量、EAA、鲜味、甜味和苦味氨基酸含量均有极显著的互作影响。

表4 两种氧化体系不同氧化强度下牦牛肉肌原纤维蛋白的呈味氨基酸组成Table 4 Taste-active amino acid composition of yak meat myofibrillar protein as a function of oxidation intensity in two oxidizing systems
2.2 氨基酸营养价值评价
两种国际标准模式下氨基酸含量如表5所示。

表5 FAO/WHO模式及全鸡蛋蛋白模式中EAA含量Table 5 EAA contents in FAO/WHO pattern and whole egg protein pattern
2.2.1 不同氧化强度下牦牛肉成熟过程中氨基酸营养价值评价
AAS、CS和EAAI越接近100%,则蛋白与评分模式氨基酸的组成越接近,越符合理想蛋白模式[33]。不同氧化强度下牦牛肉成熟过程中肌原纤维蛋白的AAS、CS和EAAI见表6。在牦牛肉成熟过程中,CS保持不变,第一限制性氨基酸始终为异亮氨酸。而AAS发生变化,在成熟第5天后不同氧化强度下第一限制性氨基酸由缬氨酸变为异亮氨酸,这与异亮氨酸在牦牛肉成熟过程中被氧化形成羰基化合物有关。同时,不同氧化强度下牦牛肉宰后成熟过程中EAAI均高于100%。
2.2.2 两种氧化体系、不同氧化强度牦牛肉牛肌原纤维蛋白氨基酸营养价值评价
两种氧化体系、不同氧化强度牦牛肉肌原纤维蛋白的AAS、CS和EAAI见表7。将牦牛肌原纤维蛋白于IOS和MOS中进行体外孵育实验发现,两种氧化体系中不同氧化强度的CS始终保持不变,第一限制性氨基酸均为异亮氨酸。AAS结果显示,IOS中的牦牛肉的第一限制性氨基酸均为缬氨酸,而MOS中,随着氧化强度的增加,第一限制性氨基酸由缬氨酸变为亮氨酸,这是因为MOS对亮氨酸的氧化作用较强而使其含量显著降低(P<0.05)。同时,两种氧化体系不同氧化强度牦牛肉EAAI也均大于100%。
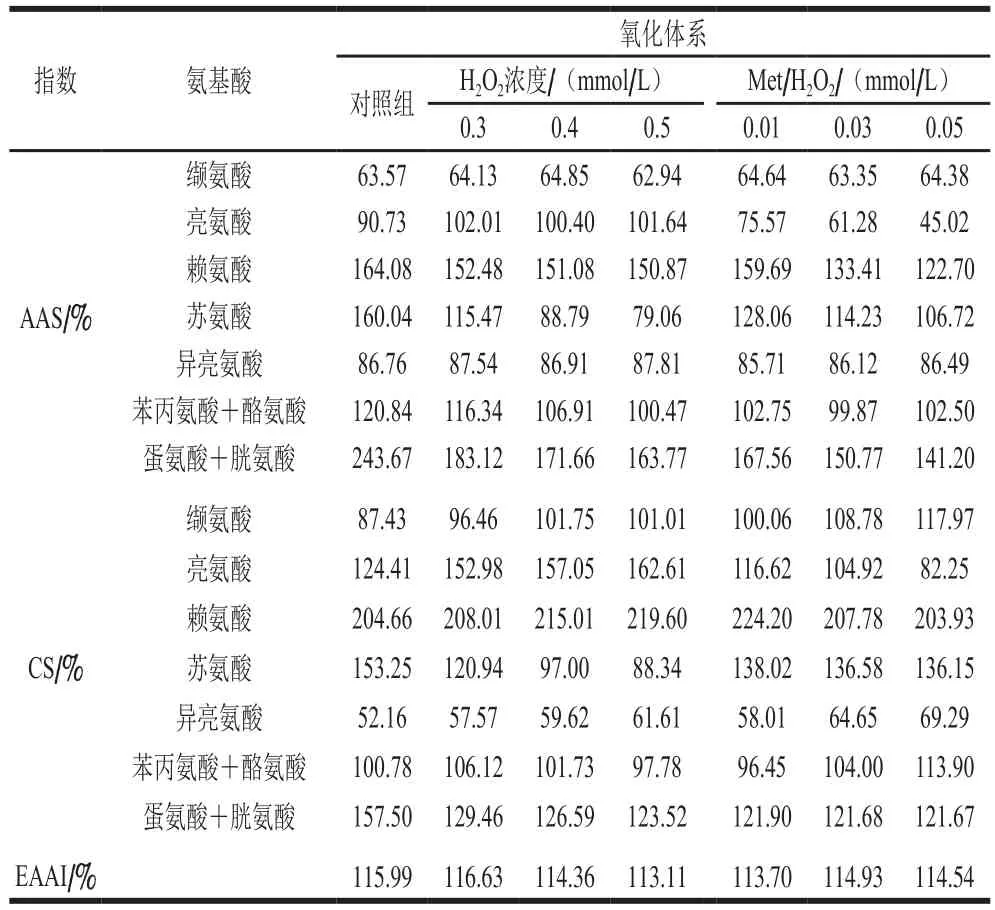
表7 两种氧化体系不同氧化强度牦牛肉肌原纤维蛋白AAS、CS和EAAITable 7 Amino acid scores (AAS), chemical scores (CS) and essential amino acid indexes (EAAI) of yak meat myofibrillar protein as a function of oxidation intensity in different oxidizing systems
2.3 主成分分析结果
2.3.1 不同氧化强度下牦牛肉成熟过程中肌原纤维蛋白氨基酸含量的主成分分析结果
主成分分析结果如表8所示。PC1和PC2分别解释了52.11%和21.87%的方差贡献率,累计贡献率达73.97%,基本反映了不同氧化强度下牦牛肉成熟过程中肌原纤维蛋白17 种氨基酸的大部分初始信息。因此,可提取前2 个主成分因子进行讨论分析,分析结果如图1所示。PC1能够明确区分成熟第0天和第1~14天时,时间对牦牛肉成熟过程中肌原纤维蛋白氨基酸含量变化的影响,可以作为成熟第0天和成熟第1~14天的区别因子;PC2能够明确区分成熟第1~5天和第7~14天时牦牛肉肌原纤维蛋白氨基酸含量的变化,可作为成熟第1~5天和第7~14天的区别因子。
不同氧化强度下牦牛肉成熟过程中肌原纤维蛋白氨基酸变化的得分图与载荷图如图1所示,牦牛肉成熟过程中,赖氨酸、苏氨酸、酪氨酸、半胱氨酸、脯氨酸、甘氨酸、天冬氨酸和丝氨酸的变化明显;在成熟的第1~5天,亮氨酸、蛋氨酸、异亮氨酸、缬氨酸和苯丙氨酸发生明显变化;而在成熟的第7~14天,谷氨酸、组氨酸、丙氨酸和精氨酸的含量变化明显,这一结果与表1结果相一致。
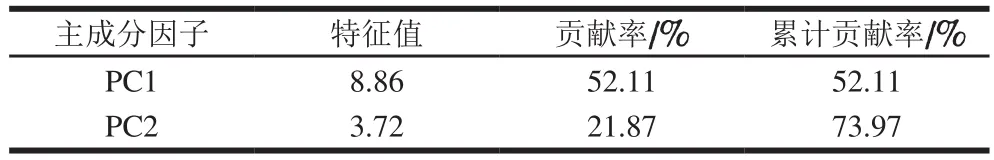
表8 不同氧化处理牦牛肉成熟过程中氨基酸主成分因子提取Table 8 Eigenvalues and contributions to total variance of principal components for amino acid contents in myofibrillar protein during aging process of yak meat with different oxidation treatments

图1 不同氧化处理牦牛肉成熟过程中氨基酸含量得分图(A)及相关载荷图(B)Fig. 1 PCA score (A) and loading plots (B) of amino acid contents of myofibrillar protein during aging process of yak meat with different oxidation treatments
2.3.2 两种氧化体系不同氧化强度牦牛肉肌原纤维蛋白氨基酸主成分分析结果
主成分分析结果如表9所示。根据累计贡献率超过75%的标准,可提取前两个主成分因子进行分析,结果如图2所示,PC1可作为氧化强度的区别因子;PC2可作为IOS和MOS的区别因子。
两种氧化体系、不同氧化强度牦牛肉肌原纤维蛋白氨基酸含量的前2 个主成分得分图及相关载荷图如图2所示,两种氧化体系、不同氧化强度牦牛肉肌原纤维蛋白中天冬氨酸、苏氨酸、蛋氨酸、精氨酸、酪氨酸、组氨酸、赖氨酸、甘氨酸、半胱氨酸、丝氨酸和亮氨酸的含量均发生明显变化,而在IOS和MOS中,不同氧化强度下,丙氨酸、异亮氨酸、苯丙氨酸、脯氨酸、缬氨酸和谷氨酸无明显变化,该结果与表2结果相一致。
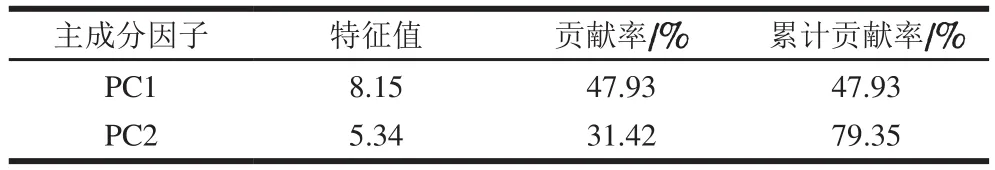
表9 两种氧化体系牦牛肉肌原纤维蛋白氨基酸主成分因子提取Table 9 Eigenvalues and contributions to total variance of principal components for amino acid contents of yak meat myofibrillar protein oxidized in two oxidizing systems
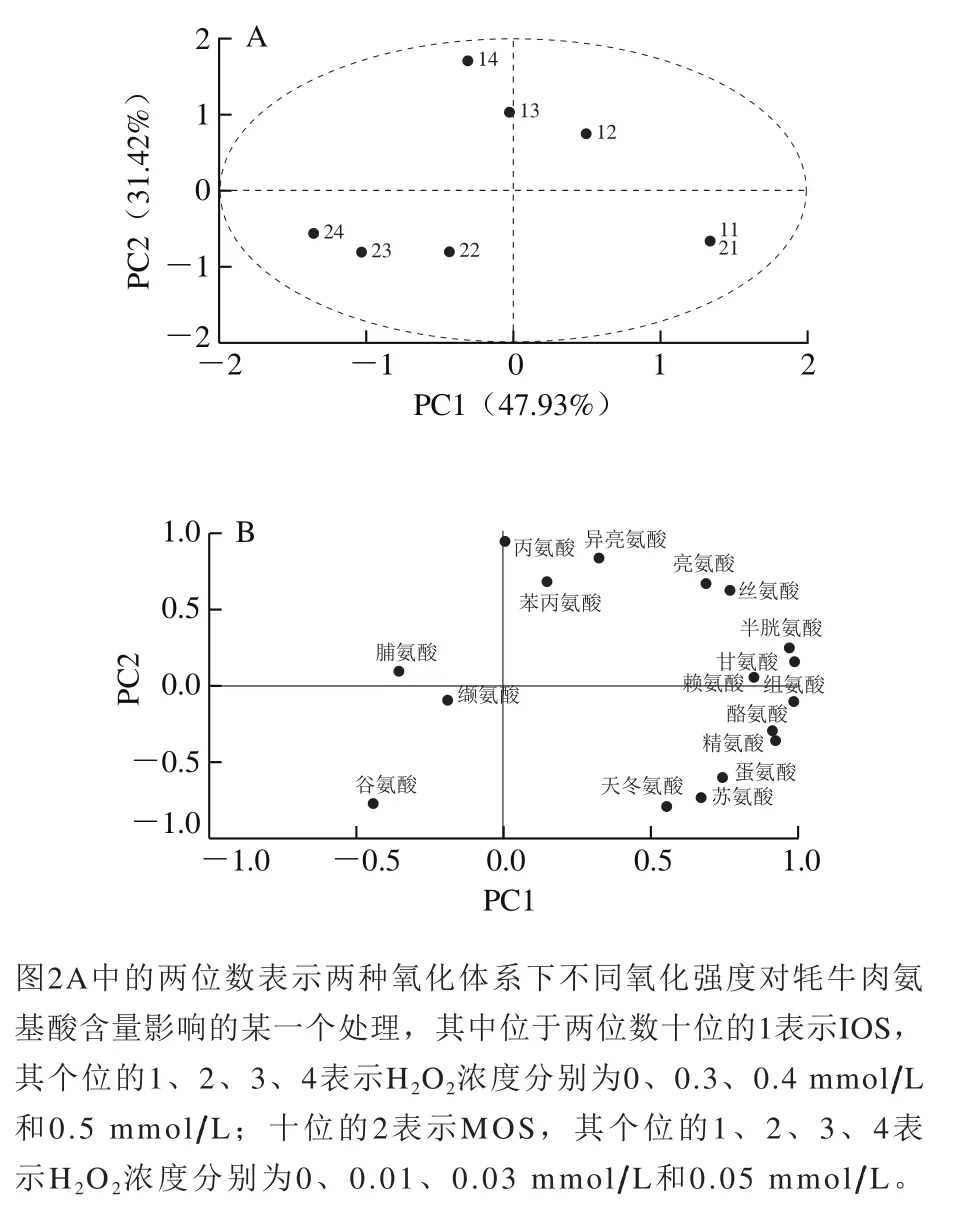
图2 两种氧化体系不同氧化强度牦牛肉肌原纤维蛋白氨基酸含量得分图(A)及相关载荷图(B)Fig. 2 PCA score (A) and loading plots (B) of amino acid contents of yak meat myofibrillar protein oxidized in two oxidizing systems
3 讨 论
氨基酸侧链基团的氧化修饰在生物体中普遍存在,且由蛋白氧化所引起的氨基酸侧链的氧化是导致肌肉蛋白营养价值损失的重要原因[13]。大量研究表明,蛋白质中所有氨基酸酰基都可以被活性氧(reactive oxygen species,ROS)等一种或多种活性物质氧化[16,21],本研究发现,牦牛肉成熟过程中,H2O2氧化处理会导致苏氨酸、甘氨酸、半胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、酪氨酸、赖氨酸、丝氨酸、甘氨酸、缬氨酸和酪氨酸含量显著下降。此外,氨基酸残基与脂质、糖类、氨基酸和谷胱甘肽等氧化产物反应也会诱导蛋白质中氨基酸残基发生间接氧化修饰[14]。然而,所有氨基酸对ROS等具有氧化活性的物质均有不同的敏感性。其中半胱氨酸可能是最易受影响的氨基酸残基,当自由基攻击半胱氨酸时,其反应活性巯基发生氧化形成二硫键[10],本实验在进行不同氧化强度处理下牦牛肉成熟过程中肌原纤维蛋白氨基酸含量变化的研究时也发现,同一氧化强度下,随成熟时间的延长,半胱氨酸含量下降约42%,而蛋氨酸含量下降约10%,其中蛋氨酸(含硫氨基酸)含量降低可能是因发生氧化反应而形成蛋氨酸亚砜衍生物[34]。已有研究表明,有活性侧链的氨基酸(如氨基、巯基、硫醚)也易受一些活性物质的氧化而形成羰基化合物[16,35-37]、蛋白分子间的交联物[38]以及参与蛋白合成[39]。本研究也发现,牦牛肉成熟的第1天,各处理组含游离氨基基团(ε-NH2)的苏氨酸含量下降约50%,这可能与苏氨酸因脱氨作用而转化为羰基衍生物有关,同时,在牦牛肉成熟过程中,缬氨酸、异亮氨酸、酪氨酸、半胱氨酸和赖氨酸含量也显著下降,这可能是因为缬氨酸和异亮氨酸被氧化形成羰基化合物、酪氨酸和半胱氨酸氧化形成蛋白质的交联、赖氨酸参与蛋白质的合成。此外,在牦牛肉成熟过程中,丝氨酸、亮氨酸和组氨酸含量随着成熟时间的延长而呈先上升后下降的趋势,这可能是由于氧化使疏水性氨基酸基团暴露,导致其含量上升,而随氧化程度的增加,氨基酸被氧化,疏水性氨基酸含量又有所下降[21]。
引起肉类和肉制品蛋白氧化的3 种主要途径(羟自由基氧化、高铁肌红蛋白氧化和脂质氧化)中,羟自由基氧化和高铁肌红蛋白氧化是直接影响蛋白质氧化的两种主要途径[1,4-6],且不同氧化途径对不同的氨基酸侧链基团也有特异性[18-20]。该研究发现,在IOS和MOS中,苏氨酸、半胱氨酸和精氨酸的含量均随氧化强度的增加而显著降低,而在这两种氧化体系之间存在显著差异的氨基酸包括蛋氨酸、酪氨酸、甘氨酸、亮氨酸和赖氨酸,其中,蛋氨酸和酪氨酸在IOS中具有较强的氧化敏感性,而甘氨酸、亮氨酸和赖氨酸在高铁肌红蛋白氧化敏感性较强。Park等[21]研究了3 种不同氧化体系下猪肉肌原纤维蛋白氨基酸的变化,结果表明,在IOS中,半胱氨酸、蛋氨酸和酪氨酸含量随氧化强度的增加而显著降低,而在MOS中,除半胱氨酸外,丙氨酸、甘氨酸、组氨酸、亮氨酸和赖氨酸含量随氧化强度的增加而显著下降,其中,半胱氨酸对MOS最敏感,而酪氨酸在高氧化强度下对IOS最敏感,这与本研究结果类似,不同的是,本研究得出在两个氧化体系中,随氧化强度的增加,苏氨酸和精氨酸含量也显著下降,且这两个氧化体系中最敏感的氨基酸分别为苏氨酸和半胱氨酸,其中,与对照组相比,在高氧化强度下,半胱氨酸含量在MOS中下降62%,苏氨酸含量在IOS中下降50.63%。而这两种氧化体系中牦牛肉肌原纤维蛋白敏感性氨基酸存在差异可能是因为IOS主要以羟自由基为主,而MOS除羟自由基外,还会生成铁氧基和蛋白自由基等,这在崔文斌[13]和Park[21]的研究中也被证实。
综上,由不同氧化机制和氧化强度所致游离氨基酸含量的变化会引起氨基酸总量、EAA、NEAA、呈味氨基酸含量以及氨基酸营养价值发生一定的变化。本实验主要研究了不同氧化强度下牦牛肉成熟过程以及在IOS和MOS下不同氧化强度对牦牛肉肌原纤维蛋白氨基酸含量的影响,但对其氧化机理有待进一步研究。
4 结 论
在IOS和MOS中苏氨酸、半胱氨酸和精氨酸含量均随氧化强度增加而显著降低,其中苏氨酸和半胱氨酸含量在成熟过程中的变化一致。不同的是,在成熟过程中,甘氨酸、缬氨酸、异亮氨酸和酪氨酸等氨基酸含量显著下降。两种氧化体系中的敏感性氨基酸不同,IOS中蛋氨酸和酪氨酸含量随氧化强度的增加而显著下降,而在MOS中,甘氨酸、亮氨酸和赖氨酸含量随氧化强度的增加而显著降低。因此,与单独氧化体系相比,牦牛肉成熟过程中氨基酸残基的氧化仅限于甘氨酸、缬氨酸、异亮氨酸和酪氨酸等少数几个氨基酸。

