药用真菌桑黄抗氧化物质及其活性研究
宋吉玲,王伟科,闫 静,陆 娜,周祖法,袁卫东
(杭州市农业科学研究院,浙江 杭州 310024)
桑黄是一类传统药用真菌的统称,隶属于担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、锈革孔菌目(Hymenochaetales)、锈革孔菌科(Hymenochaetaceae)、桑黄孔菌属(Sanghuangporus)[1]。在《药性论》、《本草纲目》和《神农本草经》等著作中均有桑黄及其药效的明确记载,也被现代人称为“森林黄金”[2-4]。现代研究表明,桑黄提取物在提高免疫力、抑制肿瘤细胞转移和增强抗肿瘤活性方面具有显著效果,是目前公认的抗癌效果较好的一种珍稀药用真菌,已成为药用真菌研究领域的热点[5]。
桑黄除了具有备受瞩目的抗肿瘤功效外,较好的抗氧化活性也是其特色之一[6-7]。研究表明,抗氧化作用过程是预防诸多慢性疾病和衰老的关键步骤,因为机体在正常生长发育过程中所产生的自由基或某些氧化剂对细胞和组织有分解、破坏作用,进而影响代谢功能,并引起不同的健康问题[8-10]。因此,消除人体内过多的氧化自由基,进而会对许多氧化自由基所引起的相关疾病起到一定的预防作用,如某些癌症[11]、心血管病[12]、糖尿病[13]、老年痴呆[14]、关节炎[15]等常见的老年疾病[16-17]。近年来,随着桑黄孔菌属(Sanghuangporus)属名与分类的进一步明确[1,18],桑黄受到越来越多的关注,而有关桑黄抗氧化活性的研究主要围绕少数几个种类展开,如王一菲等[19]发现,忍冬桑黄(S.lonicericola(Parmasto)L.W.Zhou & Y.C.Dai)和栎生桑黄(S.quercicolaLin Zhu & B.K.Cui)均具有较强的抗氧化能力;郑飞等[20]的研究结果表明,桑黄(S.sanghuangSheng H.Wu, L.W.Zhou & Y.C.Dai)在清除羟自由基、超氧阴离子、DPPH自由基和ABTS自由基方面表现出较强的能力,是一种较好的清除自由基的天然原料。桑黄抗氧化活性强弱与活性成分的种类和含量有密切的关联,且不同品种之间亦有所差异[21]。因此本研究在种质资源收集、鉴定和筛选工作的基础上[3,22-23],进一步对市场上流通较多并可栽培的杨树桑黄(S.vaninii(Ljub.) L.W. Zhou & Y.C. Dai)、鲍姆桑黄(S.baumii(Pilát) L.W. Zhou & Y.C. Dai)和桑树桑黄(S.sanghuang)进行研究,测定发酵液多糖、多酚、黄酮和抗坏血酸含量,以及DPPH自由基清除能力、ABTS自由基清除能力、羟自由基清除能力、超氧阴离子清除能力、铁离子还原能力、亚铁离子螯合能力、总抗氧化能力和超氧化物歧化酶(SOD)活性,分析不同桑黄品种抗氧化活性与抗氧化物质含量的关系,旨在为桑黄种质资源的开发与应用提供科学参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌 株 供试菌株为杨树桑黄(S.vaninii)、鲍姆桑黄(S.baumii)和桑树桑黄(S.sanghuang),保藏于杭州市农业科学研究院。
1.1.2 试 剂 苯酚、硫酸、乙醇、齐墩果酸、甲醇、葡萄糖、琼脂、KH2PO4、ZnSO4、MgSO4·7H2O、酵母浸粉、冰醋酸和高氯酸,均为分析纯试剂;多酚、黄酮、抗坏血酸、DPPH自由基清除能力、ABTS自由基清除能力、铁离子还原能力、亚铁离子螯合能力、总抗氧化能力、超氧阴离子清除能力、羟自由基清除能力和SOD活性等试剂盒,均购自南京建成生物工程研究所。
1.1.3 培养基 PDA固体培养基组成为:土豆200 g/L(煮水,过滤)、葡萄糖20.0 g/L、酵母浸粉5.0 g/L、琼脂粉15.0 g/L、KH2PO41.0 g/L,pH自然,121 ℃ 高压蒸汽灭菌30 min,取出置于室温冷却,备用。PDA液体培养基中,除不加琼脂粉外,其余成分与PDA固体培养基相同。
1.2 试验设计
从活化的PDA固体培养基中各取5个1 cm大小菌块,接种于装有100 mL液体培养基的三角瓶(250 mL)中,28 ℃、140 r/min振荡培养6~8 d,使用匀浆机将其制成悬液,充分振荡,以5.0%(体积分数)的接种量接种到装有100 mL PDA液体培养基的三角瓶(250 mL)中,28 ℃、140 r/min振荡培养,设3个重复[18]。每隔3 d取样1次,共测定7次。发酵液经4 ℃ 冷冻离心(12 000 r/min,10 min)后,于-80 ℃ 冰箱保存,用于测定抗氧化物质含量及抗氧化活性。pH计测量溶液pH值。
每隔3 d取50 mL液体培养混合物,经3层纱布过滤后,蒸馏水冲洗多次,于50 ℃烘箱烘至恒质量,称质量并统计生物量,同步观察发酵液颜色的变化。
1.3 测定指标及方法
1.3.1 抗氧化物质的测定 多糖含量采用苯酚-硫酸法[16,23-24]测定;多酚、黄酮、抗坏血酸含量和SOD活性的测定按照试剂盒说明书的步骤进行,以标准物的质量浓度为横坐标,OD值为纵坐标,制作标准曲线,并计算相应的回归方程,分别为y=182.395 8x+2.214 3(R2=0.998 1),y=28.277 2x+0.067 1(R2=0.998 3),y=2 205.652 2x+10.013 6(R2=0.998 0),y=5.476 4x+0.072 7(R2=0.998 0),测定样品的吸光度(测定波长均为450 nm),计算样品中的多糖、多酚、黄酮、抗坏血酸含量和SOD活性。
1.3.2 抗氧化物质活性的测定 (1) DPPH自由基清除能力。按照试剂盒说明书的步骤,先吸取100 μL发酵液,然后加入900 μL提取液,旋涡振荡混匀,室温10 000 r/min离心10 min,取上清,置冰上待测。取配制好的发酵液溶液10 μL,加入190 μL工作液,混匀后室温避光静置30 min,测定515 nm 处的吸光度,计算发酵液对DPPH自由基的清除能力[16]。
(2)ABTS自由基清除能力。按照试剂盒说明书的步骤,测定734 nm处的吸光度,计算发酵液对ABTS自由基的清除能力[25]。
(3)羟自由基清除能力。按照试剂盒说明书的步骤,在200 μL发酵液中依次加入各试剂,充分混匀,37 ℃保温20 min,吸取200 μL混匀后的样品溶液于96孔板中,测定510 nm处的吸光度,计算发酵液的羟自由基清除能力[25]。
(4)超氧阴离子清除能力。按照试剂盒说明书的步骤,取50 μL发酵液依次加入各试剂,充分混匀,室温避光静置5 min使之充分反应,于560 nm处采用酶标仪测定吸光度。发酵液处理完成后立即进行测定,或者低温保存不超过24 h,计算样品的超氧阴离子清除能力[16]。
(5)亚铁离子螯合能力。按照试剂盒说明书的步骤,移取发酵液50 μL,加入150 μL工作液,充分混匀后,于562 nm处测定吸光度,计算发酵液的亚铁离子螯合能力[16]。
上述指标的计算公式为:
清除能力或螯合能力=[1-(标准溶液OD值-发酵液OD值)/标准溶液OD值]×100%。
(6)总抗氧化能力。按照试剂盒说明书的步骤,取10 μL发酵液,加入20 μL应用液和170 μL ABTS工作液,充分混匀,室温反应6 min,波长405 nm,酶标仪读取各孔OD值,计算发酵液的总抗氧化能力[25]。
总抗氧化能力=样品OD值/标准溶液OD值×标准溶液的抗氧化能力(8 U/mL)×V。
式中:V为提取液体积。
(7)铁离子还原能力。按照试剂盒说明书的步骤,取40 μL发酵液,先后依次加入工作液共计340 μL,充分混匀,10 min内于700 nm处测定吸光度,计算发酵液的铁离子还原能力[16]。
铁离子还原能力=样品OD值/标准溶液OD值×标准溶液的铁离子还原能力(12 U/mL)×V。
式中:V为提取液体积。
1.4 数据统计分析
试验结果以“平均值±标准差”表示,利用SPSS 17.0软件进行单因素方差分析(ANOVA)、t检验和LSD检验。采用Pearson相关性分析法,以3个菌株各指标的平均值为基准,分析抗氧化物质含量与其抗氧化活性间的相关性[23]。运用Qrigin 8.0软件制图[25]。
2 结果与分析
2.1 3个桑黄菌株培养过程中菌丝体生物量和pH的变化
由图1和图2可见,在液体培养过程中,3个桑黄菌株的菌丝生物量均呈先上升后下降的趋势,并随着培养时间的延长逐渐由浅黄色变为黄褐色,直至黑褐色。培养后3~6 d,菌丝生物量均呈缓慢增长模式;6~12 d则呈现快速增长模式,其中杨树桑黄菌株由0.127 g增加至0.337 g,鲍姆桑黄由0.132 g增加至0.369 g,桑树桑黄由0.158 g增加至0.396 g;培养18 d时,菌丝生物量均达到最大,此时杨树桑黄菌丝生物量略低于其余2个菌株;之后伴随着菌丝自溶,菌株生物量均有所下降。
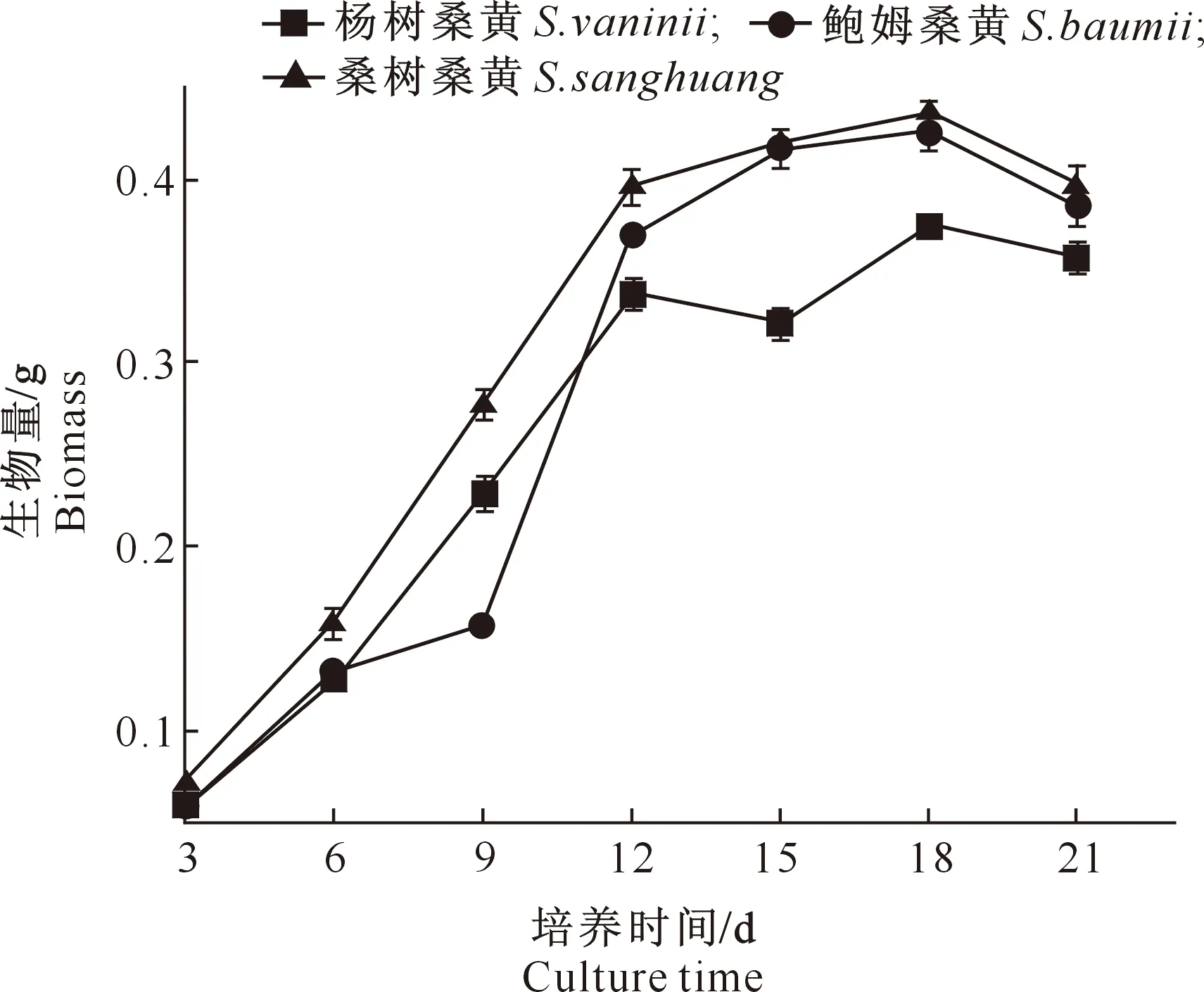
图1 3个桑黄菌株液体培养过程中的菌丝体生物量变化Fig.1 Changes in mycelial biomass of three Sanghuangporus strains during culture

图2 3个桑黄菌株液体培养过程中颜色的变化Fig.2 Changes in colour of three Sanghuangporus strains during liquid culture
3个桑黄菌株液体培养过程中pH的变化(图3)显示,3个桑黄菌株液体培养基随时间推移逐渐转酸,接种初期pH为6.03~6.08,随着培养时间的延长,至21 d时pH下降至4.52~4.80,这可能是由于菌株分泌的次级代谢产物逐渐增加,使得培养液pH逐渐下降。
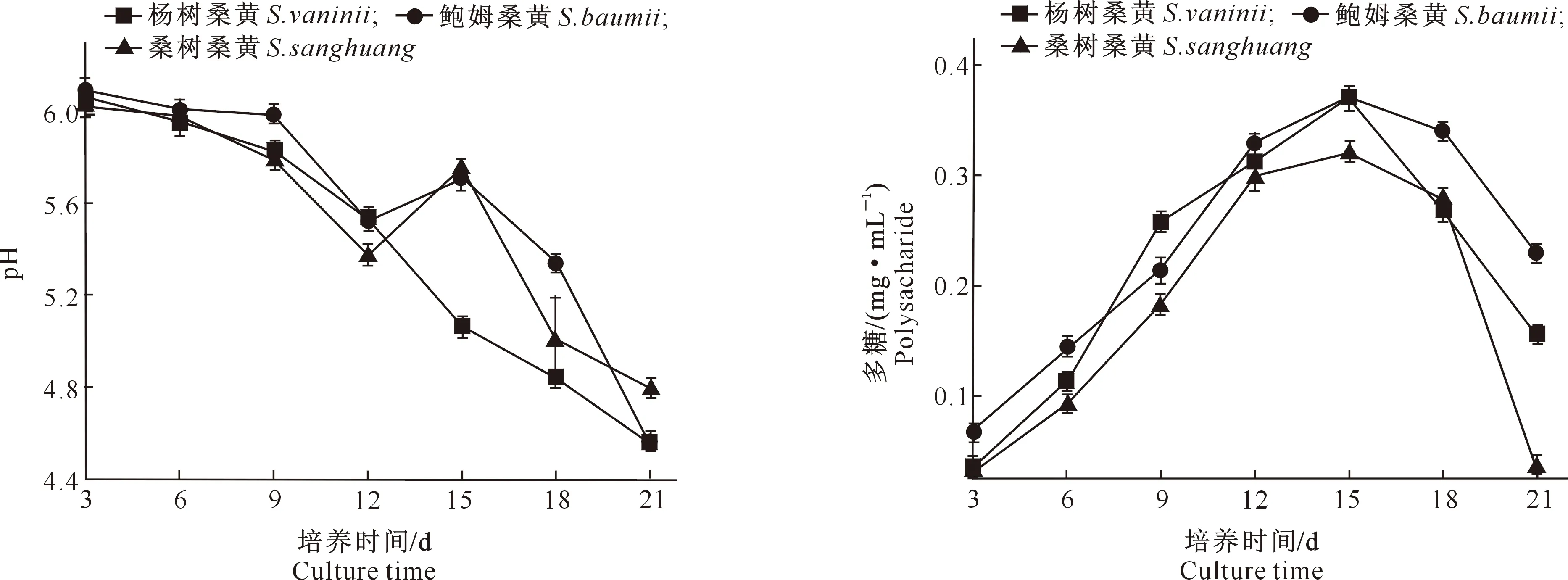
图3 3个桑黄菌株液体培养过程中培养基pH的变化Fig.3 Changes in pH of medium in liquid culture of threeSanghuangporus strains
2.2 3个桑黄菌株培养过程中多糖的变化
多糖是一类由多个醛糖或酮糖通过糖苷键聚合而成的高分子化合物,也是目前研究最为深入的活性成分[26-27]。由图4可知,3个桑黄菌株发酵液中的多糖含量均呈先上升后下降的趋势,其中杨树桑黄和鲍姆桑黄的多糖含量略高于桑树桑黄,变化趋势与课题组前期研究结果[23]相近,培养15 d时,3个桑黄菌株发酵液中的多糖含量均达到最高,其中杨树桑黄为0.370 mg/mL、鲍姆桑黄为0.371 mg/mL,桑树桑黄为0.321 mg/mL。
2.3 3个桑黄菌株培养过程中多酚的变化
多酚是广泛存在于植物和高等真菌体内的芳香族羟基衍生物的总称,其在抗肿瘤、抑菌、消炎和抗氧化方面具有较好的生理活性[16,19-20]。3个桑黄菌株液体培养过程中多酚含量的变化见图5。由图5可见,杨树桑黄和桑树桑黄的多酚含量在培养18 d时达到最高,均为0.416 μg/L;但二者变化趋势有别,杨树桑黄在培养开始后的前9天多酚含量逐渐降低,随后快速上升,而桑树桑黄在培养12 d后多酚含量才开始逐渐增加;鲍姆桑黄多酚含量在培养前9天时快速上升,随后有所下降并在18 d时达到最大(0.396 μg/L)。培养18 d后,3个桑黄菌株多酚含量均有所下降。在整个培养过程中,杨树桑黄的多酚含量几乎一直高于鲍姆桑黄和桑树桑黄(9 d除外),说明该菌株多酚分泌能力较强。
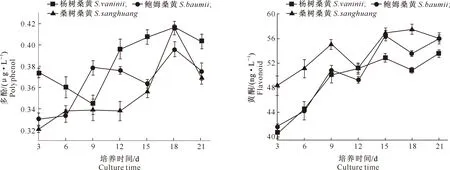
图5 3个桑黄菌株培养过程中多酚的变化Fig.5 Changes in polyphenol contents of three Sanghuangporus strains during culture
2.4 3个桑黄菌株培养过程中黄酮的变化
黄酮类物质是一类天然产物,广泛存在于植物和真菌的次级代谢产物中,具有抗癌、抗衰老、抗炎、降血糖、降血压、调节内分泌等诸多功能[20,28-29]。由图6可见,随着培养时间的延长,3个桑黄菌株的黄酮含量均呈不断上升趋势。杨树桑黄在培养后的3~15 d,黄酮含量由40.63 ng/L上升至52.837 ng/L,于培养21 d时达到最大值,为53.543 ng/L。培养3~9 d时,鲍姆桑黄和桑树桑黄的黄酮含量分别由41.667,48.357 ng/L上升至49.257,51.187 ng/L;12 d时有所下降,分别在15和18 d达最大值,为56.467和57.503 ng/L。综合来看,桑树桑黄黄酮含量明显优于其他2个菌株,而杨树桑黄和鲍姆桑黄在培养初期差异不明显,培养后期鲍姆桑黄明显优于杨树桑黄。
2.5 3个桑黄菌株培养过程中抗坏血酸的变化
图7显示,在整个培养过程中,3个桑黄菌株的抗坏血酸含量整体均呈现先缓慢上升再下降又上升的趋势,其中杨树桑黄的抗坏血酸含量一直高于其他2个菌株,并在培养的第15天时达到最大值,为28.899 μmol/L;鲍姆桑黄和桑树桑黄均于21 d时达到最大值,分别为25.328和26.435 μmol/L。

图7 3个桑黄菌株培养过程中抗坏血酸的变化Fig.7 Changes in ascorbic acid contents of threeSanghuangporus strains during culture
2.6 3个桑黄菌株的DPPH自由基清除能力
抗氧化能力是指对机体内ROS等氧化物质的清除能力[16]。由图8可见,在21 d的液体培养过程中,3个桑黄菌株的DPPH自由基清除能力整体均呈先上升后下降趋势,其中杨树桑黄在培养3~15 d时缓慢增大,并在培养15 d时达到最大,为87.71%;鲍姆桑黄除在培养的前6天有所下降外,其余时间一直呈稳定增长趋势,于18 d达到最大值,为95.83%;桑树桑黄在培养的3~9 d时,DPPH自由基清除能力显著提高,9~12 d又快速下降,随后又缓慢升高,至18 d达到最大值,为81.92%。综合分析来看,杨树桑黄的DPPH自由基清除能力整体优于桑树桑黄和鲍姆桑黄,但在培养18 d时,以鲍姆桑黄的DPPH自由基清除能力最高。
2.7 3个桑黄菌株的ABTS自由基清除能力
ABTS是一种水溶性自由基引发剂,氧化后生成蓝绿色的ABTS+阳离子自由基,在抗氧化剂作用下,ABTS+还原成无色的ABTS,且抗氧化能力越强,颜色越淡[16]。图9显示,在21 d液体培养过程中,杨树桑黄和桑树桑黄的ABTS自由基清除能力总体均呈先上升后下降的趋势,分别于18和15 d达到最大,为88.22%,78.61%;鲍姆桑黄的ABTS自由基清除能力总体也呈先上升后下降的趋势,于12 d时达到最大,为75.09%。从整个培养过程来看,杨树桑黄的ABTS自由基清除能力明显优于鲍姆桑黄和桑树桑黄。
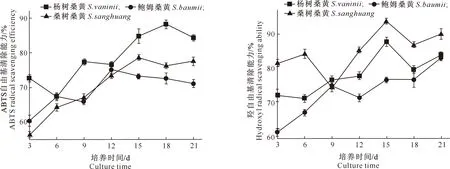
图9 3个桑黄菌株培养过程中ABTS自由基清除能力的变化 Fig.9 Changes in ABTS free radical scavenging ability ofthree Sanghuangporus strains during culture
2.8 3个桑黄菌株的羟自由基清除能力
羟自由基是人体新陈代谢过程中产生的毒性最强、危害最大的一种自由基,其可以使组织中的糖类、氨基酸、蛋白质、核酸等物质遭受氧化性损伤和破坏,导致细胞坏死或突变[30]。图10显示,整个培养过程中,杨树桑黄菌株的羟自由基清除能力在培养3~6 d变化不大,随着培养时间的延长,其清除能力呈逐渐上升趋势,于15 d时达到最大,为87.61%;鲍姆桑黄的羟自由基清除能力呈现阶梯式上涨趋势,于21 d时达到最大,为90.08%;桑树桑黄的羟自由基清除能力在培养6~9 d急剧下降,随后又呈快速上升趋势,并在15 d达到最大,为94.06%。综合分析来看,桑树桑黄的羟自由基清除能力整体优于杨树桑黄和鲍姆桑黄。
2.9 3个桑黄菌株的超氧阴离子清除能力
超氧阴离子作为生物体代谢过程中产生的一种自由基,与机体衰老和病变密切相关[31-32]。图11显示,3个桑黄菌株的超氧阳离子清除能力整体均呈先上升后下降趋势,且均于15 d时达到最大,其中杨树桑黄的超氧阴离子清除能力最大,为84.30%;鲍姆桑黄菌株的超氧阴离子清除能力整体低于杨树桑黄和桑树桑黄,为76.07%;桑树桑黄的超氧阴离子清除能力则随着时间延长而呈阶梯式上涨,达到最大时为83.38%。综合分析来看,杨树桑黄的超氧阴离子清除能力整体优于桑树桑黄和鲍姆桑黄。

图11 桑黄菌株培养过程中超氧阴离子清除能力的变化Fig.11 Changes in superoxide anion scavenging ability of three Sanghuangporus strains during culture
2.10 3个桑黄菌株的总抗氧化能力
总抗氧化能力是指对机体内ROS的清除能力,过多的ROS会导致大量的细胞损伤并产生毒性,因此,消除过多的ROS对于生物体的健康十分重要[19,33]。由图12可见,杨树桑黄在培养3~9 d时保持稳定增长,之后快速提升,于18 d达到最强,为6.61 U/mL;鲍姆桑黄培养9 d后的总抗氧化能力稳定增强,于21 d时达到最大,为6.47 U/mL;桑树桑黄的总抗氧化能力整体呈先上升后下降再上升的趋势,于15 d时最低,在21 d时达到最大,为6.85 U/mL。综合分析来看,桑树桑黄在总抗氧化能力方面明显优于杨树桑黄和鲍姆桑黄。
2.11 3个桑黄菌株的铁离子还原能力
铁离子还原能力是Fe3+被抗氧化物质还原成Fe2+,以供机体正常生长发育的能力[34-35]。由图13可见,杨树桑黄的铁离子还原能力随培养时间延长呈先增强后减弱的趋势,于15 d达到最大值,为8.89 U/mL;鲍姆桑黄的铁离子还原能力在培养9 d前明显高于桑树桑黄和杨树桑黄,于18 d时达到最大值,为9.77 U/mL;桑树桑黄的铁离子还原能力在培养12 d后明显提升,并在18 d达到最大值,为9.45 U/mL。综合分析来看,鲍姆桑黄的铁离子还原能力整体优于桑树桑黄和杨树桑黄。
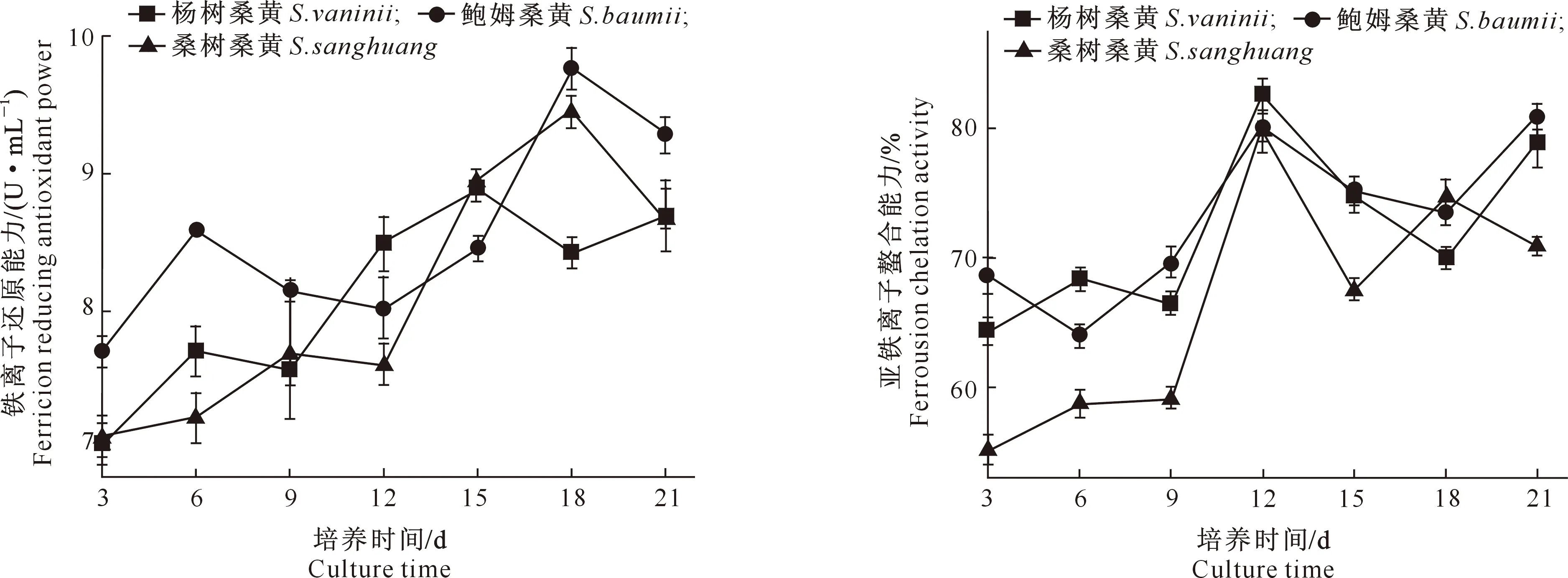
图13 3个桑黄菌株培养过程中铁离子还原能力的变化Fig.13 Changes in iron reduction ability of threeSanghuangporus strains during culture
2.12 3个桑黄菌株的亚铁离子螯合能力
由图14可知,在整个培养过程中,杨树桑黄和鲍姆桑黄的亚铁离子螯合能力整体优于桑树桑黄(18 d除外),整体均表现出先上升后下降的趋势。培养3~9 d时3个菌株处于平稳状态,均于12 d时均达到最大值,此时杨树桑黄、桑树桑黄和鲍姆桑黄的亚铁离子螯合能力分别为82.53%,79.73%和80.1%,之后均有所下降。
2.13 3个桑黄菌株的超氧化物歧化酶(SOD)活性
SOD是催化去除ROS的重要酶类,在生物体的生长、代谢、抗氧化和氧化还原调节中起主要作用[19,33]。由图15可见,杨树桑黄的SOD活性在培养的3~6 d有所下降,之后增长迅速,于18 d时达到最大值,为12.75 U/mL;桑树桑黄和鲍姆桑黄SOD活性在培养3~12 d呈浮动增长(先升后降),之后均迅速增强,均在18 d达到最强,分别为12.34和11.43 U/mL。综合分析来看,杨树桑黄的SOD活性整体优于鲍姆桑黄和桑树桑黄。
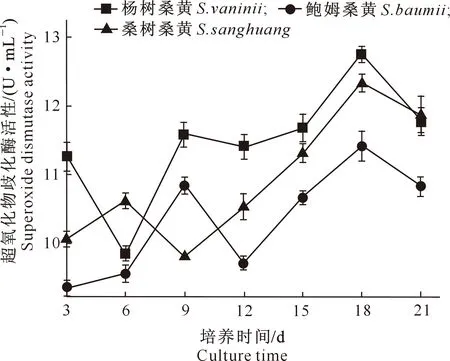
图15 3个桑黄菌株培养过程中超氧化物歧化酶活性的变化Fig.15 Changes in activity of superoxide dismutase of three Sanghuangporus strains during culture
2.14 3个桑黄菌株抗氧化物质与抗氧化活性的相关性分析
Pearson相关性分析结果(表1)表明,桑黄真菌活性成分与其抗氧化活性有一定的相关性,其中多糖含量与DPPH自由基清除能力、铁离子还原能力、亚铁离子螯合能力呈极显著正相关,与ABTS自由基清除能力、超氧阴离子清除能力呈显著正相关;多酚含量与DPPH自由基清除能力、ABTS自由基清除能力、铁离子还原能力、超氧阴离子清除能力、亚铁离子螯合能力和SOD活性呈极显著正相关;黄酮含量与铁离子还原能力、羟自由基清除能力、超氧阴离子清除能力和总抗氧化能力呈极显著正相关,与ABTS自由基清除能力和SOD活性呈显著正相关;抗坏血酸含量与DPPH自由基清除能力、ABTS自由基清除能力、羟自由基清除能力、超氧阴离子清除能力和SOD活性呈极显著正相关,与铁离子还原能力呈显著正相关。

表1 桑黄真菌抗氧化物质与其抗氧化活性的相关性Table 1 Correlations between antioxidants and their antioxidant activity of Sanghuangporus strains
桑黄菌株活性成分中与ABTS自由基清除能力和超氧阴离子清除能力相关性最强的为抗坏血酸含量,相关系数分别为0.819和0.855;与铁离子还原能力和超氧化物歧化酶活性相关性最强的为多酚含量,相关系数分别为0.642和0.759;与羟自由基清除能力和总抗氧化能力相关性最强的为黄酮含量,相关系数分别为0.790和0.765;与亚铁离子螯合能力相关性最强的为多糖含量,相关系数为0.606。
3 讨 论
桑黄作为一类具有重要药用价值的大型真菌,因其具有多种生理活性且无毒副作用而受到广泛的关注。本研究发现,杨树桑黄、鲍姆桑黄和桑树桑黄3个桑黄菌株均具有较强的抗氧化能力,但在不同抗氧化能力指标及强度上的表现不尽相同。随着培养时间的延长,其抗氧化能力总体呈现阶梯上升趋势,各抗氧化指标多在培养12~18 d时达到峰值。3个桑黄菌株亚铁离子螯合能力均于培养12 d时达到最强;培养15 d时,杨树桑黄清除羟自由基和超氧阴离子的能力达到最强;培养18 d时,杨树桑黄ABTS自由基清除能力和SOD活性达到最大,鲍姆桑黄的铁离子还原能力和DPPH自由基清除能力也达到最强,与此同时桑树桑黄和杨树桑黄的总抗氧化能力亦达到峰值。综合分析可知,桑黄菌株在培养12~18 d时抗氧化能力最强,这与郑飞等[20]“桑黄清除DPPH自由基能力在培养初期(第2天)最强”的研究结果不同,可能与菌株来源差异或培养条件不同有关,具体原因有待进一步研究。
桑黄的次级代谢产物含量与抗氧化能力具有一定的相关性[27]。本研究发现,杨树桑黄的多酚和抗坏血酸含量较高,鲍姆桑黄菌株的多糖含量较高,桑树桑黄的黄酮含量较高。相关分析结果表明,多酚含量与DPPH自由基清除能力、ABTS自由基清除能力、铁离子还原能力、超氧阴离子清除能力、亚铁离子螯合能力和SOD活性呈极显著正相关;而黄酮含量与铁离子还原能力、羟自由基清除能力、超氧阴离子清除能力和总抗氧化能力呈极显著正相关;抗坏血酸含量与DPPH自由基清除能力、ABTS自由基清除能力、羟自由基清除能力、超氧阴离子清除能力和SOD活性呈极显著正相关;多糖含量与DPPH自由基清除能力、铁离子还原能力、亚铁离子螯合能力呈极显著正相关。综合分析来看,多酚、黄酮和抗坏血酸为抗氧化能力的主要活性物质,多糖次之,这与应瑞峰等[36]、崔诗遥等[37]、钱骅等[38]及王伟科等[39]对桑黄子实体的研究结果相一致。与桑黄(S.sanghuang)[20]、栎生桑黄(S.quercicola)[19]和忍冬桑黄(S.lonicericol)[19]3个菌株的活性物质含量相比,本研究3个桑黄菌株的多糖含量相对较高,多酚、黄酮和抗坏血酸含量相对较低,可能是由于供试菌株生长状况差异导致不同代谢产物的合成有所偏差。

