喀斯特洞穴昆虫拉林裸灶螽尾须的超微结构
冯雪立,黄世会,罗昌庆
(贵州大学 a昆虫研究所 贵州山地农业病虫害重点实验室,b动物科学学院,贵州 贵阳550025)
喀斯特洞穴又称“溶洞”,是指可溶性岩石经地下水长期溶蚀、侵蚀以及重力崩塌等作用而形成的天然地下空间,是一种与地表(例如森林、草原、湿地、荒漠等)完全不同的地下环境[1-3]。作为陆地自然环境中的一个子系统,喀斯特洞穴与外界环境具有较高程度的隔离性,几乎每个洞穴都是一个相对独立的生态系统[4-5]。在这一特殊生态系统中,洞穴环境与洞穴动物、微生物及低等植物等共同构成了一个相互影响、相互制约的统一整体[1,6]。作为洞穴生物多样性的主要组成部分,洞穴动物对维持洞穴生态系统的稳定发挥着极为重要的作用[7-8]。
大部分洞穴动物可能因地形地貌变化(例如高原隆升)和气候变迁(例如第四纪气候变化导致的严酷气候条件)被迫由地表转入洞穴生活[9-11]。为适应洞穴极端生态条件,洞穴动物进化出了一系列特殊的形态、生理、行为等方面的特征[12-14]。其中,在形态学方面,大部分洞穴动物的附肢明显延长且密被感器,该形态结构特点表明穴居种类具备敏锐的嗅觉、触觉等感觉能力,有助于其在洞穴黑暗环境中运动、觅食、竞争、寻偶等[15-17]。比如,长期生活在黑暗环境中的洞穴蜘蛛,其步足明显延长,步足上的感器类型及数量也随之增多,使得该类群的触觉、嗅觉等非视觉感知能力变得更为敏锐[18-20]。多数洞穴步甲在适应洞穴环境的进化过程中,复眼退化甚至消失,而下唇须、下颚须、触角等附肢则变得尤为发达,使其能够更为灵敏地感知周围环境中的物理、化学信号,进而提高了其在洞穴环境中的捕食效率[21-22]。
疾灶螽属(Tachycines)昆虫属直翅目(Orthoptera)驼螽科(Rhaphidophoridae),是我国喀斯特洞穴中的常见昆虫类群[23-24]。迄今为止,我国已发现该属穴居种类24个,且大多分布于喀斯特洞穴繁多的西南地区[23,25-29]。该属穴居类群在形态结构上产生了一系列适应洞穴生境的明显变化,首先是复眼不同程度退化,且复眼的退化程度可能与不同种类营穴居生活的时间长短有关[25,27];其次是附肢极其修长[25,30],例如拉林裸灶螽(Tachycineslalinus)的尾须极为发达,几乎与躯体等长[27]。
作为昆虫重要的感觉器官之一,尾须表面附有多种形状不一、大小不同的感器,这些感器由尾须上丰富的感觉毛特化而成,具有感知外源信息的功能,在躲避天敌、繁殖、保持身体平衡等生命活动中起着重要作用[31-33]。目前,已报道的昆虫尾须感器类型主要有6类,分别为丝毛形感器、矛形感器、毛形感器、刺形感器、钟形感器及棒状感器[34-37],但关于拉林裸灶螽成虫尾须表面所附感器类型及其分布规律尚无报道。为此,本研究以栖息于喀斯特洞穴中的疾灶螽属昆虫拉林裸灶螽(T.lalinus)为研究对象,利用扫描电镜对其雌、雄成虫尾须表面所附感器进行观察、分析,明确该物种尾须所具有的感器类型及分布规律,为后续进一步探讨拉林裸灶螽尾须感器的生理功能以及其因洞穴极端生境而在尾须上产生的适应性变化奠定基础。
1 材料与方法
1.1 供试昆虫
拉林裸灶螽(Tachycineslalinus)雌、雄成虫,均采自贵州省黔南州独山县麻万镇拉林洞。该洞海拔966 m,经度107.560 157° E,纬度25.889 310° N。
1.2 样品制备
选取具完整尾须的拉林裸灶螽雌、雄成虫各5头。利用显微剪、镊子在体视显微镜(SMZ1270,Nikon,日本)下紧贴腹部位置取下完整尾须,将其置于生理盐水中浸泡30 min,利用磷酸缓冲液(pH 7.2)漂洗3次,每次15 min,然后用体积分数2.5%戊二醛溶液固定20 h。固定结束后利用超声波清洗机(JP-030S,中国)深层清洗15 min,然后置于0.01 mol/L碘化钾溶液中浸泡12 h。再依次用体积分数50%,70%,80%,90%和100%的乙醇进行梯度脱水,脱水完成后于无水乙醇中浸泡12 h;弃去乙醇溶液,于40 ℃电热鼓风干燥箱(101-ISB,中国)中干燥12 h,保存备用。
1.3 电镜观察
将1.2节的尾须样品粘在贴有导电胶的样品台上,离子溅射仪(NeoCoater,JEOL,日本)喷金2 min。通过扫描电镜(JCM 6000,JEOL,日本)观察拉林裸灶螽雌、雄成虫尾须整体特征及感器形态、分布特点,统计感器类型与数量。利用扫描电镜自带软件Scaler测量尾须及感受器的形态学指标。扫描电镜在15 kV的加速电压下运行。感器形态特征描述及命名参照文献[38-42]。
1.4 数据分析
试验数据采用“平均值±标准误”表示,采用SPSS 21.0软件进行分析,利用Levene’s tests进行方差齐性检验,通过Kolmogorov-Smimov tests检验数据是否为正态分布,对符合方差齐性以及正态分布的数据,利用独立t检验进行差异显著性分析,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 拉林裸灶螽雌、雄成虫尾须的整体形态特征
拉林裸灶螽雌、雄成虫尾须的外部形态特征如图1所示。

图1 拉林裸灶螽雌、雄成虫尾须的外部形态Fig.1 Morphology of cerci of female and male adults of Tachycines lalinus
由图1可知,拉林裸灶螽雌、雄成虫尾须着生于腹部末端背侧,几乎垂直于躯干,细长,不分节,呈须状,基部至端部逐渐变细。雌虫尾须平均长度为(9.372±0.318) mm,雄虫尾须平均长度为(9.276±0.321) mm。雌、雄成虫尾须的整体形态无明显二型现象,且其尾须长度无显著差异(P>0.05)。
2.2 拉林裸灶螽雌、雄成虫尾须感器种类及形态学特征
扫描电镜观察发现,拉林裸灶螽雌、雄成虫尾须感器均有刺形感器、丝毛形感器、钟形感器、锥形感器和毛形感器5种类型,且这些感器均着生于凸起的基窝中,部分感器仅在长度或基部直径上存在差异。根据外部形态差异,刺形感器又分为刺形感器1型和刺形感器2型2种亚型。
2.2.1 刺形感器(sensilla chaetica,Sc) 刺形感器具2种亚型,即刺形感器1型(Sc.1)和刺形感器2型(Sc.2)。刺形感器1型(Sc.1)相对较长,呈鬃毛状,基部至顶端逐渐变细,顶端尖锐,表面具纵向脊纹,基部有一凸起基窝,感器呈50°~90°夹角插入基窝(图2-A-C)。由表1可知,雌虫感器平均长度为(122.082±7.304) μm,基部直径为(11.918±0.792) μm;雄虫感器平均长度为(128.049±6.166) μm,基部直径为(9.681±0.449) μm。雌、雄感器长度无显著差异,但雌虫感器基部直径显著大于雄虫。
刺形感器2型(Sc.2)呈钉状,较刺形感器1型(Sc.1)短,基部至顶端逐渐变细,直至尖锐,表面有纵向脊纹,基部具臼状窝,感器大部分垂直尾须表面或与表面呈60°~90°夹角(图2-D-E)。表1显示,雌虫感器平均长度为(44.034±2.211) μm,基部直径为(7.751±0.314) μm;雄虫感器平均长度为(35.711±3.153) μm,基部直径为(7.031±0.468) μm。雌虫感器的长度显著大于雄虫,雌、雄成虫感器基部直径无显著差异。
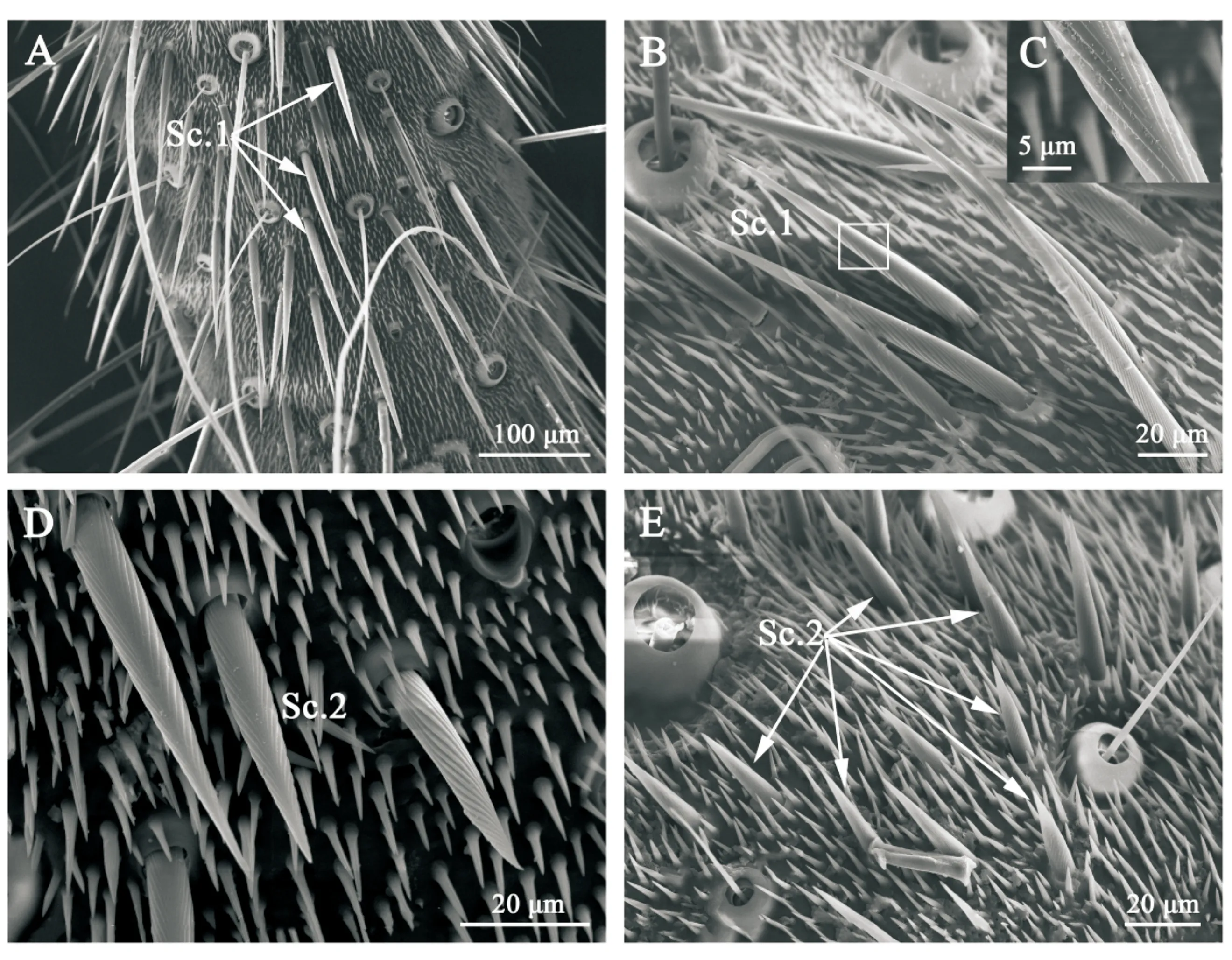
A~B.刺形感器1型;C.图B中白色方框部分放大,显示感器表面的纵向脊纹;D~E.刺形感器2型A-B.Sensilla chaetica subtype 1 (Sc.1);C.Enlargement of the white box in “panel B” to show longitudinal ridges on surface of sensilla chaetica subtype 1;D-E.Sensilla chaetica subtype 2 (Sc.2)
2.2.2 丝毛形感器(sensilla filiformia,Sf) 丝毛形感器(Sf)细长,呈丝毛状,底部至顶端逐渐变细,表面具纵向沟槽,基部有一毛窝复合体,该毛窝复合体在尾须表面隆起,包括凸凹的表皮轮廓以及内部一个凹陷近圆的轮廓,丝状毛垂直插入复合体内部凹陷深处(图3)。表1表明,雌虫感器平均长度为(977.794±110.294) μm,基部直径为(24.334±1.202) μm;雄虫感器平均长度为(1 218.321±95.093) μm,基部直径为(24.107±1.094) μm。雌、雄成虫感器长度及基部直径均无显著差异。
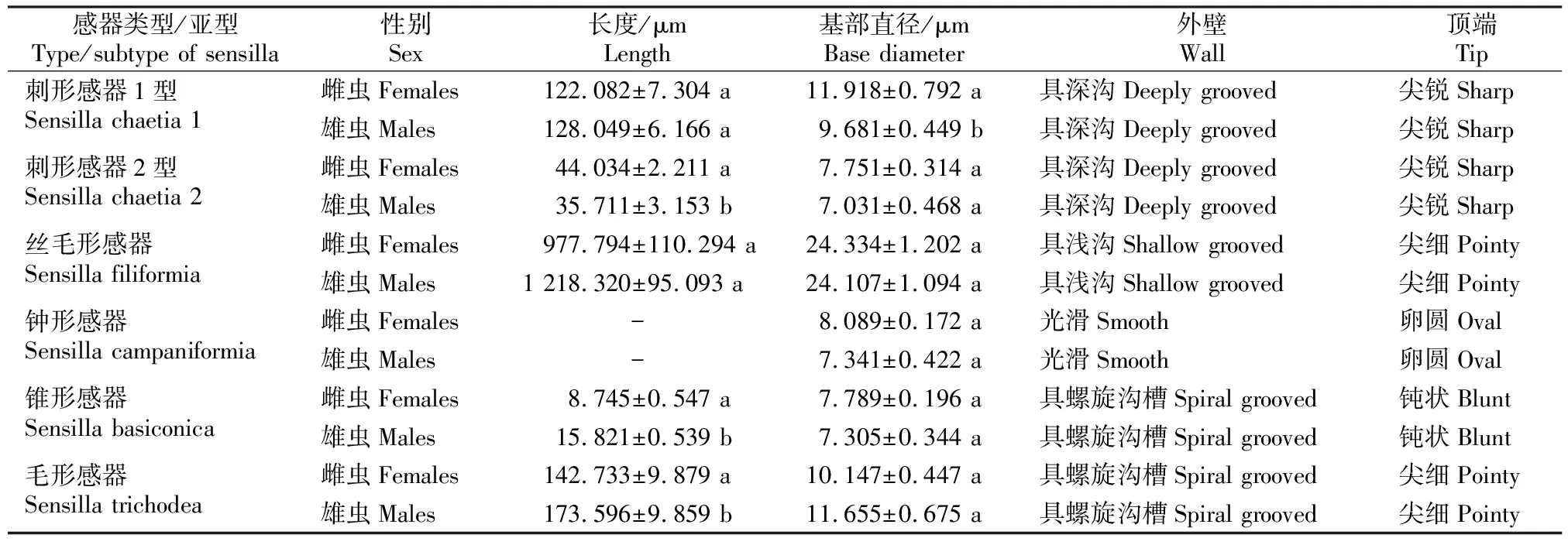
表1 拉林裸灶螽雌、雄成虫尾须感器的外部形态特征Table 1 Morphological characteristics of cerci sensilla in male and female Tachycines lalinus
2.“-”表示钟形感器的长度未测量(钟形感器与表皮等高,导致该感器的长度无法精确测量)。
Note:1.Different lowercase letters indicate significant differences in same sensilla type between male and female adults (P<0.05).The same below.
2.“-”indicates non detected due to equal heights between bell-shaped sensilla and epidermis.
2.2.3 钟形感器(sensilla campaniformia,Sca) 钟形感器(Sca)相对较小,呈纽扣状,表面无感觉毛,着生于尾须表面隆起的圆形基窝中,基窝边缘光滑清晰,表面呈空薄壁状,常与丝毛形感器基窝邻接(图4-A-B)。如表1所示,雌虫钟形感器基部直径为(8.089±0.172) μm;雄虫钟形感器基部直径为(7.341±0.422) μm,二者间无显著差异。
2.2.4 锥形感器(sensilla basiconica,Sb) 锥形感器(Sb)呈锥状,整体粗短,基部膨大,向顶部逐渐变细,顶端钝圆,着生于基窝中,表面具沟槽,直立散生于尾须上(图4-C-D)。由表1可知,雌虫感器平均长度为(8.745±0.547) μm,基部直径为(7.789±0.196) μm;雄虫感器平均长度为(15.821±0.539) μm,基部直径为(7.305±0.344) μm。雌、雄成虫感器长度差异显著,基部直径差异不明显。
2.2.5 毛形感器(sensilla trichodea,St) 毛形感器(St)形如毛发,细长,基部到顶端逐渐变细,顶端尖锐,感器表面有螺旋状纹,着生于向上隆起的基窝中,直立于尾须表面或与表面呈70°~90°夹角(图4-E-G)。表1显示,雌虫感器平均长度为(142.733±9.879) μm,基部直径为(10.147±0.447) μm;雄虫感器平均长度为(173.596±9.859) μm,基部直径为(11.655±0.675) μm。雄虫感器长度显著大于雌虫,而雌、雄成虫感器的基部直径无显著差异。
2.3 拉林裸灶螽雌、雄成虫尾须感器的分布规律
由表2可知,刺形感器1型(Sc.1)、刺形感器2型(Sc.2)、丝毛形感器(Sf)、钟形感器(Sca)、锥形感器(Sb)和毛形感器(St)在拉林裸灶螽雌、雄成虫尾须上均有分布。在数量上,Sc.1、Sc.2、Sf、Sca、Sb、St分别占雌虫尾须感器总数量的33.852%,25.806%,26.743%,2.416%,1.151%和10.032%,占雄虫尾须感器总数量的25.062%,20.415%,35.463%,1.672%,1.725%和15.663%。由此可见,雌、雄成虫各类感器数量占比较为相似。其中,Sc.1、Sc.2、Sf 3种感器占比较大,St次之,Sca和Sb在尾须上的数量则相对较少。

A~B.钟形感器;C~D.锥形感器;E~F.毛形感器;G.毛形感器表面的脊纹 A-B.Sensilla campaniformia (Sca);C-D.Sensilla basiconica (Sb);E-F.Sensilla trichodea (St);G.The ridges of sensilla trichodea图4 拉林裸灶螽尾须钟形、锥形、毛形感器的形态Fig.4 Morphology of sensilla campaniformia,sensilla basiconica and sensilla trichodea on cerci of Tachycines lalinus

表2 拉林裸灶螽雌、雄成虫尾须感器的数量和分布Table 2 Abundance and distribution of cerci sensilla in male and female Tachycines lalinus
为了了解各类感器在尾须上的分布情况,本研究将拉林裸灶螽尾须等分为基部、中部及尾端部3部分。结果(表2)表明,拉林裸灶螽雌、雄成虫尾须Sc.1、Sf、Sca、St分布最广,且在尾须的基部、中部、尾端部均有分布。其中Sf和St在雌、雄虫尾须各部位的分布数量无显著性差异;Sc.1在雌虫尾须各部位的分布数量均显著多于雄虫;Sca在雌、雄虫尾须基部的分布数量无显著性差异,但在雌虫尾须中部及尾端部的数量均显著多于雄虫;Sc.2主要分布于拉林裸灶螽雌、雄成虫尾须的基部和中部,在尾端部无分布;Sc.2在雌虫尾须基部的分布数量显著多于雄虫,但尾须中部的分布数量在雌、雄之间无显著性差异;Sb仅分布于拉林裸灶螽雌、雄虫尾须的基部,且雌、雄之间在感器数量上无显著性差异。
3 讨 论
本研究首次利用扫描电镜对栖息于喀斯特洞穴中的拉林裸灶螽雌、雄成虫尾须的整体形态及感器进行了观察。结果表明,拉林裸灶螽雌、雄成虫尾须均不分节,且雌、雄成虫具有相同的感器类型(刺形感器、丝毛形感器、钟形感器、锥形感器及毛形感器)以及较为相似的分布规律,仅在某些感器数量上存在一定差异。拉林裸灶螽尾须上的感器类型与已报道的其他螽亚目昆虫[43]尾须上的感器相似,但在其尾须上并未发现螽亚目昆虫(例如沙螽科Stenopelmatidae、癞蟋科Mogoplistidae、蚁蟋科Myrmecophilidae)尾须上常见的棒状感器。
刺形感器是昆虫尾须上一种较为常见的感器,该感器内部通常具有机械感觉神经细胞,能够感知机械刺激(例如振动、风向、角质层形变等)[44-45]。疾灶螽属昆虫拉林裸灶螽雌、雄个体尾须上的刺形感器均具2种亚型(Sc.1和Sc.2),在2种亚型感器数量上雌虫均显著多于雄虫,该差异可能导致雌虫在感知机械刺激时较雄虫更为敏感。此外,前人研究发现,庭疾灶螽(Tachycinesasynamorus)触角上的刺形感器,作为刚毛着生于其他感器周围(例如腔锥形感器),对其他感器起着保护作用[46]。拉林裸灶螽刺形感器广泛着生于其他感器周围,可能也同样对其他感器具有保护作用。
丝毛形感器一般由感觉细胞、胶质细胞及包膜细胞组成,具有检测空气流动及机械振动的作用[34,37,47-48]。本研究表明,拉林裸灶螽尾须上具有大量的丝毛形感器,有助于其在洞穴环境中更好地感知机械振动以及微弱的空气流动。此外,前人对栖息于洞穴中的白斑穴螽(Troglophilusneglectus)尾须形态及尾须对空气流动的感知作用进行了研究,发现其尾须垂直于躯体,尾须上的丝毛形感器使尾须能够灵敏感知水平方向的气流[49-50]。与白斑穴螽(T.neglectus)的尾须相似,拉林裸灶螽尾须垂直于躯体并且具有相似的丝毛形感器,因此推测拉林裸灶螽可能通过尾须上的丝毛形感器感知洞穴环境中水平方向上的空气流动。
钟形感器通常着生于丝毛形感器的周围,具有辅助丝毛形感器感受机械刺激的功能[51-52]。拉林裸灶螽尾须上钟形感器的基窝与丝毛形感器的基窝常邻接着生,在美洲大蠊(Periplanetaamericana)、家蟋蟀(Achetadomesticus)等昆虫中也发现了此类现象[32,34-35]。有学者对这种邻接着生的钟形感器和丝毛形感器的神经投射通路进行了研究,发现2种感器具有不同感觉神经元,并且在对机械刺激的响应方面,钟形感器不如丝毛形感器灵敏,只有在较高强度的机械刺激下,由丝毛形感器的振动引起基窝变形,进而引起钟形感器产生反应,这种由一种感器带动另一种感器产生反应的现象称为机械耦合[32,53-54]。因此,拉林裸灶螽可能通过这种机械耦合现象,利用钟形感器加强对较高强度机械刺激的响应。
锥形感器仅分布于拉林裸灶螽尾须的基部。在庭疾灶螽(Tachycinesasynamorus)触角上也发现了该类型感器,并且已证明该类型感器对外源化学物质无明显反应,但能够感受温湿度的变化,即该感器为温湿度感器[46]。
毛形感器在拉林裸灶螽雌、雄虫尾须的基部、中部和尾端部均有分布。前人研究表明,毛形感器能够感知机械刺激或者外源化学物质,并且表面具微孔的毛形感器才具有感知外源化学物质的功能[55-58]。拉林裸灶螽毛形感器表面不具微孔,因此该感器可能仅具有感知机械刺激的作用,而不能感知外源化学物质的变化。
总体而言,拉林裸灶螽尾须上的感器数量庞大,这可能与其对洞穴环境的适应有关。在黑暗无光的洞穴环境中,无法利用视觉感知周围环境,拉林裸灶螽便通过增加感器数量更为灵敏地感知环境中的各种刺激。

