高粱抗性淀粉辅助治疗胃癌的研究
南姝利 尚世龙 曾宪鹏 南喜平




摘要:高粱抗性淀粉对于多种疾病有治疗作用,通过体内及体外试验共同验证其辅助抑制肿瘤增殖的作用,评价高粱抗性淀粉与罗米地辛联合应用对胃癌的治疗作用。结果表明,在体内试验中,罗米地辛组肿瘤抑制率为34.6%,高粱抗性淀粉+罗米地辛组肿瘤抑制率为44.1%,高粱抗性淀粉+罗米地辛组对裸鼠肿瘤组织的增殖速度抑制更加明显;在体外试验中,抗性淀粉+罗米地辛模型组与罗米地辛组相比同样表现出更强的抑制SGC-7901细胞增殖的能力,2组药物将SGC-7901细胞周期阻滞在G1期,其机制是通过降低肿瘤细胞中STAT5A、cyclin-D1蛋白的表达而实现的。综合以上结果可以推断高粱抗性淀粉可增强罗米地辛抑制胃癌增殖的作用,达到辅助治疗胃癌的目的。
关键词:高粱抗性淀粉;罗米地辛;胃癌;肿瘤增殖
中图分类号: R735.2文献标志码: A
文章编号:1002-1302(2022)05-0168-05
收稿日期:2021-08-20
基金项目:吉林省科学技术厅技术攻关项目(编号:20190301066NY);长春医学高等专科学校科学技术研究项目(编号:2020KJ002)。
作者简介:南姝利(1989—),女,吉林公主岭人,硕士,讲师,主要从事肿瘤发生机制及治疗药物研究。E-mail:597616988@qq.com。
通信作者:南喜平,研究员,主要从事农产品加工研究。E-mail:xpnan001@163.com。
高粱是我国重要的粮食作物之一,其不但具有很高的食用价值,同时兼具药用价值。中医认为高粱性味甘平、微寒,有和胃健脾、消积、清热利湿、活血散瘀、解毒消痈等功效[1-2]。因此,我国古往今来都有利用高粱治疗腹泻[3]、消化不良[4]等疾病的例子。随着人们对饮食健康重视程度的不断增高,高粱制品走上了越来越多人的餐桌,人们对高粱的研究也更加深入,其新的药用价值也被慢慢发觉。研究表明,高粱可用于治疗慢性疾病,如高血压、高血脂[1]、糖尿病[5],对绝经肥胖[6]、肿瘤[7]等疾病也有治疗作用。高粱中的有效成分有很多,主要包括多酚类化合物、植物甾醇、甘蔗脂肪醇、淀粉等,通过前期对高粱淀粉的研究表明,高粱淀粉依据其消化特点可以大致分为快速消化淀粉、慢速消化淀粉及抗性淀粉(resistant starch,RS)[8]。目前已有研究证明抗性淀粉对肠道肿瘤[9]、胰腺癌[10]、宫颈癌[11]等肿瘤的预防和治疗具有一定作用。高粱抗性淀粉根据其结构特点可分为4类,分别为RS1、RS2、RS3、RS4[12],其总体特点是在肠道内不易被消化分解,而是通过肠道微生物发酵转变为其他代谢产物排出体外。因此与给予其他类淀粉相比,机体摄入抗性淀粉后,会大大降低其转化为葡萄糖进入机体的机会。而肿瘤细胞的能量来源主要是葡萄糖,葡萄糖的含量直接影響肿瘤细胞的存活[13]。肿瘤内葡萄糖减少可以有效阻断肿瘤细胞的能量供应,以致“饿死”肿瘤细胞[14]。由此可见,在肿瘤患者的饮食中添加高粱抗性淀粉制作的食物可以起到辅助治疗肿瘤的作用。
消化系统肿瘤是影响人类健康的重大杀手之一,其中胃癌的发病率在我国更是极高。据统计,亚洲国家的胃癌患者占全球胃癌患者的73%,而我国胃癌患者则占全球的50%[15]。目前临床上用于胃癌治疗的方法主要是通过手术,但遗憾的是并非所有人都可以通过手术的方式得到治疗,部分患者需要使用药物进行治疗,化疗药物的类型主要包括烷化剂类药物、抗肿瘤抗生素、抗肿瘤激素类药物、金属铂类药物、抗代谢药物、抗肿瘤植物药、分子靶向药物等[16]。这些药物均有各自特点也有很多不良反应,因此如何能够找到更加安全、有效的抗肿瘤药物或辅助治疗药物仍然是肿瘤治疗的研究重点。
通过之前研究发现抗肿瘤药物罗米地辛具有明显抑制肿瘤的作用,本试验于2020年10月至2021年8月在吉林省农业科学院农产品加工研究所通过体内和体外试验观察罗米地辛对胃癌增殖的抑制作用,同时对比联合使用高粱抗性淀粉前后罗米地辛在胃癌治疗中的作用,从而推断高粱抗性淀粉在胃癌治疗中是否具有辅助作用,为高粱抗肿瘤产品的开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 动物与细胞 SPF级雄性BALB/c 裸小鼠30只,4周龄,体质量(20±1) g,购于北京维通利华实验动物技术有限公司,恒温、恒湿、无菌条件下饲养。SGC-7901细胞株由中南大学湘雅细胞库购得。
1.1.2 试剂 高粱抗性淀粉实验室自制;罗米地辛购置于美国MCE公司;BCA 蛋白定量试剂盒、细胞周期与细胞凋亡检测试剂盒、Cell Counting Kit-8试剂盒、辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG购置于碧云天生物技术有限公司;DMEM 培养基、胎牛血清购自美国 Gibco公司;Anit-STAT5a 抗体、Anti-Cyclin D1抗体购于Abcam公司。
1.2 仪器与设备
显微镜(奥林巴斯公司);酶标仪(瑞士TECAN集团公司);电泳仪、电泳槽、凝胶成像系统(Bio-Rad中国公司);超速冷冻离心机(贝克曼集团有限公司);细胞孵育箱(SANYO 公司);流式细胞仪(Bio-Rad 中国公司)。
1.3 试验方法
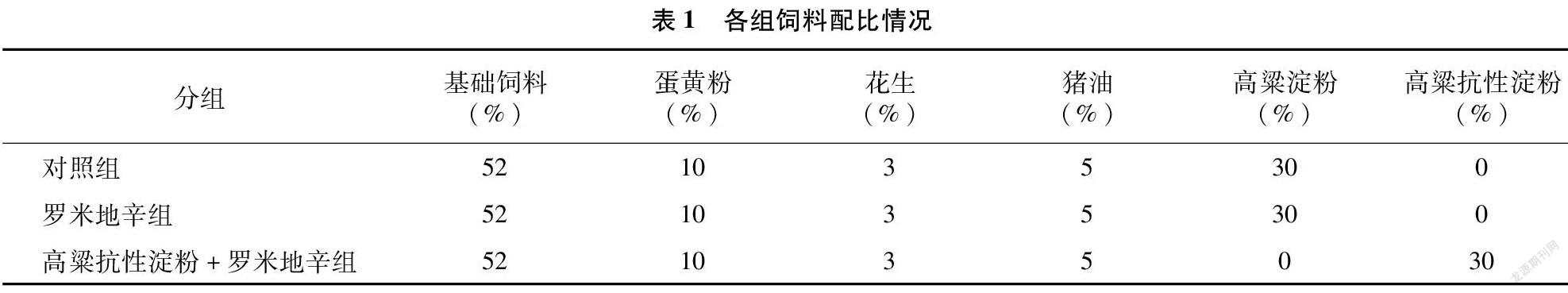
1.3.1 裸鼠胃癌模型制备及给药 将培养瓶中SGC-7901细胞经胰酶消化清洗后配制适量细胞悬液在每只裸鼠的肋部(右肋)皮下接种5×106个细胞,将30只裸鼠随机分为3组,分别为对照组、罗米地辛组、高粱抗性淀粉+罗米地辛组。接种3 d后开始给药,罗米地辛组、高粱抗性淀粉+罗米地辛组给予 1 mg/kg罗米地辛治疗1次,对照组给予 20 mg/kg 的二甲基亚砜(DMSO)生理盐水[17]。此外,为观察高粱抗性淀粉对罗米地辛治疗作用的影响,对照组和罗米地辛组裸鼠饲料中添加高粱淀粉,而高粱抗性淀粉+罗米地辛组裸鼠饲料中添加高粱抗性淀粉,根据文献[18],各组裸鼠饲料配比情况如表1所示。
1.3.2 肿瘤体积及抑制率的计算方法 接种肿瘤细胞后每隔3 d用游标卡尺测量皮下肿瘤的长、宽以计算肿瘤体积,计算公式如下:体积=0.52×长轴×短轴2。
各組裸鼠给药21 d后脱颈处死,剥离出肿瘤包块后称质量,计算肿瘤抑制率,肿瘤抑制率计算公式如下:
肿瘤抑制率=对照组肿瘤质量-给药组肿瘤质量对照组肿瘤质量×100%。
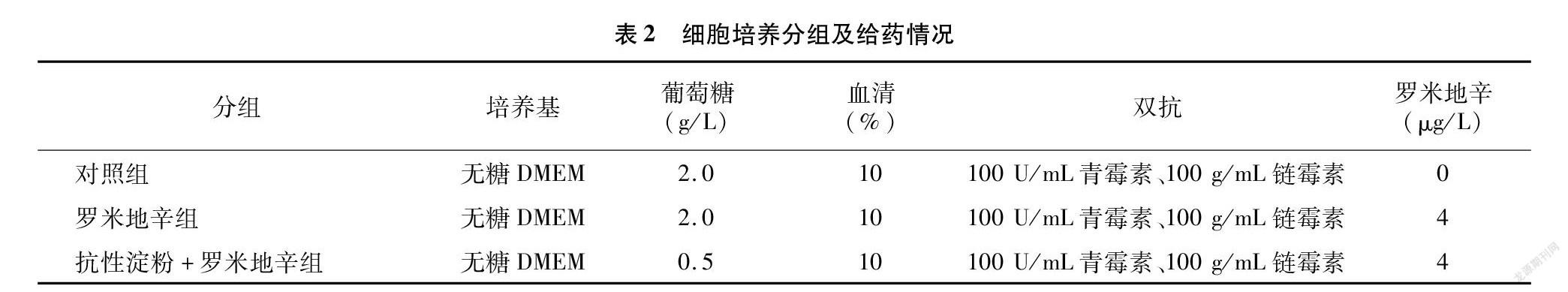
1.3.3 细胞培养及分组给药 将细胞培养分为3组:对照组、罗米地辛组、抗性淀粉+罗米地辛组。通过查阅文献[19],具体分组如表2所示。
1.3.4 给药浓度及时间确定 为了确定罗米地辛的给药剂量,通过查阅前期文献,本试验按照梯度选取5个浓度:0、2、4、8、16 μg/L 作为初始给药浓度,96孔板培养细胞孵育24 h后分别加入5个浓度药物,通过Cell Counting Kit-8试剂盒检测细胞增殖情况,选择细胞存活率介于70%~80%的浓度为给药浓度。给药浓度确定后再次铺板孵育后给药,给药后0、6、12、24、48 h 5个时间点分别再次通过Cell Counting Kit-8试剂盒检测细胞增殖情况,同样选择细胞存活率介于70%~80%的时间点,选定给药时间。
1.3.5 细胞增殖检测 将培养瓶中SGC-7901细胞经胰酶消化清洗后配制适量细胞悬液,均匀吸取0.5 mL细胞悬浮液加入24孔板的每个孔中,每组设置3个副孔,培养24 h后按照不同分组分别给药。给药后细胞继续培养7 d,1~7 d中每日分别收集每组细胞,通过Cell Counting Kit-8试剂盒检测细胞增殖情况,最后绘制7 d细胞增殖曲线。
1.3.6 细胞周期检测 将培养瓶中SGC-7901细胞经胰酶消化清洗后转移至1.5 mL离心管中,使用细胞周期与细胞凋亡检测试剂盒按照使用说明分别加入试剂后,用锡纸包裹避光,放置于37 ℃细胞孵箱中孵育30 min,随即放入冰盒避光保存。采用488 nm激发波长通过流式细胞仪检测各组样品细胞周期。
1.3.7 Western Blot 法分析蛋白表达 将培养瓶中SGC-7901细胞经胰酶消化清洗后配制适量细胞悬浮液,均匀吸取1 mL细胞悬浮液加入6孔板中,每组设置2个副孔,孵育24 h后分组给药,按照给药时间继续培养后弃去培养基并清洗3次,刮下细胞提取蛋白。用BCA蛋白定量试剂盒对各组样品进行蛋白定量,将定量后的样品进行聚丙烯酰胺凝胶电泳,经转膜、封闭、杂交、显影后观察结果。
1.4 数据统计
采用SPSS 20.0软件进行分析,数据显著性差异采用Duncans新复极差法进行多重比较(α=0.05)。
2 结果与分析
2.1 各组裸鼠胃癌组织增殖情况比较
肿瘤接种后检查成瘤状态,所有被接种裸鼠体内均成瘤。观察发现,成瘤裸鼠进食情况、活动情况及精神状态与未成瘤前无明显差别。给药过程中每隔 3 d 测量裸鼠皮下肿瘤长、宽,计算肿瘤体积后进行记录,最终绘制出各组裸鼠肿瘤体积增长曲线。如图1所示,与对照组肿瘤体积相比,罗米地辛组和高粱抗性淀粉+罗米地辛组肿瘤体积均显著降低(P<0.05)。给药结束后剥离出肿瘤包块,分组称质量后计算肿瘤抑制率。如表3所示,罗米地辛组肿瘤抑制率为34.6%,高粱抗性淀粉+罗米地组肿瘤抑制率为44.1%(P<0.05)。以上试验结果说明单独给予罗米地辛以及高粱抗性淀粉联合罗米地辛对于肿瘤增殖均有抑制作用,其中高粱抗性淀粉联合罗米地辛对肿瘤增殖抑制作用更为显著,高粱抗性淀粉对于罗米地辛的抗肿瘤作用起到增强作用。
2.2 各组细胞增殖情况比较
为确定罗米地辛的给药剂量和给药时间,通过Cell Counting Kit-8试剂盒检测SGC-7901细胞存活率,最终确定罗米地辛给药浓度为4 μg/L、给药时间为24 h。为了验证高粱抗性淀粉和罗米地辛对胃癌细胞增殖的影响,本试验通过观察各组细胞7 d内的增殖情况进行验证。按照试验分组观察3组细胞1~7 d的增殖情况,并且通过Cell Counting Kit-8试剂盒进行检测。记录数据后绘制7 d细胞增殖曲线,如图2所示,罗米地辛组、抗性淀粉+罗米地辛组与对照组相比细胞增殖速度明显减慢,且与时间呈正相关(P<0.05),抗性淀粉+罗米地辛组细胞增殖受抑制程度更为显著。
2.3 各组细胞的细胞周期分布比较
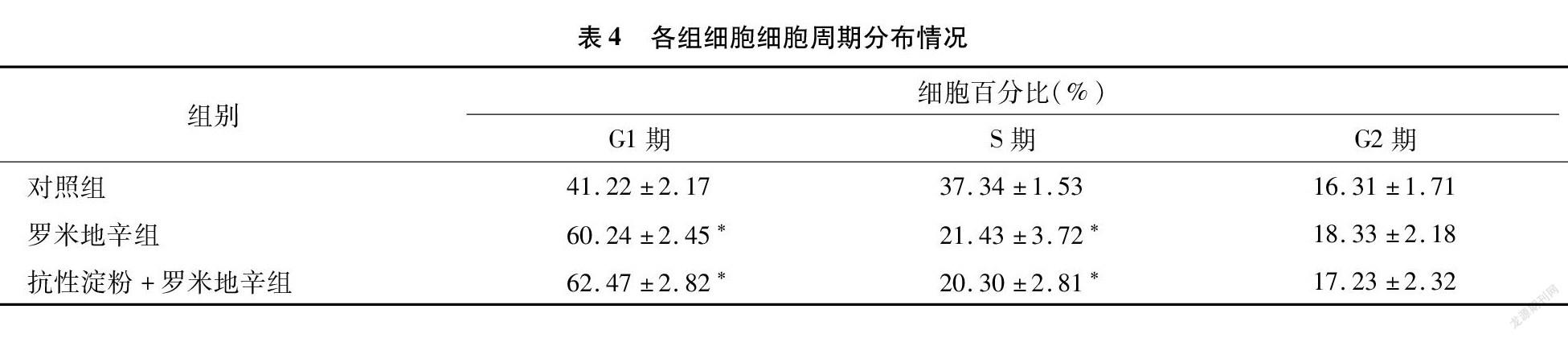
为了验证高粱抗性淀粉和罗米地辛是如何抑制SGC-7901增殖的,本试验通过流式细胞术检测了3组细胞的细胞周期。如表4所示,对照组中G1、S、G2期的细胞百分比分别为41.22%、37.34%、16.31%。罗米地辛组G1、S、 G2期的细胞百分比分别为60.24%、21.43%、18.33%,抗性淀粉+罗米地辛组G1、S、G2期的细胞百分比分别为62.47%、20.30%、17.23%。罗米地辛组和抗性淀粉+罗米地辛组的G1期细胞百分比有所上升(P<0.05);S期细胞百分比则有所降低(P<0.05),G2期细胞百分比略有上升,但不存在显著差异。通过本试验可以说明罗米地辛可以将SGC-7901细胞周期阻滞在G1期,而高粱抗性淀粉可以起到辅助作用。
2.4 各组细胞中STAT5A、cyclin-D1蛋白的表达比较
通过上述体内和体外试验,笔者所在课题组明确了罗米地辛对胃癌增殖具有抑制作用,高粱抗性淀粉可以增强罗米地辛的作用。为进一步明确罗米地辛在抑制胃癌增殖的过程中影响了哪些蛋白的表达,笔者所在课题组进行了蛋白表达量的检测。STAT5A是STATs家族中的一员,它在乳腺癌、肺癌、胃癌等多种肿瘤中的表达升高[20],能促进肿瘤增殖,其下游cyclin-D1同样对肿瘤增殖有促进作用[21]。通过Western Blot 试验检测3组细胞中STAT5A、cyclin-D1蛋白表达情况,如图3所示,罗米地辛组中STAT5A和cyclin-D1的表达均极显著低于对照(P<0.01),抗性淀粉+罗米地辛组中2种蛋白表达与对照组相比降低更为明显(P<0.01)。说明高粱抗性淀粉联合罗米地辛对胃癌增殖的抑制作用是通过调控STAT5A、cyclin-D1的表达而发挥的。
3 討论与结论
在肿瘤发病率日趋升高的今天,人们没有一刻停止对于肿瘤发生机制的探索,在我国胃癌作为一个恶性程度高、发病率高的肿瘤[22],更加受到各界关注。研究胃癌的发生机制、治疗药物以及辅助治疗药物对于临床开展胃癌治疗具有积极意义。
罗米地辛是2011年被美国食品药品监督管理局(FDA)批准上市的抗肿瘤药物,其对乳腺癌、前列腺癌、肝癌等多种肿瘤都有较好的抑制作用[23]。本研究通过检测给予罗米地辛前后裸鼠肿瘤增殖情况和SGC-7901细胞增殖及细胞周期变化验证了罗米地辛对胃癌增殖具有显著的抑制作用,此外还通过检测细胞中STAT5A、cyclin-D1蛋白的表达情况推断出罗米地辛抑制胃癌增殖可能与JAK2/STAT5信号通路相关。
高粱抗性淀粉是高粱中的有效成分,本研究通过体内试验证实饲料中添加高粱抗性淀粉组的裸鼠与添加其他高粱淀粉组相比,在接受罗米地辛治疗时肿瘤增殖速度降低更加明显,这说明高粱抗性淀粉在罗米地辛治疗胃癌时达到了辅助治疗目的。
综上所述,高粱抗性淀粉联合罗米地辛可以更好地达到治疗胃癌的目的,高粱抗性淀粉可以辅助治疗胃癌,这为高粱产品的深加工与产品开发开辟了新的思路,同时也提供了理论依据。
参考文献:
[1]陈永发,钟春梅,苏 芳,等. 高粱在人类食品中的应用[J]. 粮食加工,2013,38(4):49-54.
[2]陈 超,赵美华,陈月新. 验方治腹泻[J]. 中国民间疗法,2006,14(2):61.
[3]龙甫林. “十胃九病”,健脾养胃从饮食开始[J]. 烹调知识,2020(8):80.
[4]杜金娟. 甜高粱ACE抑制肽的制备及其特性研究[D]. 镇江:江苏科技大学,2013:1-89.
[5]Oh K K,Adnan M,Cho D H. Network pharmacology of bioactives from Sorghum bicolor with targets related to diabetes mellitus[J]. PLoS One,2020,15(12):e0240873.
[6]Ge Y F,Wei C H,Wang W H,et al. The resistant starch from Sorghum regulates lipid metabolism in menopausal rats via equol[J]. Journal of Food Biochemistry,2020,44(8):e13295.
[7]Wang Q Y,Wang P,Xiao Z G.Resistant starch prevents tumorigenesis of dimethylhydrazine-induced colon tumors via regulation of an ER stress-mediated mitochondrial apoptosis pathway[J]. International Journal of Molecular Medicine,2018:41(4):1887-1898.
[8]吴 琼,曹慧馨,王旭升,等. 响应面法优化超声波辅助提取高粱淀粉的研究[J]. 食品科技,2020,45(11):212-216,223.
[9]Nelson B,Cray N,Ai Y F,et al. Effect of dietary-resistant starch on inhibition of colonic preneoplasia and wnt signaling in azoxymethane-induced rodent models[J]. Nutrition and Cancer,2016,68(6):1052-1063.
[10]Trivieri N,Panebianco C,Villani A,et al. High levels of prebiotic resistant starch in diet modulate a specific pattern of miRNAs expression profile associated to a better overall survival in pancreatic cancer[J]. Biomolecules,2020,11(1):26.
[11]Sasidharan B K,Ramadass B,Viswanathan P N,et al. A phase 2 randomized controlled trial of oral resistant starch supplements in the prevention of acute radiation proctitis in patients treated for cervical cancer[J]. Journal of Cancer Research and Therapeutics,2019,15(6):1383-1391.
[12]Verbeke W. Functional foods:Consumer willingness to compromise on taste for health?[J]. Food Quality and Preference,2006,17(1/2):126-131.
[13]Zhou Y F,Zhou Y,Shingu T,et al. Metabolic alterations in highly tumorigenic glioblastoma cells:preference for hypoxia and high dependency on glycolysis[J]. The Journal of Biological Chemistry,2011,286(37):32843-32853.
[14]Dinda S,Sarkar S,Das P K. Glucose oxidase mediated targeted cancer-starving therapy by biotinylated self-assembled vesicles[J]. Chemical Communications,2018,54(71):9929-9932.
[15]Ferlay J,Parkin D M,Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe in 2008[J]. European Journal of Cancer,2010,46(4):765-781.
[16]魏秋紅,刘晓月,王 盼,等. 抗肿瘤药物的分类和药效学研究进展[J]. 医学综述,2020,26(18):3707-3711,3716.
[17]Sun W J,Huang H,He B,et al. Romidepsin induces G2/M phase arrest via Erk/cdc25C/cdc2/cyclinB pathway and apoptosis induction through JNK/c-Jun/caspase3 pathway in hepatocellular carcinoma cells[J]. Biochemical Pharmacology,2017,127:90-100.
[18]董吉林,林 娟,申瑞玲,等. 高粱淀粉及抗性淀粉对高脂饮食诱导大鼠体脂分布研究[J]. 粮食与油脂,2013,26(10):14-17.
[19]Panebianco C,Adamberg K,Adamberg S,et al. Engineered resistant-starch (ERS) diet shapes colon microbiota profile in parallel with the retardation of tumor growth in in vitro and in vivo pancreatic cancer models[J]. Nutrients,2017,9(4):331.
[20]Wagner K U,Rui H. Jak2/Stat5 signaling in mammogenesis,breast cancer initiation and progression[J]. Journal of Mammary Gland Biology and Neoplasia,2008,13(1):93-103.
[21]Li Z L,Shao S H,Xie S Y,et al. Anti-sense nucleic acid of CyclinD1 induces apoptosis of lung adenocarcinoma cancer cell A549[J]. Sheng Li Xue Bao,2011,63(3):261-266.
[22]Li Y L,Yang T S,Ruan W M,et al. Effect of trichostatin a on SGC-7901 gastric cancer cells[J]. International Journal of Clinical and Experimental Medicine,2014,7(8):1958-1966.
[23]Ren J A,Zhang J,Cai H,et al. HDAC as a therapeutic target for treatment of endometrial cancers[J]. Current Pharmaceutical Design,2014,20(11):1847-1856.

