雅鲁藏布江下游沿岸湿地建群种植物根际土壤细菌群落结构和多样性特征
陈海生,刘守平,杨万勤,梁国钱
1 浙江同济科技职业学院,杭州 311231
2 浙江省台州市农业科学研究院,临海 317000
3 台州学院生命科学学院,椒江 318000
高寒生态系统是在高寒环境下的土壤、植物群落、微生物群落及其水热变化过程等,以及在该环境下形成的协同发展的生态系统[1]。高寒生态系统主要分布在高纬度或高海拔、气候寒冷、冻土分布广泛的地区。微生物是生物地球化学循环的主要驱动者,微生物群落的组成及其变化影响着生态系统的功能和稳定性。高寒生态系统是全球气候变化的敏感区域,其微生物群落结构和多样性在很大程度上影响着生态系统的转化方向[2—3]。目前,关于高寒地带的微生物群落结构及多样性的研究已成为国内外生态学上研究的热点[4—10]。Wilhelm 等[11]曾研究了加拿大高北极地融冰层和冻土层土壤细菌群落结构,发现融冰层中细菌群落以酸杆菌门的相对丰度为最高,其值为30%,冻土层中细菌群落以放线菌门的相对丰度为最高,其值为 28%。康宝天等[12]采用 Illumina Miseq 高通量测序方法,比较了祁连山东缘高寒草甸和河西走廊荒漠平原土壤细菌多样性和群落组成,发现高寒草甸和荒漠平原土壤细菌多样性和群落组成差异明显,土壤总碳、总氮、pH、有机酸、含水量、容重等是影响两种草地类型土壤细菌菌群分布的重要因素。李海云等[13]研究了东祁连山不同退化程度高寒草地土壤细菌群落分布与环境因子间的相互关系,发现放线菌门、变形菌门和厚壁菌门是不同退化程度草地土壤中的优势菌门,它们的相对丰度与土壤 pH、电导率、速效氮、速效钾呈显著相关(P<0.05)。
青藏高原是全球海拔最高、面积最大和独特的高原高寒生态系统,储存着大量的有机质,在全球碳平衡、全球气候变化中起着重要的作用[14]。该地许多方面具有“极地”的属性,其气候特点是高寒、缺氧、日照时间长、辐射强、降水少,这些气候因子相互作用形成了青藏高原独特的土壤微生物资源。Yuan 等[15]研究了青藏高原念青唐古拉山南坡海拔 4400—5200 m 的高寒草地土壤细菌群落结构特征,发现细菌酸杆菌门和变形菌门是该地域的主要菌门,降水量是影响不同海拔高度土壤细菌分布的最主要环境因素。Cui 等[3]采用高通量测序技术研究了青藏高原东部边缘的贡嘎山冷杉林根际土壤与非根际土壤细菌群落结构和 Alpha 多样性沿海拔高度的变化情况,发现随着海拔高度的变化,土壤细菌群落结构和 Alpha 多样性也发生了显著变化,但冷杉根际与非根际间土壤细菌群落结构和 Alpha 多样性差异并不显著,土壤总磷、有机碳、NH4-N 含量是决定土壤细菌群落结构和Alpha 多样性的主要因子。曾见有关于雅鲁藏布江支流尼洋河沉积物中细菌群落结构的报道[16],认为尼洋河水体中总氮、总磷、溶解氧、铬、锶、钡和锰是尼洋河沉积物中细菌群落结构的主要影响因子。但关于雅鲁藏布江下游沿岸建群种植物根际土壤细菌群落结构和多样性的研究还未见报道。
土壤微生物的群落结构和组成影响土壤的生物活性[17—18]。土壤微生物物种多样性较高的土壤生态系统稳定性也较高,在不良环境胁迫条件下,其逆境适应性和生态系统恢复能力也强[19—21]。高寒湿地中自然分布着一些对当地自然气候和土壤环境有着强适应能力的野生乡土植物。这些植物在生态系统生物多样性保护和生态系统恢复方面起着重要作用。但是,植物种类的不同,或同一植物生长发育阶段的不同,其根系所分泌的次生代谢产物也不同,对土壤微生物群落产生了选择性效应,因此,不同植物根际土壤微生物群落结构和多样性存在差异,从而导致高寒湿地脆弱生态系统逆境适应能力与恢复能力产生差异[22—23]。雅鲁藏布江是西藏最大的河流,是西藏重要淡水来源和水气通道,也是全球海拔最高的河流之一[24—25],属于典型的高寒生态系统。本研究拟在雅鲁藏布江大峡谷沿岸选取艾草ArtemisiaargyiH. Lév. & Vaniot、白刺花Sophoradavidii(Franch)、黄刺玫RosaxanthinaLindl、八宝Hylotelephiumerythrostictum(Miq.)H. Ohba 4 种高寒生境中典型植物作为研究对象,采用 Miseq 2500 高通量测序方法[26—27],探索雅鲁藏布江大峡谷沿岸不同植被根际土壤细菌群落结构和多样性的差异及其变化规律,为实现青藏高原高寒湿地生态系统植被恢复和生态系统的可持续发展提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于青藏高原的东南部,即西藏自治区林芝市境内的米林县直白村,北纬 29°33′55″、东经 94°54′0″,海拔 3090 m,气压 71 kPa,系念青唐古拉山向南延伸的余脉,与喜马拉雅山东部向北发展的山系相连,以居南迦巴瓦峰脚下和处于雅鲁藏布江大峡谷咽喉而闻名。研究区处于藏东南温暖气候区与半湿润气候区的过渡地带,受印度洋暖湿季风影响,冬春干燥,夏秋多雨。年降水量 600—1000 mm,年平均气温 8—10℃,≥0℃积温为 3000—3500℃,≥10℃的时间约 180 d[28]。土壤为新积土和风沙土,成土时间短,质地粗,结构和保水保肥能力差,土壤瘠薄。山南宽谷植被基本上属于山地灌丛草原同一植被型[29]。
1.2 样品采集
选取雅鲁藏布江下游林芝地区沿江岸 4 种典型建群种植物根际土壤为研究对象,即菊科蒿属艾草、豆科槐属白刺花、景天科八宝属八宝、蔷薇科蔷薇属黄刺玫。以 HE 代表八宝根际土壤,AR 代表艾草根际土壤,SD 代表黄刺玫根际土壤,RN 代表白刺花根际土壤。于 2019年 5 月在样点采集土壤样品。每种植物设置 3 个 10 m × 10 m 的标准地,每标准地选取 10 株代表性植株,在植株周围东、南、西、北设 4 个取样点,在土壤表层 0—20 cm 处采集直径少于 0.1 cm 的各植株细根,用抖落法[30]收集粘附在细根上的土壤作为植物根际土壤样品,取样过程中去除凋落物等杂质,将每个样地的各土壤样品混合均匀,用直径 2 mm 的网筛进行过筛。取 20 g 土样装入无菌聚乙烯封口袋中,放入冰盒中低温保存带回实验室。在实验室将样品分成二份,一份取 10 g 置于 4℃ 冰箱中,用于测定土壤的理化性质;另一份取 10 g 用干冰进行 -70℃ 低温保存,用于高通量测序。
1.3 植物根际土壤的理化性质测定
将采集后的土壤样品风干,并过 0.25 mm 的网筛,然后进行土壤理化性质的测定。土壤总氮(TN)含量测定采用凯氏定氮法,土壤有效磷(AP)含量测定采用 NaHCO3—钼锑抗比色法,土壤速效钾(AK)含量测定采用 NH4OAc 浸提—火焰光度法,土壤有机质含量(SOM)含量测定采用重铬酸钾容量法—外加热法,用环刀法测定土壤含水量[30],土壤 pH 值测定采用 1∶2.5 土水比、酸度计法[32]。
1.4 土壤细菌基因组 DNA 提取
准确称取 0.1 g 土样,采用 E.Z.N.A.Soil DNA Kit 试剂盒(D5625,Omega,Inc.,USA),提取土样的总 DNA。经 1% 琼脂糖凝胶电泳检测 DNA 提取质量,同时采用紫外分光光度计 Nano Drop ND- 1000 (Nano Drop,Wilmington,DE,USA)对 DNA 进行定量测定。各样品的 5 份 DNA 样品随机取 3 份等量混均,分别制成 3 个平行样品,于 -20℃ 保存、备用。
1.5 PCR 扩增及高通量测序
参考 Caporaso 等[33]的方法,通过细菌 16S rDNA V3-V4 区段引物来扩增各样品,使用上下引物分别为 341F (5′-CCTACGGGNGGCWGCAG- 3′)和805R (5′-GACTACHVGGGTATCTAATCC- 3′),对 16S rDNA 基因的(V3-V4)进行 PCR 扩增。DNA 扩增的反应条件:为 35 个循环(98℃,30S;98℃,10S;54℃,30S;72℃,45S),72℃ 延伸扩增 10 min。PCR 产物经 2% 琼脂糖凝胶电泳确证。在整个 DNA 提取过程中,使用的是超纯水,而不是样品溶液,以排除假阳性 PCR 结果作为阴性对照的可能性。PCR 产物经 AMPure XT beads (Beckman Coulter Genomics,Danvers,MA,USA)纯化,经 Qubit(Invitrogen,USA)定量。扩增子池用于测序,扩增子文库的大小和数量分别在 Agilent 2100 生物分析仪(Agilent,美国)和 Illumina (Kapa Biosciences,Woburn,MA,美国)的文库定量试剂盒上进行评估。在 NovaSeq PE 250 平台上对库进行排序。
1.6 生信分析流程
各样品在 Illumina NovaSeq 平台上按照制造商的建议进行测序,由 LC-Bio 提供。根据样品独特的条形码,将配对端序列分配给样品,并将建库引入的 barcode 和引物序列去除。使用 FLASH 合并匹配端读取。根据 fqtrim(v0.94),在特定的过滤条件下对原始读数据进行质量过滤,以获得高质量的 clean 标签。使用 Vsearch 软件对嵌合序列进行过滤(v2.3.4)。利用 DADA2 进行解调,得到特征表和特征序列。Alpha 多样性通过归一化到相同的随机序列来计算。然后根据 SILVA(release 132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。Alpha 多样性用于分析样本物种多样性的复杂性,通过 5 个指标,包括Chao1、Observed species、Goods coverage、Shannon、Simpson,各样本中所有这些指标均采用 QIIME2 计算。采用 Blast 进行序列比对,每个代表性序列用 SILVA 数据库对特征序列进行注释。其它图片均是使用 R 包(v3.2.5)实现。
2 结果与分析
2.1 4 种江岸植物根际土壤细菌Alpha 多样性分析
经 Miseq 测序所得样品数据经质控后,获得了不同分类水平上相应有效序列,不同植物根际土壤细菌有效序列数量以黄刺玫为最高,为 50224 条,其次是艾草,有效序列数是 50029 条,以白刺花为最低,只有 40031 条。经质控和去除嵌合体后,以相似性在 97% 以上的有效序列视为一个 OTUs,从而得到各植物根际土壤样品中关于 OTUs 的丰度信息。如表 1 所示,从 4 种土壤样品中共分析出 4563—6695 个 OTUs,其中以艾草的 OTUs 数目最高(6695 个),其次是黄刺玫(6458 个),以白刺花的 OTUs 数目为最低(4563 个)。

表1 4 种江岸植物根际土壤样品基因组DNA 测序数据及Alpha 多样性
从4种植物根际土壤样品中一共分析出 13238 个 OTUs 数目,其中 4 种植物根际土壤共有 OTUs 数为 661 个,占 OTUs 总数的 4.99%,如图 1。艾草根际土壤细菌特有 OTUs 数为 1646 个,占 OTUs 总数的 12.43%;八宝根际土壤细菌特有 OTUs 数为 1352 个,占 OTUs 总数的 10.21%;白刺花根际土壤细菌特有 OTUs 数为 1542 个,占 OTUs 总数的 11.65%;黄刺玫根际土壤细菌特有 OTUs 数为 1858 个,占 OTUs 总数的 14.04%。

图1 基于操作分类单元丰度的4种植物根际土壤细菌群落维恩图
对稀释曲线分析可以反映样品的取样深度,能够评价测序量是否能覆盖所有类群。从图2 可以看出,4 种样品稀释曲线均趋于平缓,文库的覆盖率均已超过 93%,说明取样基本合理,样本的 OTU 覆盖度已经饱和,本次测序深度可以反映雅鲁藏布江下游林芝地区沿江岸植被根际土壤细菌群落的真实情况。

图2 4 种植物根际土壤样品细菌群落的稀释曲线
表 1 还表明,不同植物其根际土壤细菌物种丰富度指数(Chao1 指数)和多样性指数(Shannon 指数)也明显不同。四种植物中,黄刺玫和八宝根际土壤样品细菌 Shannon 指数分别是 10.801 和 10.726,显著高于艾草和白刺花的 10.221 和 10.052(P<0.05)。而黄刺玫和八宝根际土壤样品之间,以及艾草和白刺花根际土壤样品之间其值差异并不显著(P>0.05)。四种植物中,黄刺玫和艾草根际土壤细菌 Chao1 指数均较高,其值分别为 7691.801 和 8000.021,显著高于其它两种植物(P<0.05)。而白刺花根际土壤细菌 Chao1 指数最低,其值为 5113.664,显著低于其它三种植物(P<0.05)。
2.2 4 种江岸植物根际土壤细菌的群落结构组成
通过对测序结果的物种注释,从 4 种植物根际土壤样品中共获得 28 门、84 纲、156目、262 科、599 属、1192 种土壤细菌。变形菌门(Proteobacteria,31.79%—49.02%)、酸杆菌门(Acidobacteria,16.52%—27.33%)及放线菌门(Actinobacteria,9.12%—24.96%)是雅鲁藏布江江岸植物根际土壤中的优势菌群,相对丰度较高。其次高为拟杆菌门(Bacteroidetes,4.53%—11.30%)、芽单胞菌门(Gemmatimonadetes,4.61%—10.53%)、疣微菌门(Verrucomicrobia,1.58%—5.35%)。在该区域发现未分类的细菌门的相对丰度为2.27%—3.27%。
在该区域植物根际土壤中相对丰度较低的细菌门有单糖菌门(Saccharibacteria,0.67%—1.46%)、绿湾菌门(Chloroflexia,0.65%—1.21%)、浮霉状菌门(Planctornyces,2.06%—0.87%)、硝化螺旋菌门(Nitrospira,0.18%—0.72%)、厚壁菌门(Firmicutes,0.24%—0.84%)、装甲菌门(Armatimonadetes,0.08%—0.27%)。
不同土壤样品中细菌群落相对丰度不同,说明各土壤样品间的细菌群落结构存在着差异。从分析结果来看,各植物根际土壤样品中变形菌门细菌的相对丰度最多的是艾草(49.02%),其次是黄刺玫(44.08%),相对丰度最低的是白刺花(31.79%)。在各植物根际土壤样品中细菌酸杆菌门相对丰度最高的是八宝(27.33%),其次是黄刺玫(18.53%),相对丰度最低的为艾草(16.52%)。在各植物根际土壤样品中细菌放线菌门相对丰度最高的为白刺花(24.96%),其次是八宝(11.70%),相对丰度最低的是艾草(9.12%)。
微生物结构热图可以反映不同样品间物种的组成和差异(图 4)。由图 4 可以看出,在门水平上,4 种植物根际土壤样品中细菌的群落结构组成表现为黄刺玫和艾草相似,而八宝和另外三种植物相差较大。
从纲水平上来看(图 5),在 4 种植物根际土壤样品中 α-变形菌纲(Alphaproteobacteria,21.44%—37.77%)均为优势类群,其中艾草根际土壤样品 α-变形菌纲相对丰度最高(37.77%),其次是黄刺玫根际土壤样品,其 α-变形菌纲相对丰度值为 26.23%,而以八宝和白刺花根际土壤样品细菌 α-变形菌纲的相对丰度较低,其值分别为 21.85% 和 21.44%。在 4 种植物根际土壤样品中放线菌纲(Actinobacteria)的相对丰度略少于 α-变形菌纲(8.29%—23.50%),其相对丰度值依次是白刺花>八宝>黄刺玫>艾草。其它菌纲的相对丰度从高到低依次为酸杆菌纲 Acidobacteria(5.59%—6.91%)、芽单胞菌纲 Gemmatimonadetes(4.60%—10.02%)、鞘脂杆菌纲 Sphingobacteria(3.68%—9.91%)。此外,还发现未分类的细菌纲(2.26%—3.27%)。

图3 门水平 4 种植物根际土壤样品中细菌群落结构
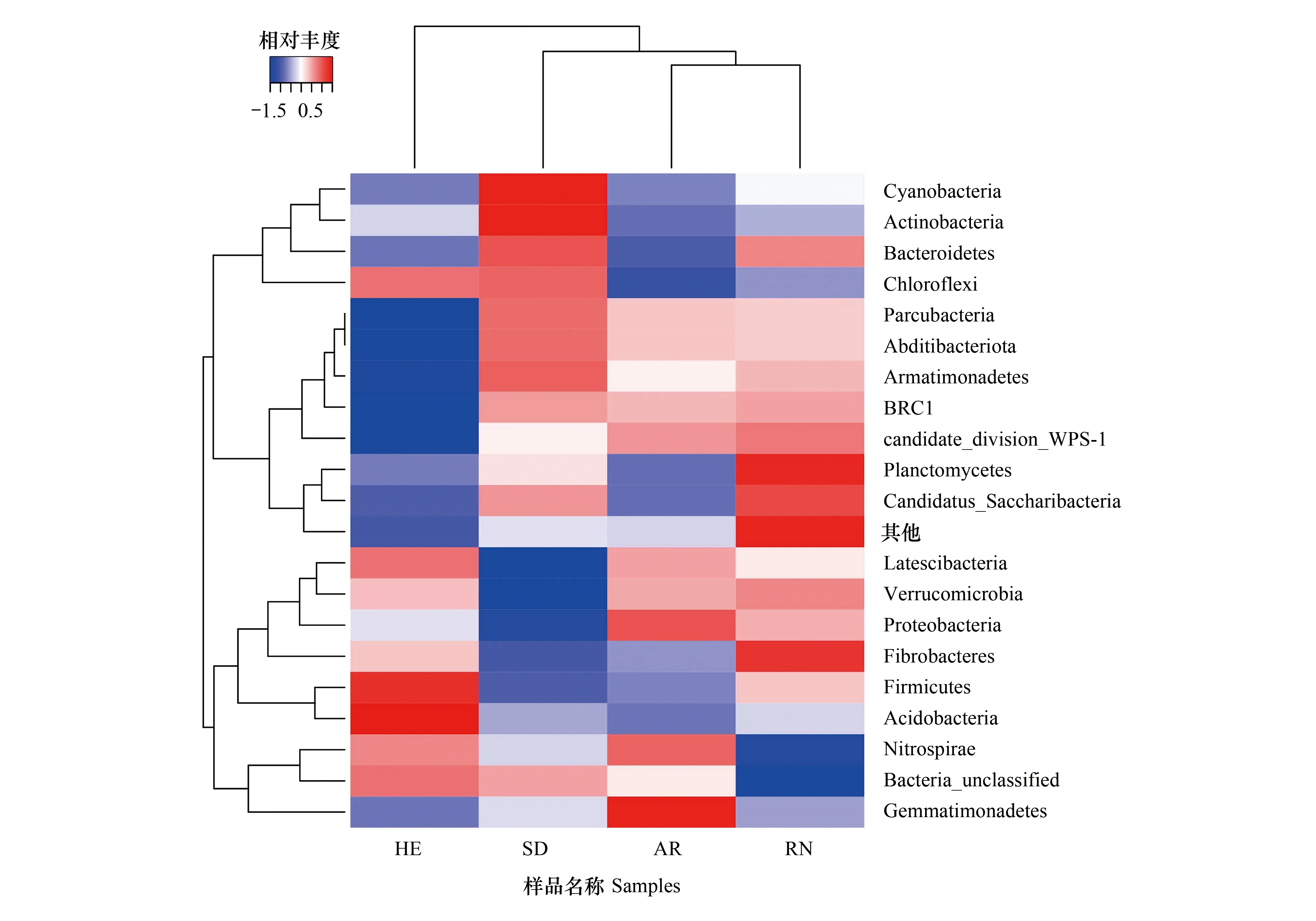
图4 门水平上4种植物根际土壤细菌群落结构聚类热图
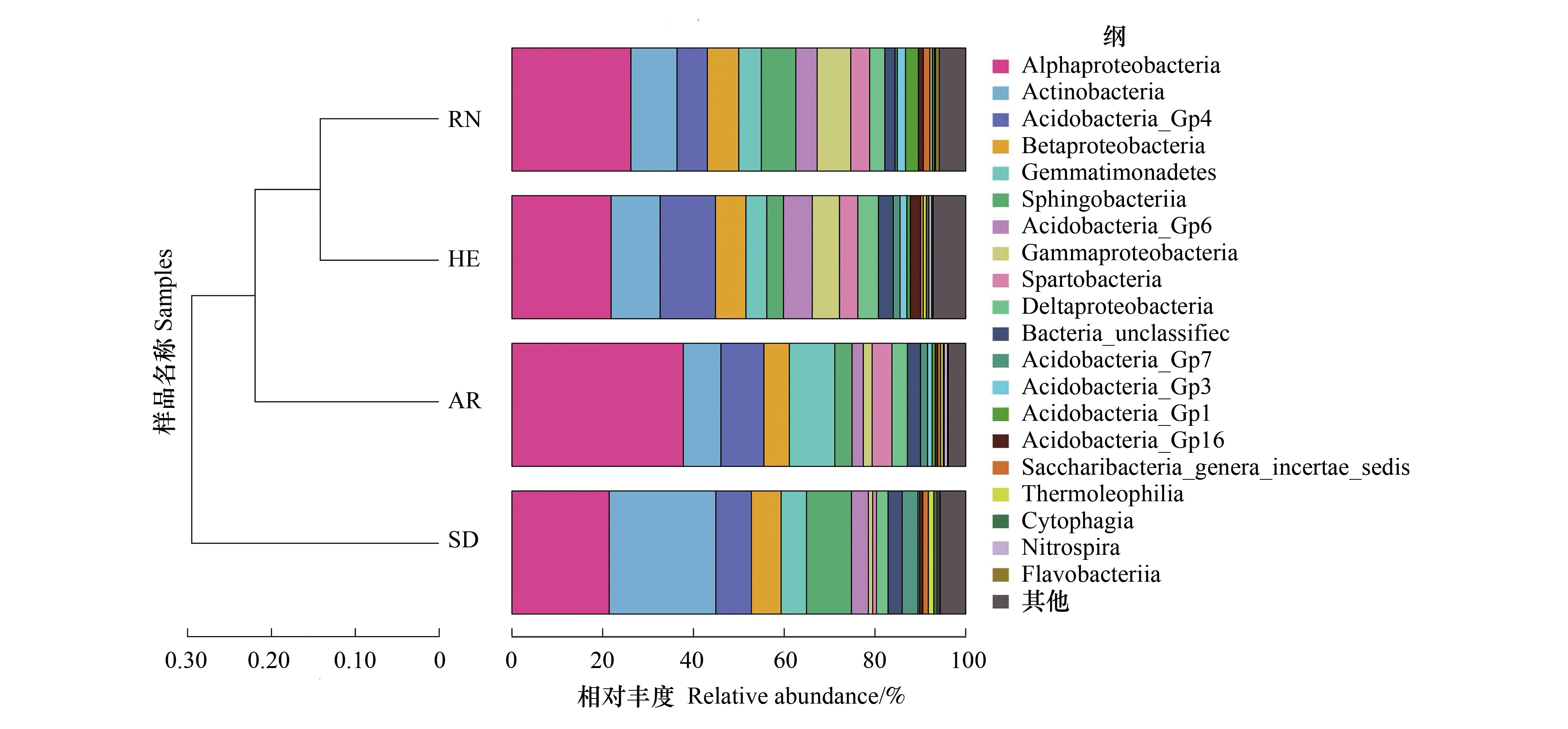
图5 在纲水平上4种植物根际土壤细菌群落结构
2.3 土壤理化性状对根际土壤细菌多样性指数及群落结构的影响
在一个自然生态系统中,土壤理化性状决定着其地表植物的种类和分布[34],相应地也决定着其植物根际土壤微生物多样性与群落结构。通过对雅鲁藏布江下游江岸建群种植物根际土壤细菌 Shannon 和土壤理化性状的相关性分析(表2),发现土壤总氮、速效钾、有机质和土壤含水量与土壤细菌 Shannon 的相关性均达极显著水平(P<0.01)。土壤 pH 与土壤细菌 Shannon的相关性达显著水平(P<0.05)。通过对建群种植物根际土壤细菌 Chao1 和土壤理化性状的相关性分析,发现土壤总氮、速效钾、有机质和土壤细菌 Chao1 间的相关性均达显著水平(P<0.05)。
通过对雅鲁藏布江下游江岸建群种植物根际土壤细菌群落结构与土壤理化性状的相关性分析(表 2),发现土壤 pH、总氮和有机质含量对建群种植物根际土壤主要优势细菌的影响较大,各土壤理化性状对各建群植物根际土壤细菌优势门的影响顺序为 TN﹥pH﹥O·M。土壤中 TN 含量与土壤细菌酸杆菌门、芽单胞菌门、疣微菌门的相对丰度呈极显著正相关(P<0.01),与土壤细菌放线菌门、拟杆菌门的相对丰度呈极显著负相关(P<0.01)。土壤 pH 与土壤细菌酸杆菌门、疣微菌门的相对丰度呈极显著负相关(P<0.01),与芽单胞菌门的相对丰度呈显著负相关(P<0.01),与变形菌门和放线菌门的相对丰度呈极显著正相关(P<0.01)。土壤有机质含量与土壤细菌变形菌门、放线菌门、拟杆菌门的相对丰度呈显著负相关(P<0.05),与酸杆菌门、芽单胞菌门和疣微菌门的相对丰度呈显著正相关(P<0.05)。土壤含水量与放线菌门的相对丰度呈显著正相关(P<0.05),与疣微菌门的相对丰度呈极显著负相关(P<0.05)。

表2 雅鲁藏布江下游江岸建群种植物根际土壤细菌门水平群落结构与土壤理化性状相关性
3 讨论
3.1 雅鲁藏布江下游江岸植被根际土壤细菌的优势菌门
青藏高原是我国高原湿地的最重要分布区,是全球海拔最高的一个高寒生态系统,独特的地理环境使它成为了全球气候变化的预警区和敏感区,其境内湿地是我国长江、黄河和澜沧江等的发源地,具有重要的水源涵养、水土保持和气候调节等生态功能。土壤微生物在维持生态系统植被多样性和促进生态平衡中产生着重要作用,土壤微生物各组成部分的相对丰度是定量诠释生态系统的基础[12]。研究雅鲁藏布江流域植物根际土壤细菌群落结构和多样性,对恢复和保护我国重要的生态屏障青藏高原具有意义。本研究结果表明,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是雅鲁藏布江江岸湿地建群种植物根际土壤的优势菌门。这与高秀宏等[35]在呼和浩特市大青山白桦根际土壤上测定的结果,以及刘兴等[36]在研究贵州喀斯特高原地区土壤细菌群落结构特征所得出的结果是一致的。生态系统不同、气候条件不同、土壤类型和植物种类不同,均可使植物根际土壤细菌群落组成表现不同,既存在相似的细菌群落组成,也存在各自优势类群[37—41]。如 Chu 等[42]研究发现,西藏高原西部表层土壤细菌群落的优势类群是放线菌门、变形菌门、酸杆菌门、绿湾菌门及芽单胞菌门。Yuan 等[15]研究认为,酸杆菌门、变形菌门、芽单胞菌门是唐古拉山南面高山草原土壤细菌群落的优势类群。朱平等[43]在研究祁连山中部 4 种典型植被类型土壤细菌群落结构与多样性时,发现放线菌门、酸杆菌门、变形菌门、厚壁菌门及芽单胞菌门是该区域的优势类群。Zhang 等[44]研究认为变形菌门、放线菌门、酸杆菌门、拟杆菌门是青藏高原北麓河流域草甸、草原和荒漠草原土壤细菌群落的优势类群。
3.2 雅鲁藏布江下游江岸不同植被根际土壤细菌群落的变化特征
在雅鲁藏布江江岸植物根际土壤中,变形菌门是最主要的细菌门类,且以 α-变形菌纲丰度最高,这与很多地区的研究结果相一致[35—36]。变形菌门细菌是土壤环境中的一大类细菌菌落,其中部分变形菌门细菌能够利用有机物分解产生的氨气、甲烷等营养物质进行生长代谢活动[45]。本研究发现雅鲁藏布江江岸菊科植物艾草的根际土壤细菌变形菌门相对丰度最高,说明这4种植物中该植物根系分解利用枯枝落叶有机物的能力最强,其次是蔷薇科植物黄刺玫根际土壤细菌变形菌门的相对丰度,而豆科植物白刺花根际土壤细菌变形菌门的相对丰度最低。
酸杆菌门细菌通常存在于贫瘠的土壤,在肥力低下的根际土壤细菌酸杆菌门丰度值较低[35]。本研究发现景天科植物八宝根际土壤细菌酸杆菌门的相对丰度较高,而豆科植物白刺花根际土壤细菌酸杆菌门的相对丰度最低,这是因为八宝植物通常生长在干旱、贫瘠的土壤上,而豆科植物白刺花根系上的根瘤菌能够进行固氮作用而提高了其根际土壤肥力。另外二种植物即蔷薇科植物黄刺玫和菊科植物艾草的根际土壤细菌酸杆菌门相对丰度值在白刺花和八宝根际土壤样品之间。放线菌门细菌能够分解动植物残体中的纤维素和几丁质,可以将它们转变成植物容易吸收的营养物质[36]。在雅鲁藏布江沿岸干旱、涝渍频繁发生和强盐碱性土壤条件下,放线菌门是居于第三位的优势菌群,其相对丰度以豆科植物白刺花根际土壤样品为最高,以菊科植物艾草根际土壤样品为最低,而黄刺玫和八宝的根际土壤样品的相对丰度则介于这二者之间。
本研究还发现雅鲁藏布江江岸 4 种植物根际土壤细菌共有的 OTUs 数占 OTUs 总数的比率只有 4.99%。而各植物根际土壤样品特有的 OTUs 数占总 OTUs 数的比例则达到 10.21%—14.04%,这是因为雅鲁藏布江江岸植物生长的土壤,大多是新积土和风沙土,成土时间短,质地粗,结构和保水保肥能力差。这些土壤在枯水季节暴露在水面之上,经寒冰、日晒,以及因风力作用而发生搬迁[46]。总之,由于雅鲁藏布江江岸土壤的成土时间短,再加上风力的搬迁作用,就造成了各植被根际土壤细菌共有的 OTUs 比率较低,而各样本特有的 OTUs 比率较高的现象。
3.3 雅鲁藏布江江岸植被根际土壤芽单胞菌门和酸杆菌门细菌丰度较高
雅鲁藏布江江岸植被根际土壤细菌的芽单胞菌门相对丰度较高,为 4.61%—10.13%,其中艾草根际土壤细菌中芽单胞菌门相对丰度达到 10.13%,这是因为芽单胞菌门与其它类群细菌相比更适应在土壤含水率比较低的土壤中生长,且该细菌很难在酸性土壤中被检测得到。芽单胞菌门细菌具有耐盐或嗜盐的特性,适宜在盐分比较高的土壤中生长和繁殖。祁连山中部山区植被根际土壤芽单胞菌门的平均相对丰度达到 6.12%[43],在黄河三角洲人工林根际土壤中相对丰度也只有 4.74%—5.67%[17],而黄河三角洲地区农田土壤盐碱化程度是我国较为严重的地区之一。雅鲁藏布江地处青藏高原,江岸土壤电导率和含盐量均高,因此,导致土壤中芽单胞菌门的相对丰度较高。艾草是典型的耐干旱耐盐碱植物,在本研究中其根际土壤芽单胞菌门细菌相对丰度达到 10.13%,这与其它干旱高盐分地区的研究结果相一致[17,43]。
酸杆菌门细菌具有丰富的编码纤维素酶和半纤维素酶基因,在对植物残体降解中起到重要作用。在寒冷的微氧或缺氧的高海拔地区,当其它纤维素降解菌难以生存时,酸杆菌门细菌仍能对纤维素降解起重要作用[47]。另外,有研究认为酸杆菌门多存在于肥力低下、营养贫瘠的土壤中[47]。本研究区 4 种植物根际土壤细菌群落中酸杆菌门的相对丰度(6.52%—27.33%)较高,仅次于变形菌门。李海东等[24]研究表明,雅鲁藏布江沿岸风沙土土壤碱性较强,土壤有机质和全氮含量很低。因此本文从土壤细菌酸杆菌门菌群相对丰度水平上也反映出雅鲁藏布江大峡谷流域气候干旱、土壤养分贫瘠的特点。
3.4 雅鲁藏布江江岸植被根际土壤细菌群落与土壤理化性状的关系
植物根际土壤理化因子在很大程度上影响着土壤细菌群落结构[48]。刘兴等[36]采用 Illumina 高通量测序方法分析了贵州喀斯特不同植被演替群落下的土壤细菌群落结构及变化特征,认为影响贵州喀斯特高原土壤细菌的主要土壤理化性状有土壤有机碳和土壤总氮。刘海燕等[49]采用 Illumina 高通量测序的方法对新疆塔里木河中下游流域棉田及胡杨林土壤细菌群落结构及多样性特征进行了研究,结果表明,土壤全氮、盐分、有机质和土壤 pH 是驱动细菌群落变异的主要因子。高秀宏等[35]采用高通量测序技术对呼和浩特市大青山天然次生林生态系统演变过程中先锋树种白桦的根际土壤细菌群落结构进行了研究,结果表明,土壤全氮、土壤 pH 和含水量是白桦根际土壤优势细菌的主要影响因子。朱平等[43]采用了 Illumina 高通量测序的方法研究了祁连山中部垫状植被、高寒植被、沼泽草甸和高寒灌丛这 4 种典型植被群落表层土壤的细菌群落结构差异,认为土壤 pH、土壤含水量、土壤有机碳和总氮是影响土壤细菌群落结构的主要因子。本研究采用同样的 Illumina 高通量测序方法分析了雅鲁藏布江下游沿岸建群种植物根际土壤细菌群落结构及与土壤理化性质的关系,发现土壤 pH、土壤含水量、土壤有机质和总氮含量是影响建群种植物根际土壤优势细菌的主要因素。本研究结果与高秀宏等[35]和朱平等[43]的研究结果基本一致。
4 结论
高寒生态系统中土壤微生物多样性对于维持整个生态系统的生态平衡起着重要作用。本文采用 Illumina 的方法对雅鲁藏布江沿岸 4 种建群种植物根际土壤细菌群落结构及多样性进行了研究,共获得 28 门、84 纲、156 目、262 科及 599 属细菌,发现变形菌门、酸杆菌门、放线菌门是雅鲁藏布江江岸植物根际土壤的优势菌群。在细菌门水平上,4 种植物根际土壤细菌的群落结构组成表现为黄刺玫和艾草相似,而八宝和另外3种植物相差较大。不同植物其根际土壤细菌物种丰富度指数和多样性指数也明显不同。土壤细菌 OTUs 数和 Chao1 均以艾草根际土壤样品为最高,而以白刺花根际土壤样品为最低。细菌多样性指数以黄刺玫根际土壤样品为最高,而以白刺花根际土壤样品为最低。雅鲁藏布江江岸植被根际土壤细菌物种组成丰富,本文的4种典型植物根际土壤细菌在门水平和纲水平上结构相似,但部分细菌相对丰度差异明显。各植物根际土壤细菌共有的 OTUs 比率较低,而各植物特有的 OTUs 比率则较高,反映了该区域土壤大多是新积土和风沙土,成土时间短的特点。高寒地区土壤大多缺氧、贫瘠、盐碱性较强,造成了该区域植被根际土壤细菌酸杆菌门和芽单胞菌门群落相对丰度较高的现象。雅鲁藏布江江岸 4 种建群种植物中,艾草根际土壤细菌变形菌门相对丰度最高,说明这 4 种植物中该植物根系分解利用枯枝落叶等有机物的能力最强。土壤 pH、土壤含水量、土壤有机质和总氮含量是影响建群种植物根际土壤优势细菌的主要因素,这为预测微生物对环境变化的响应提供了基础。

