SPIB对食管癌增殖及上皮间质转化的影响
方汉林,黄云龙,张仁泉
食管癌是全球最常见的恶性肿瘤之一。据报道[1],2020年全球食管癌新发病例数60.4万,死亡数达到54.4万。我国食管癌的发病率居第5位,病死率居第4位[2]。目前,手术治疗联合辅助放化疗仍是食管癌的有效治疗手段。但是,食管癌的5年存活率仍较低,约为30%~40%[3]。其中,约90%的食管癌为鳞状细胞癌[3]。鳞状细胞癌是一种高度转移性生长和侵袭的上皮细胞恶性肿瘤。然而,关于食管癌的发生和转移的分子学机制尚不清楚。SPIB是Ets家族转录因子的成员,位于19q染色体上,其在成熟B细胞向浆细胞分化和浆细胞样树突状细胞分化中发挥重要作用[4-5]。研究表明,在肝细胞癌[6]、B细胞淋巴瘤[7]和非小细胞肺癌[8-10]中,SPIB是重要的预后因子,高表达SPIB患者的生存预后较差。SPIB通过调控SNAP47蛋白表达,进一步介导非小细胞肺癌的自噬过程[9]。Zhao et al[11]研究表明,与癌旁组织比较,食管癌中SPIB呈现高表达水平。然而,关于SPIB调控食管癌细胞增殖和转移的作用机制尚未见报道。因此,该研究旨在通过体外实验阐明SPIB对食管癌增殖及上皮间质转化的作用机制。
1 材料与方法
1.1 主要试剂与仪器食管癌细胞(KYSE150、KYSE450、KYSE30)和食管正常上皮细胞(Het-1a)均购自中国科学院细胞库;敲低组siSPIB-1/2 和对照组(siNC)购自上海生工生物有限公司;pCDH-SPIB及空载体购自北京擎科生物科技有限公司;RIPA裂解液、BCA蛋白检测试剂盒、CCK-8试剂盒购自上海碧云天生物技术有限公司;GAPDH抗体、辣根过氧化物酶标记山羊抗鼠二抗购自北京中杉金桥公司;SPIB抗体购自武汉爱博泰克生物科技有限公司;CytoFLEX流式细胞仪购自美国贝克曼公司。
1.2 方法
1.2.1细胞培养 食管癌细胞(KYSE150、KYSE450、KYSE30)和食管正常上皮细胞(Het-1a)采用含10%胎牛血清的RPMI-1640培养基进行培养,培养条件为:37 ℃、5% CO2。
1.2.2siRNA和质粒转染 在6孔板中接种KYSE150细胞,待细胞生长至约80%,进行siRNA(或质粒)转染:将50 pmol siRNA(或2.5 μg质粒)和5 μl lipofectamine 2000 分别加入到2支含50 μl Opti-MEM 培养基的离心管中进行混匀,并将siRNA(或质粒)液体加入到转染试剂中混匀。室温放置5 min后,将上述混合液均匀加入到每个培养孔内。通过加入嘌呤霉素(2 μg/ml)筛选,构建稳定过表达SPIB的食管癌细胞系。siSPIB-1/2序列F:5′-GG ACCTATGGACCACTATACT-3′,R: 5′-CAAGGTTCCC TCTTGTCAGAT-3′。
1.2.3细胞增殖检测 细胞密度按照3×103个/孔在96孔板上接种KYSE150细胞并培养过夜,转染siSPIB-1/2和siNC,或接种Vector组和SPIB组KYSE30细胞。不同时间后,每孔加入10 μl CCK-8溶液,继续培养孵育2 h。使用酶标仪(美国Bio-tek公司)测定吸光度值(450 nm)。以siNC组为参考,计算相对细胞增殖率。
1.2.4细胞划痕实验 当KYSE150细胞经过不同转染处理后,按照5×105个/ml的密度接种于6孔板中,继续培养。第2天,换成含0.5% 胎牛血清的培养基继续培养12 h。再用黄色枪头在孔板底部划出平行的划痕,并用PBS洗去漂浮细胞,继续培养48 h。使用光学显微镜进行图像采集。
1.2.5细胞侵袭实验 细胞侵袭实验采用美国Corning公司的Transwell系统,在小室底部预铺基质胶(稀释比例为 6 ∶1)。将经过不同转染处理后的KYSE150细胞稀释成细胞悬液(2×106个/ml),在6孔板内加入600 μl 含15%胎牛血清的培养基,在小室内加入100 μl 上述细胞悬液,继续培养36 h。接下来,对小室的外面细胞进行染色:采用4%多聚甲醛溶液进行室温固定,15 min后采用PBS洗涤,采用1%结晶紫染料进行染色,擦去小室的内面细胞。使用显微镜进行图像采集。
1.2.6细胞周期检测 将KYSE150细胞接种于6孔板中,培养过夜后,分别转染siNC和siSPIB-1/2。48 h后,胰酶消化细胞并收集细胞进行细胞周期检测:首先采用预冷的PBS溶液洗涤2次,然后用70%预冷乙醇固定,24 h后用预冷的PBS溶液洗涤2次,使用500 μl PI溶液进行染色,并避光孵育30 min(37 ℃)。用CytoFLEX流式细胞仪和CyExpert软件分析染色细胞。采用Flow Jo软件分析细胞周期G1/G0、S和G2/M期的细胞百分比。
1.2.7克隆形成实验 将已构建好的稳定表达SPIB的KYSE30细胞系,细胞密度按照250个/孔接种于6孔板中。2周后,去除培养基,使用预冷PBS洗涤细胞2次,加入中性福尔马林固定15 min,弃去固定液,加入结晶紫染色液染色15 min。使用PBS洗去多余的结晶紫染色液,并采用数码相机进行拍照。
1.2.8Western blot实验 采用预冷的RIPA裂解液(含1 mmol/L PMSF)裂解细胞10 min,以14 000 r/min离心5 min取上清液,即蛋白溶液。蛋白溶液通过BCA蛋白检测试剂盒检测蛋白样品浓度。取35 μg蛋白加入到SDS-PAGE胶(10%)中进行分离并转移到PVDF膜上。接下来,将PVDF膜置于5%脱脂奶进行封闭90 min后,弃去封闭液并与一抗孵育过夜(4 ℃)。使用TBS-T溶液洗涤3次,加入辣根过氧化物酶标记的山羊抗兔或鼠的二抗并孵育(室温)。使用TBS-T溶液洗涤3次后,在目标条带位置加超敏感化学发光显色液,通过使用数字成像系统采集图像。
1.2.9qRT-PCR实验 细胞内总RNA使用细胞或组织RNA分离纯化(FastPure Cell/Tissue Total RNA Isolation)试剂盒提取,并经HiScript II Q RT SuperMix试剂盒逆转录为cDNA,使用AceQ qPCR SYBR Green Master Mix试剂盒进行qRT-PCR实验。SPIB引物F:5′-ACCATGCTCGCCCTGGA-3′,R:5′-GGCT AGCGAAGTTCTCC-3′;GAPDH引物F:5′-AGGTCG GTGTGAACGGATTTG-3′,R:5′-GGGGTCGTTGATG GCAACA-3′。
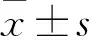
2 结果
2.1 SPIB在食管癌细胞系中的表达情况及其低表达对细胞增殖能力的影响与食管正常上皮细胞Het-1a比较,KYSE150等3株食管癌细胞系中SPIB mRNA和蛋白表达上升(P=0.000 1,F=126.90;图1A、B)。进一步采用siRNA干扰技术分析,2条siRNA-SPIB均能有效地下调KYSE150细胞内SPIB蛋白表达(图1C、D)。因此,通过CCK-8实验显示,下调SPIB表达可减弱KYSE150细胞的增殖能力,差异有统计学意义(48 h:P=0.009 0,F=29.76;72 h:P<0.000 1,F=89.51;图1E)。
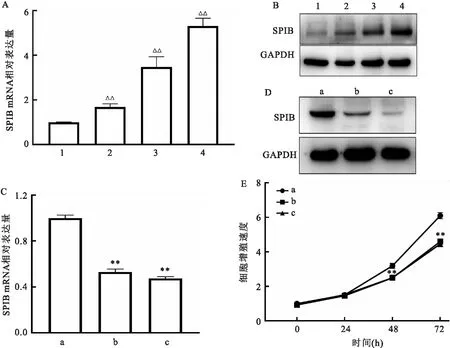
图1 SPIB在食管癌细胞系中表达情况及其低表达对细胞增殖能力的影响
2.2 过表达SPIB对食管癌细胞增殖和克隆形成能力的影响通过构建过表达载体,成功在KYSE30细胞内稳定过表达SPIB蛋白(P<0.000 1,t=64.19;图2A、B)。细胞增殖实验表明,过表达SPIB促进KYSE30细胞增殖,差异有统计学意义(48 h:P= 0.000 1,t=14.06;72 h:P=0.000 7,t=9.363;图2C)。SPIB亦增强KYSE30细胞的克隆形成能力,差异有统计学意义(P=0.002 0,t=7.15;图2D、E)。

图2 过表达SPIB对食管癌细胞增殖和克隆形成能力的影响
2.3 下调SPIB对食管癌细胞周期和Cyclin D1蛋白表达的影响为进一步了解SPIB对食管癌细胞周期的调控能力,采用流式细胞术检测细胞周期,结果显示:敲低食管癌细胞内SPIB表达,可以诱导细胞G1/G0期捕获,降低S和G2/M期细胞比例,差异有统计学意义(图3A、B,表1)。同时,下调表达SPIB进一步降低KYSE150细胞内Cyclin D1蛋白表达(图3C)。

图3 下调SPIB对食管癌细胞周期和Cyclin D1蛋白表达的影响

表1 下调SPIB对食管癌细胞周期的影响
2.4 下调SPIB蛋白表达对食管癌细胞上皮-间充质转化能力的影响敲低KYSE150细胞内SPIB表达,可减弱细胞的迁移能力,差异有统计学意义(P<0.000 1,F= 305.00;图4A、B)。Transwell实验表明,siSPIB可抑制KYSE150细胞的侵袭能力,差异有统计学意义(P=0.004 7,F= 29.57;图4C、D)。为进一步了解SPIB对食管癌细胞EMT相关蛋白表达的影响,通过Western blot检测了细胞内N-cadherin和E-cadherin蛋白的表达水平,结果敲低SPIB表达,可以增加KYSE150细胞内E-cadherin蛋白表达,但减弱了N-cadherin蛋白的表达(图4E)。

图4 SPIB对食管癌细胞上皮-间质转化能力及相关蛋白表达的影响
3 讨论
食管癌是最常见的消化系统恶性肿瘤之一。虽然联合手术与放化疗能显著提高患者的生存预后,但是5年总生存率仍然较低。因此,通过基础实验阐明食管癌发生发展的分子机制将有利于今后的抗食管癌治疗。SPIB作为Ets家族转录因子的成员之一,在调控成熟B细胞的分化过程中发挥重要作用。Ho et al[6]研究表明结肠、肝脏和胃癌组织中SPIB蛋白表达水平显著高于非肿瘤组织。研究[6, 8]表明,SPIB在肝癌和非小细胞肺癌等实体肿瘤中是重要的预后因子。
Zhao et al[11]通过对8例配对食管癌和癌旁正常组织进行GeneChip分析,发现了22个差异化表达转录因子,其中高表达的转录因子为:SPIB、BRCA1、MZF1、MAFG和NFE2L1,这提示SPIB可能作为一个促癌因子,调控食管癌增殖转移。为验证上述推测,本研究首先检测了食管癌细胞系和正常食管上皮细胞中SPIB表达水平,结果显示食管癌细胞中SPIB的mRNA和蛋白表达显著高于食管上皮细胞。因此,推测SPIB可能是一个促癌因子,调控食管癌发展。由于在三株食管癌细胞系中,KYSE150细胞中SPIB表达最高,进行siRNA敲低实验符合实验设计,同时能更好反映SPIB对食管癌细胞生物学行为的影响;而KYSE30细胞中SPIB表达最低,siRNA干扰预实验提示下调SPIB效果不明显,无法进行后续实验,故进行SPIB过表达实验。此外,选择不同细胞系进行正反方向验证,可避免细胞系选择单一而引起的结果偏差。分别通过siRNA和质粒转染方式,下调和上调食管癌细胞中SPIB表达。细胞增殖实验表明,过表达SPIB增强食管癌细胞增殖速度和克隆形成能力。敲低SPIB表达可显著抑制Cyclin D1蛋白表达,诱导食管癌细胞停滞于G1期。迁移侵袭是食管癌的另一个恶性生物学行为。通过细胞划痕实验和Transwell系统检测了SPIB低表达对食管癌上皮间质转化行为的影响,结果显示敲低SPIB表达可显著抑制食管癌迁移侵袭。研究[8, 10]表明过表达SPIB可促进皮下移植瘤的肺部转移,并显著降低模型小鼠的总生存率[10]。研究[8]表明SPIB可通过靶向抑制紧密连接蛋白Claudin-2转录而抑制肺癌的早期转移。本研究中,敲低SPIB表达可以增加食管癌细胞内E-cadherin蛋白表达,但抑制N-cadherin蛋白表达。因此,SPIB可通过调节E-cadherin和N-cadherin蛋白的表达,介导食管癌细胞的迁移侵袭能力。SPIB作为新发现的促癌转录因子,对众多促癌因子起到正向调节作用。但在食管癌中,SPIB是否能通过转录调控方式调节促癌或抑癌因子表达,进一步影响食管癌的恶性行为需要进一步研究。
综上所述,SPIB在食管癌细胞系中表达升高,可促进食管癌细胞增殖、迁移和侵袭,SPIB可能是今后食管癌诊疗的潜在靶点之一。

