达格列净对棕榈酸诱导的人肾小管上皮细胞损伤的保护机制研究
丁庭庭,潘李萌,杨 光,杨 婧,钟 兴,潘天荣
全球糖尿病患病率在未来将继续增加,预计到2045年,全球糖尿病患者数将达到6.93亿[1]。糖尿病常常伴有多种并发症,其中糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最严重的并发症之一,与糖尿病患者的高发病率与死亡率相关,是终末期肾衰竭最常见的病因之一[2]。DKD是一种以肾小球超滤及肾小球电荷和通透性改变为主的疾病,近来研究[3-4]表明肾小管损伤机制可能在DKD的病理生理中起重要作用,DKD患者肾功能下降与肾小管结构改变包括肾小管萎缩、肾小管间质纤维化等有关。钠-葡萄糖共转运蛋白2(sodium-glucose cotransporter 2,SGLT2)抑制剂——达格列净可通过抑制肾脏对葡萄糖的重吸收、促进尿糖排泄降低血糖,并且对DKD有保护作用,但具体机制尚不清楚。该研究通过棕榈酸诱导肾小管上皮细胞线粒体功能障碍及氧化应激模型,使用达格列净干预后检测肾小管上皮细胞线粒体功能、氧化应激及凋亡情况的变化,探讨达格列净对DKD的保护机制。
1 材料与方法
1.1 材料人肾小管上皮细胞HK-2购自美国Actt公司; DMEM/F12培养基、胎牛血清购自美国Gibco公司;PBS缓冲液购自美国Hyclone公司;0.25%含EDTA胰酶消化液购自上海源培公司;棕榈酸购自美国Sigma公司(批号:P0500);达格列净购自南京百鑫德诺生物科技公司(批号:BMS512148);CCK-8细胞活力检测试剂盒购自武汉伊莱瑞特生物科技公司;Hoechst 33258染色细胞凋亡试剂盒购自上海贝博公司;JC-1染色线粒体膜电位检测试剂盒、DCHF-DA细胞活性氧(reactive oxygen species,ROS)检测试剂盒、细胞线粒体分离试剂盒购自上海碧云天生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)检测试剂盒购自南京建成生物公司;β-actin购自美国Engibody公司、caspase3、Cleaved caspase3、Cytochrome C抗体购自英国Abcam公司。
1.2 方法
1.2.1细胞培养与分组 将HK-2细胞置于含10%胎牛血清的DMEM/F12培养液中,同时加1%青-链霉素,在37 ℃、5% CO2饱和湿度的恒温培养箱中,细胞呈贴壁生长,当细胞生长密度达70%~80%时传代。选取生长状态良好处于对数生长期的细胞进行随机分组:正常对照(CON)组,含10%胎牛血清的DMEM/F12培养液对HK-2细胞进行培养;棕榈酸(PA)组,使用棕榈酸浓度为150 μmol/L的培养液培养HK-2细胞[5];棕榈酸+达格列净(PA+Dapa)组,使用棕榈酸浓度为150 μmol/L和达格列净浓度为2 μmol/L的培养液进行HK-2细胞培养;达格列净(Dapa)组,使用含2 μmol/L达格列净的培养液对HK-2细胞培养[6]。
1.2.2CCK-8实验检测细胞增殖力 在96孔板中接种细胞悬液(100 μl/孔),每孔约3 000个细胞进行培养,待细胞培养生长至接近单层时,给与相应的刺激,处理结束后每孔加入100 μl含有10% CCK-8的工作液,在37 ℃、5% CO2培养箱中避光孵育1 h,用酶标仪测定在450 nm处的吸光值。
1.2.3细胞内活性氧的检测 HK-2细胞呈对数生长时,将细胞悬液滴加到6孔板中,放置于细胞培养箱中培养至细胞接近长成单层并给与相应刺激,使用预冷的PBS洗涤细胞3次,用无血清的DMEM/F12培养基稀释DCFH-DA荧光染料至终浓度为10 μmol/L,将染料加入6孔板中,每孔1 ml,均匀覆盖细胞表面,将6孔板放置于37 ℃、5% CO2的培养箱中避光孵育30 min,弃去染料,用无血清的DMEM/F12培养基洗涤细胞3次,然后在荧光显微镜下采集图像。
1.2.4细胞线粒体膜电位的检测 将HK-2细胞接种于6孔板中培养,给与相应刺激后,吸出6孔板中的培养液,使用PBS冲洗1次,加入1 ml细胞培养液和1 ml JC-1染色工作液,充分混匀后放置于细胞培养箱里避光孵育20 min,使用JC-1染色缓冲液(1×)洗涤2次,使用荧光显微镜采集图像。
1.2.5Hoechst33258检测细胞凋亡 将细胞玻片放置于12孔板中,将对数生长期的HK-2细胞以1×105个/孔的细胞密度接种于12孔板,给予相应药物干预后,按照Hoechst33258染色试剂盒说明书进行细胞凋亡的检测,最后使用荧光显微镜采集图像。
1.2.6细胞氧化应激指标的检测 HK-2细胞使用药物干预后,在6孔板中加入100 μl /孔的裂解液冰上裂解30 min,然后收集样品于EP管中,使用BCA蛋白浓度检测试剂盒测量样品的蛋白浓度用于计算,根据说明书检测细胞内SOD、MDA含量。
1.2.7Western Blot法检测细胞凋亡蛋白 细胞及线粒体成分中加入适量的裂解液,冰上裂解30 min,4 ℃、13 200 r/min离心30 min,取上清用BCA蛋白定量检测试剂盒测量相应蛋白浓度。根据蛋白浓度加入适量的蛋白样品(约30 μg/泳道)于SDS-PAGE进行电泳,将蛋白转膜至PVDF膜上,使用5%脱脂奶粉室温慢摇封闭2 h,封闭结束后放置于提前使用一抗稀释液稀释的一抗中,4 ℃孵育过夜,次日使用TBST液快摇洗涤10 min×3次,二抗孵育1 h后再用TBST快摇洗涤10 min×3次,用ECL化学发光试剂盒显影,所有实验重复3次,并使用Image J软件对条带进行灰度值分析。
2 结果
2.1 达格列净对棕榈酸诱导的HK-2细胞的增殖力的影响CCK-8实验结果显示:四组间细胞活力水平比较差异有统计学意义(F=22.87,P<0.01);与CON组比较,PA组HK-2细胞的活力下降(P<0.05),而Dapa组细胞活力差异无统计学意义(P>0.05);与PA组比较,PA+Dapa组细胞活力增强,差异有统计学意义(P<0.05)。见图1。
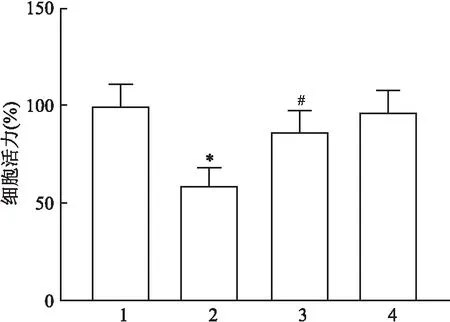
图1 各组HK-2细胞增殖力的情况
2.2 达格列净对棕榈酸诱导的HK-2细胞内ROS表达的影响DCF免疫荧光结果显示:四组间ROS水平差异有统计学意义(F=405.4,P<0.01);与CON组比较,PA组绿色荧光增强,提示ROS水平增强,差异有统计学意义(P<0.05),而Dapa组HK-2细胞绿色荧光强度差异无统计学意义(P>0.05);与PA组比较,PA+Dapa组HK-2细胞绿色荧光强度减弱,提示ROS水平降低(P<0.05)。见图2。
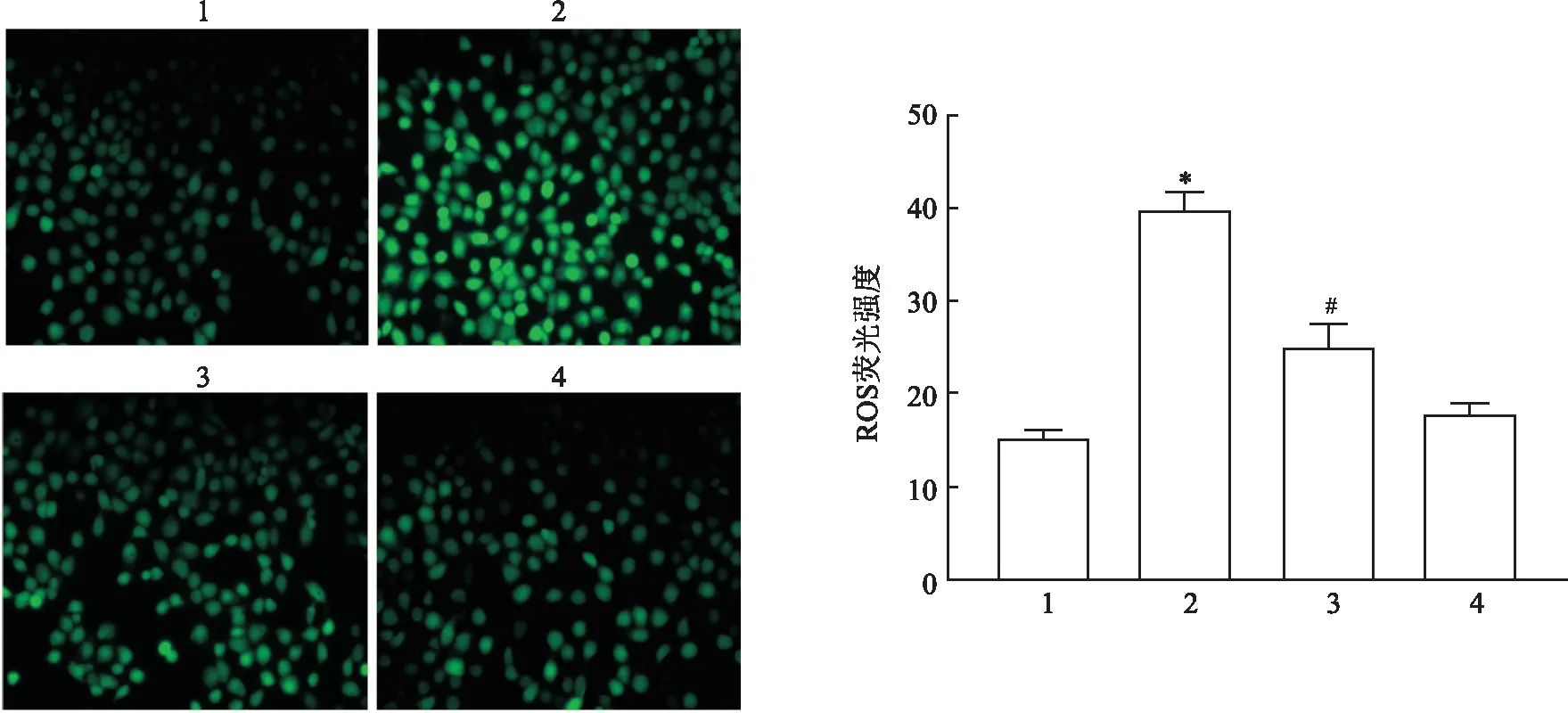
图2 各组HK-2细胞内ROS水平的情况 ×200
2.3 达格列净对棕榈酸诱导的HK-2细胞线粒体膜电位的影响JC-1荧光染色结果显示:四组间线粒体膜电位水平比较差异有统计学意义(F=16.05,P<0.01);与CON组比较,PA组红色荧光强度与绿色荧光强度的比值降低(P<0.05),提示线粒体膜电位降低,而Dapa组红色荧光强度与绿色荧光强度比值差异无统计学意义(P>0.05);与PA组比较,PA+Dapa组红色荧光强度与绿色荧光强度的比值升高(P<0.05),提示膜电位水平升高。见图3。
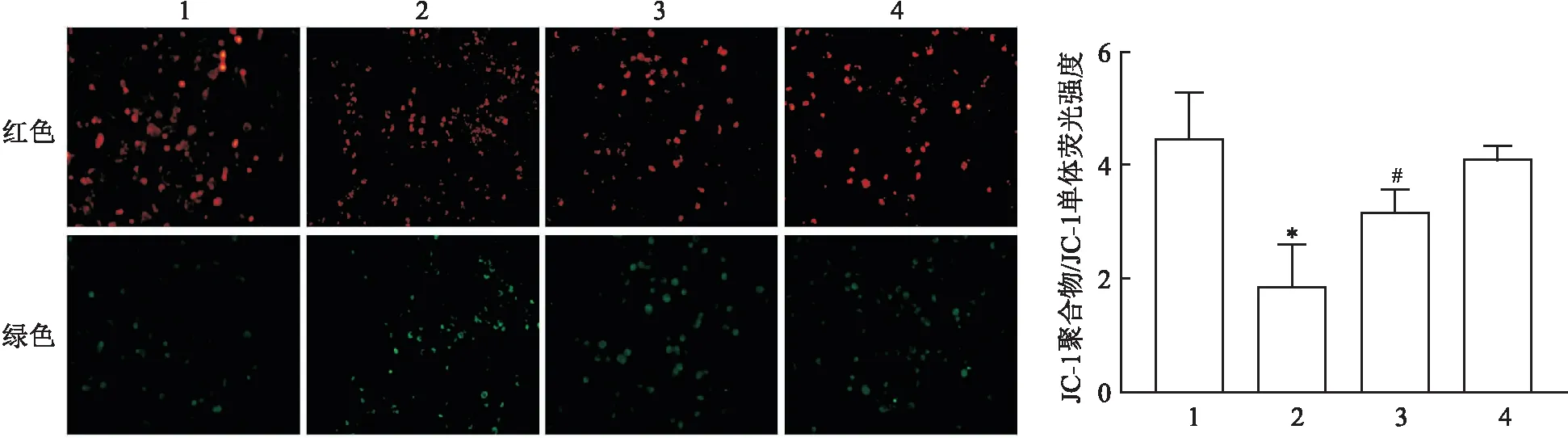
图3 各组HK-2细胞内线粒体膜电位的变化 ×200
2.4 HK-2细胞氧化应激指标的变化SOD、MDA检测试剂盒检测结果显示:四组间SOD、MDA水平比较差异均有统计学意义(F=41.0、26.02,均P<0.01);与CON组SOD、MDA水平比较[(154.40±6.43) U/mgprot、(0.63±0.13) nmol/mgprot],PA组细胞内SOD水平(109.97±3.37) U/mgprot降低,MDA水平(2.01±0.31) nmol/mgprot升高,差异有统计学意义(P<0.05),而Dapa组SOD及MDA水平[(141.75±5.08) U/mgprot、(0.93±0.15) nmol/mgprot]差异无统计学意义(P>0.05);与PA组比较,PA+Dapa组SOD水平(125.32±5.58) U/mgprot上升,MDA水平(1.33±0.17) nmol/mgprot下降,差异有统计学意义(P<0.05)。见图4。
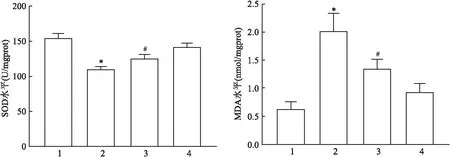
图4 各组HK-2细胞内SOD、MDA水平变化
2.5 HK-2细胞内凋亡水平的变化Hoechast33258凋亡染色结果显示:四组间凋亡水平比较差异有统计学意义(F=244.0,P<0.01);与CON组比较,PA组凋亡染色荧光强度增加,细胞凋亡水平增加,差异有统计学意义(P<0.05);与PA组比较,PA+Dapa组凋亡染色荧光强度降低,细胞凋亡水平下降,差异有统计学意义(P<0.05)。见图5。
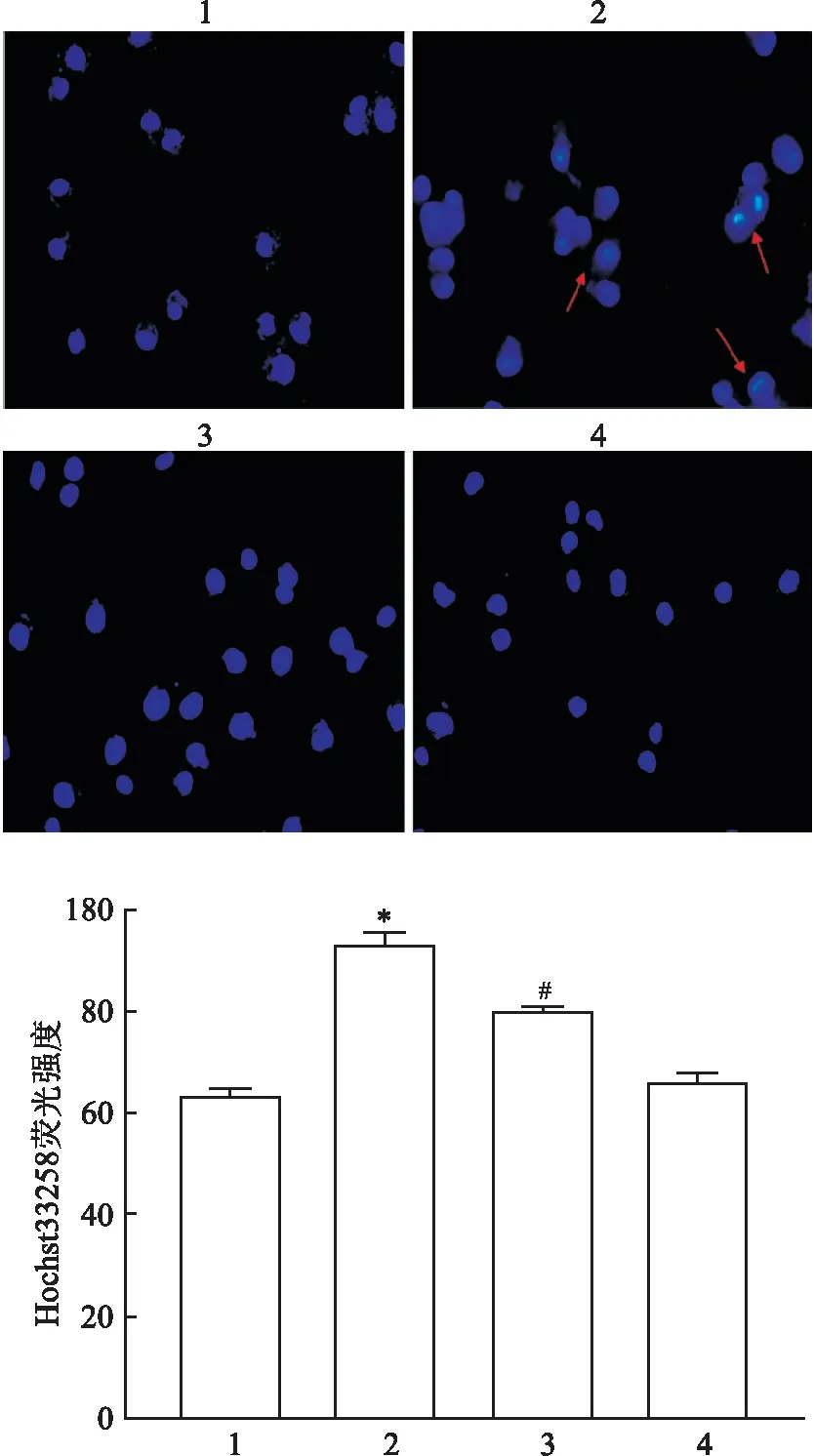
图5 各组HK-2细胞内细胞凋亡水平的变化 ×200
2.6 HK-2细胞内凋亡蛋白和Cyto C蛋白的变化Western Blot结果显示:四组间caspase3、Cleaved caspase3、Cyto C蛋白水平比较差异有统计学意义(F=78.51、179.8、132.3,均P<0.01);与CON组比较,PA组凋亡蛋白caspase3、Cleaved caspase3水平上升,胞浆Cyto C蛋白表达量升高,差异有统计学意义(P<0.05);与PA组比较,PA+Dapa组caspase3、Cleaved caspase3及Cyto C水平下降,差异有统计学意义(P<0.05)。见图6。
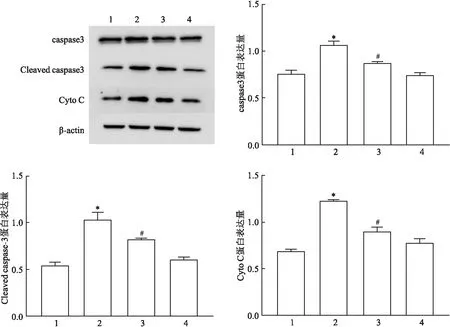
图6 各组HK-2细胞内凋亡蛋白、Cyto C蛋白表达量情况
3 讨论
DKD是慢性高血糖所致的慢性肾脏损害,临床上以持续白蛋白尿和肾小球滤过率进行性下降为主要特征,进而发展为终末期肾病。DKD的治疗主要包括控制体质量、血压和血糖等,以延缓终末期肾病的发展。达格列净是属于SGLT2抑制剂的新型降糖药物,SGLT在体内以主动转运的形式逆浓度梯度转运葡萄糖,参与肾脏对葡萄糖的重吸收。SGLT2表达于肾脏近曲小管,具有低亲和力、高转运能力,在肾脏重吸收约90%的葡萄糖。研究[7]表明,SGLT2抑制剂每天增加尿葡萄糖排泄约70~80 g,降低HbA1c约0.5%~0.8%。临床研究[7]结果显示,达格列净治疗降低了白蛋白尿,并且其降低白蛋白尿的作用很大程度上与血糖、血压及体质量的降低无关,这表明达格列净具有降糖之外的肾脏保护作用。另一项随机交叉实验的事后分析发现达格列净降低了白蛋白尿,并且使肾小管损伤标志物Kim和炎症因子IL-6排泄减少,达格列净降低蛋白尿的作用可能是由于肾小球内压力或肾小管细胞损伤减少所致[8]。本研究使用棕榈酸刺激体外培养的HK-2细胞,结果示棕榈酸可导致体外培养的HK-2细胞增殖力降低,检测凋亡水平增加,达格列净干预后细胞凋亡明显改善,提示达格列净可改善棕榈酸诱导的HK-2细胞增殖力,降低细胞凋亡。
糖脂代谢异常是糖尿病最主要的疾病特征,近年来研究[9-10]认为2型糖尿病的发病机制与脂肪酸代谢紊乱导致的机体胰岛素抵抗、胰岛素分泌异常、糖代谢受损关系密切,游离脂肪酸升高被认为是诱发2型糖尿病的重要原因。同时,异位脂质(脂质在非脂肪组织中的积累)与系膜细胞、足细胞和近端肾小管上皮细胞的结构和功能变化有关,是导致肾脏损害的重要原因[11]。目前DKD的发病机制尚不完全清楚,可能与高血糖、微循环障碍、糖代谢异常、脂代谢异常及氧化应激有关。近来研究[12]表明,DKD的发生可能与线粒体功能障碍有关。而氧化磷酸化系统在线粒体内膜上发生,若内膜一旦被破坏,磷酸化解偶联和电子传递系统完全失去运作平衡,导致氧化应激的发生;同时,发生氧化应激时,可引起线粒体功能损伤加重。实验研究[13]发现高糖使得体外培养的HK-2细胞线粒体断裂,线粒体膜电位降低,同时伴有线粒体蛋白Drp1和Fis1的表达增加,融合蛋白Mfn2表达降低。以上研究提示,在糖尿病模型中存在线粒体功能障碍。本研究通过体外培养人肾小管上皮HK-2细胞,使用棕榈酸处理后结果显示HK-2细胞凋亡增加,表现为线粒体膜电位下降,产生过量的ROS导致氧化应激的发生;同时胞浆Cyto C蛋白表达量增加,提示线粒体损伤膜通透性增加,从而使Cyto C从线粒体释放至胞浆,激活caspase引起凋亡。
达格列净对肾脏保护作用的潜在机制可能是多方面的。有研究[14]报道,使用达格列净干预胰岛素抵抗的代谢综合征大鼠模型后,大鼠心肌细胞线粒体膜电位升高、ROS减少及Ca2+稳态得到良好控制,提示达格列净通过改善线粒体功能及氧化应激对代谢综合征大鼠的心脏进行保护作用。另一项体外研究[15]表明,达格列净可以降低高葡萄糖所致的肾小管上皮细胞内ROS、IL-8、TGF-β水平及对高葡萄糖触发的细胞凋亡发挥保护作用,提示达格列净可改善肾小管氧化应激、炎症和纤维化。Takagi et al[5]研究发现,在高脂喂养的小鼠中,近端肾小管出现空泡化、扩张和上皮细胞脱离,同时体外培养HK-2细胞,在高糖和棕榈酸刺激下表现为线粒体明显损伤,使用伊格列净改善了上述症状。本研究结果同样显示,达格列净可以提高棕榈酸诱导的HK-2细胞线粒体膜电位,降低ROS水平及氧化应激水平,使HK-2细胞内凋亡蛋白水平降低,对棕榈酸干预的HK-2细胞具有保护作用。
综上所述,达格列净使棕榈酸干预的HK-2细胞线粒体功能及氧化应激水平得到改善,提示达格列净可能通过改善线粒体功能障碍及氧化应激水平对DKD进行保护作用。

