MG53改善脂多糖诱导小鼠抑郁样行为的实验研究
龙香花,鲁 跃,裴昌贞
(重庆市大足区人民医院睡眠心身中心,重庆 402360)
抑郁症是一种高发病率、高复发率和高致残率的疾病,临床上常用五羟色胺再摄取抑制剂(Selective serotonin reuptake inhibitor,SSRI)和五羟色胺去甲肾上腺素再摄取抑制剂(Serotonin noradrenaline reuptake inhibitor,SNRI)等抗抑郁药进行治疗,但是仅50%的患者治疗有效,仅30%的患者获得痊愈[1]。因此亟需研发新型抗抑郁药物。研究证实,抑郁症的发生与免疫炎症损伤有关[2],例如脂多糖(lipopolysaccharide,LPS)是一种常用的促炎性内毒素,可以引起小胶质细胞和星形胶质细胞活化,使机体促炎细胞因子水平升高,诱发小鼠抑郁样行为[3]。Mitsugumin-53(MG53)是多功能三结构域(TRIM)蛋白家族中的成员之一,基本结构由N 末端的RING,B 盒和卷曲螺旋区域组成,其最早被发现与心肌细胞膜修复有关[4],后来研究发现,MG53 能够参与胰岛素抵抗和炎症损伤等病理过程[5-6]。重组人MG53 可以改善机体损伤对心脏、骨骼肌、肺、肾、皮肤和大脑的影响[7]。Yao 等[8]发现,重组人MG53 可以透过血脑屏障,通过改善免疫紊乱对缺血性脑损伤起到保护作用。MG53是否能通过减轻免疫炎症损伤而改善抑郁症,既往鲜有报道。本研究建立LPS致小鼠抑郁模型,用糖水偏好实验和悬尾实验检测小鼠的抑郁情况[9-10],检测海马小胶质细胞激活和炎症细胞因子表达水平,旨在探讨重组人MG53 改善LPS 诱导小鼠抑郁样行为的可能机制。
1 材料与方法
1.1 动物与试剂24 只成年雄性C57BL/6N 小鼠,体重20~25 g,购于北京维通利华实验动物技术有限公司。重组人MG53 购于英国ABCAM 公司,LPS 购于上海复申生物科技有限公司,戊巴比妥购于天津一方科技有限公司,肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、白细胞介素1β(Interleukin-1 β,IL-1β)和白细胞介素-6(IL-6)酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)试剂盒购于武汉博士德生物科技有限公司,免疫荧光检测试剂盒购于上海瑞楚生物科技有限公司。转录因子κB(Transcription factor kappa B,NF-κB)p65、五羟色胺转运体(Serotonin transporter,5-HTT)、脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)和GAPDH内参抗体均购于美国Sigma公司。
1.2 动物干预将小鼠随机分为对照组、LPS组和LPS+MG53组,每组8 只。第1~4 天时对照组和LPS组腹腔注射等体积的生理盐水,LPS+MG53组腹腔注射重组人MG53(3 mg/kg[11]),1 次/d。LPS组和LPS+MG53组小鼠最后一次注射后的1 h,腹腔注射LPS(0.83 mg/kg[12]),对照组注射等体积的生理盐水。LPS注射24 h 后,对所有小鼠进行行为测试,随后处死小鼠,快速取出脑海马组织,储存于-80℃冰箱中。实验过程中对动物的处置符合2009 年《Ethical issues in animal experimentation》[10]相关动物伦理学标准的条例。
1.3 抑郁样行为测试
1.3.1 糖水偏好实验[9]先剥夺小鼠饮水6 h,后用蔗糖水和纯水双瓶给小鼠饮用,测量1 h 内小鼠的糖水或纯水消耗量,计算糖水偏好百分比(糖水消耗量/总液体消耗×100%)。
1.3.2 悬尾实验(Tail suspension test,TST)[10]小鼠放置于行为实验房间适应1 h,将小鼠尾部的后1/3固定于悬尾实验架上,头部朝下,头部距离箱底15 cm。用EthoVision XT7.0影像采集系统(荷兰Noldus)进行摄像,计时5 min,前2 min为小鼠不动潜伏期时间,后3 min为小鼠不动总时间。
1.4 免疫荧光法检测海马小胶质细胞激活情况用 150 mg/kg 戊巴比妥麻醉小鼠,以37℃生理盐水经右心耳迅速灌注,随后用4℃4%多聚甲醛溶液灌注。灌注完毕后立即取脑固定、脱水和切片,切片厚度为25 μm。将切片放置于切片保护液中,保存于-20℃冰箱。0.1 M PBS 漂洗切片后用10%山羊血清封闭,1 h后加入IBA1一抗(1∶500),4℃过夜,0.1 M PBS冲洗后加入Alexa Fluor 488标记的羊抗鼠二抗(1∶1 000),避光1 h,0.1 M PBS 冲洗后封片,在尼康ECLPSE 80i 荧光显微镜下观察海马免疫染色切片。每只小鼠标本随机选取3 张切片,每张切片选取3 个视野,用Image-Pro-plus 6.0软件对IBA1阳性细胞的密度进行自动分析,在×20 倍放大镜下分析小胶质细胞胞体面积和突起长度,取平均值。
1.5 ELISA 法检测炎症细胞因子表达水平取小鼠海马组织,每100 mg组织中加入1 mL PBS缓冲液,超声匀浆10 min 后在4℃孵化1 h,得到的组织匀浆在120 000 g下离心,获取上清液。用ELISA试剂盒检测上清液中TNF-α、IL-1β 和IL-6 浓度,实验步骤严格按照试剂盒说明书操作。
1.6 Western-blot 检测蛋白表达水平用RIPA 裂解液提取海马组织中总蛋白,用BCA 试剂盒检测蛋白浓度,10%SDS-PAGE 分离蛋白,用半干法将蛋白转至PVDF 膜。5%脱脂奶粉封闭2 h,加入NF-κB p65 一抗(1∶500)、5-HTT 一抗(1∶500)或BDNF 一抗(1∶500),4℃过夜孵育,次日除去一抗,用TBST 缓冲液洗涤3 次后加入羊抗兔二抗(1∶500),封闭1 h。以GAPDH作为内参,用ECL发光仪对蛋白成像,用Image J软件分析灰度值。
1.7 统计学方法采用SPSS22.0 软件进行统计学分析,计量资料用均数±标准差()表示,多组间比较用单因素方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠抑郁样行为比较对照组糖水偏好百分比为(81.04±15.12)%,TST 不动时间为(52.01±9.89)s;LPS组分别为(57.90±10.01)%、(76.68±9.13)s;LPS+MG53组分别为(75.23±11.28)%、(53.09±7.12)s。与对照组比较,LPS组糖水偏好百分比降低,TST不动时间延长(P<0.05)。与LPS组比较,LPS+MG53组糖水偏好百分比增高,TST 不动时间缩短(P<0.05),见图1。
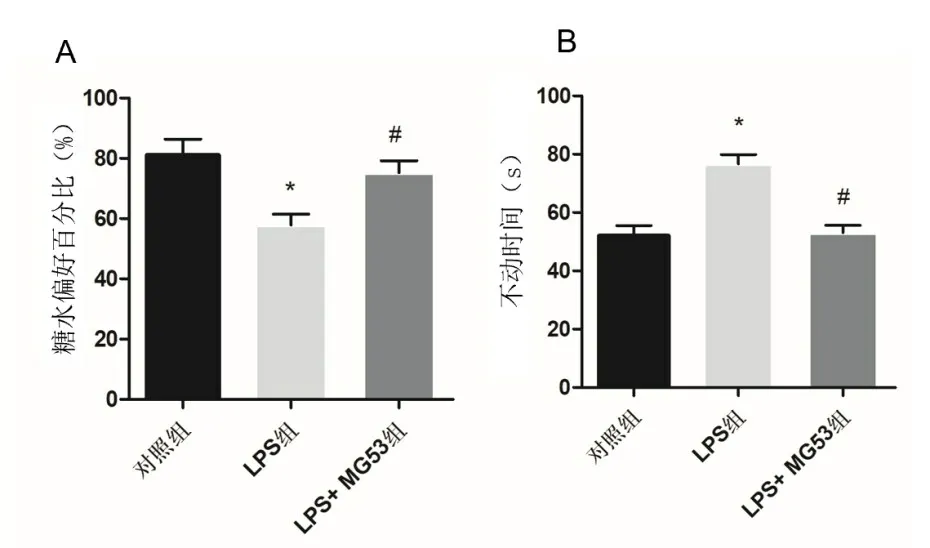
图1 各组小鼠抑郁样行为比较(n=8)
2.2 各组小鼠海马小胶质细胞激活情况比较对照组IBA1 阳性细胞数为(69.23±10.12)个/mm2,小胶质细胞胞体面积为(37.80±8.79)μm2,小胶质细胞突起长度为(21.89±7.34)μm;LPS组分别为(121.29±13.10)个/mm2、(119.45±33.07)μm2、(11.70±3.20)μm;LPS+MG53组分别为(88.10±15.14)个/mm2、(78.98±18.45)μm2,(18.00±4.62)μm。与对照组比较,LPS组IBA1阳性细胞数增多,小胶质细胞胞体面积变大,而小胶质细胞突起长度变短(P<0.05)。与LPS组比较,LPS+MG53组IBA1 阳性细胞数减少,小胶质细胞胞体面积缩小,而小胶质细胞突起长度变长(P<0.05),见图2。

图2 免疫荧光法检测小鼠海马小胶质细胞的激活情况
2.3 各组小鼠海马组织炎症细胞因子表达水平比较
对照组海马组织中TNF-α、IL-1β、IL-6蛋白浓度、NF-κB p65蛋白相对表达水平分别为(23.45±8.34)pg/mL、(88.11±28.79)ng/L、(65.02±25.00)ng/L、(0.43±0.09),LPS组分别为(57.90±10.01)pg/mL、(142.12±43.09)ng/L、(156.02±65.02)ng/L、(1.21±0.12),LPS+MG53组分别为(35.90±7.76)pg/mL、(110.23±36.78)ng/L、(100.03±19.89)ng/L、(0.65±0.09)。与对照组比较,LPS组海马组织TNF-α、IL-1β和IL-6蛋白浓度及NF-κB p65蛋白相对表达水平升高(P<0.05)。与LPS组比较,LPS+MG53组TNF-α、IL-1β 和IL-6 蛋白浓度及NF-κB p65蛋白相对表达水平降低(P<0.05),见图3。

图3 各组小鼠海马组织炎症细胞因子表达水平比较
2.4 各组海马组织5-HTT 和BDNF 表达水平比较对照组海马组织5-HTT 和BDNF 蛋白相对表达量分别为(1.34±0.08)、(1.14±0.09),LPS组分别为(0.41±0.04)、(0.52±0.10),LPS+MG53组分别为(0.87±0.09)、(0.72±0.10)。与对照组比较,LPS组海马组织5-HTT 和BDNF 表达水平降低(P<0.05);与LPS组比较,LPS+MG53组5-HTT和BDNF表达水平升高(P<0.05),见图4。

图4 各组海马组织5-HTT和BDNF表达水平比较
3 讨论
抑郁症的发病机制有单胺神经递质假说、谷氨酸假说、下丘脑-垂体-肾上腺轴假说、神经营养假说和炎症假说等。临床上常用的SSRI 和SNRI 等抗抑郁药的治疗有效率不足50%[1]。本研究结果显示,重组人MG53 对LPS 诱导的小鼠抑郁样行为有一定改善作用。
细胞膜完整性在维持细胞内稳态方面起着重要作用,细胞膜缺陷会导致细胞死亡,并且与多种疾病有关,例如神经退行性疾病[13]。既往研究发现,MG53对细胞膜损伤和组织损伤有一定保护作用[14]。MG53与磷脂酰丝氨酸(Phosphatidylserine,PS)结合,并与caveolin-3 蛋白相互作用,进而修复损伤的细胞膜[15]。在组织修复中,MG53与磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)的亚单位P85 及caveolin-3 相互作用,随后激活Pl3K/Akt/GSK3β 信号通路和ERKl/2 信号通路,进而保护缺血性脑损伤和心肌损伤[8,16]。
免疫炎症损伤是抑郁症发病的重要机制之一,抑郁症患者外周血炎症细胞因子TNF-α、IL-1β 和IL-6 表达水平升高[17]。转录因子NF-κB 调控炎症细胞因子表达及免疫应答,在抑郁症中表达水平也较高[18]。LPS 腹腔注射是抑郁症经典模型。本研究中,一次性腹腔注射0.83 mg/kg LPS 诱导了小鼠抑郁样行为,糖水偏好百分比明显降低,TST 不动时间延长,与既往报道一致[9,19-20]。
既往研究发现,MG53 能够改善炎症损伤和氧化应激损伤[21]。免疫荧光染色实验中,IBA1 阳性细胞数、小胶质细胞胞体面积、突起长度用于评估小胶质细胞的激活[22]。本研究发现,重组人MG53 可以降低LPS诱导的海马小胶质细胞激活(IBA1阳性细胞数增多,小胶质细胞胞体面积变大,小胶质细胞突起长度变短),并降低NF-κB p65、TNF-α、IL-1β 和IL-6 表达水平。Ma 等[23]的研究也发现,MG53 可以改善人脐带间充质干细胞和小鼠大脑的胶质细胞活化,降低TNF-α、TOLL 样受体4、炎症小体NLRP3 和IL-1β 表达水平。海马炎症损伤使5-HTT 和BDNF 表达水平下降,进而诱发抑郁[24]。本研究也发现,重组人MG53使海马组织5-HTT和BDNF表达水平升高,进一步验证了重组人MG53的抗抑郁效果。
综上所述,重组人MG53 可通过改善海马炎症损伤而改善LPS 诱导的小鼠抑郁样行为,MG53 可能成为抑郁症的治疗靶点。未来需要进一步深入研究,明确MG53在抑郁症中的分子生物学机制。

