肿节风药渣绿色制备纳米银及体外抗癌作用研究
王英辉,邹太艳,苏 瑞,魏思敏
·药剂与工艺·
肿节风药渣绿色制备纳米银及体外抗癌作用研究
王英辉1,邹太艳2,苏 瑞2,魏思敏2*
1. 长安大学理学院,陕西 西安 710064 2. 陕西中医药大学,陕西中药资源产业化省部共建协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西省创新药物研究中心,陕西 咸阳 712083
使用单味药渣绿色合成纳米银,研究生物合成参数对纳米银生成、粒径及多分散性的影响;研究合成的纳米银理化性质、抗癌活性及作用机制。使用肿节风药渣在超声条件下合成纳米银,紫外可见光谱监测纳米银生成和生长,激光粒度仪和透射电镜表征纳米银的组成、粒径、分散性、表面性质和形貌,MTT法检测抗癌活性,流式细胞技术测纳米银内吞作用,2′,7′-二氯荧光素-二乙酸酯染色法检测活性氧物质。pH 7.0、肿节风药渣提取液-AgNO32∶1、反应时间4.0 h时生成效率最高;pH 10.0、物料比1∶1或pH 7.0、物料比2∶1时能获得粒径为34 nm左右的纳米银,但碱性条件影响纳米银的分散性;物料比1∶1时可获得分散性最好的纳米银,多分散指数(polydispersity index,PDI)为0.20。pH 7.0、物料比2∶1、反应时间2.0 h时生成的纳米银呈近球形,粒径在20~30 nm,以单分散形式存在,为六方晶型结构,表面带负电荷,ζ电势−22.2 mV,1个月内保持稳定,对人肝癌HepG2细胞的半数抑制浓度(IC50)为44.2 μg/mL,该方法合成的纳米银可被细胞摄入并在细胞内产生活性氧物质。使用单味中药肿节风药渣可绿色合成纳米银,生物合成参数对纳米银形成、粒径及多分散性影响较大;制得的纳米银有强体外抗癌活性,可能通过产生活性氧物质破坏细胞组织或DNA等杀死癌细胞。
纳米银;单味中药;药渣;绿色合成;生物合成参数;抗癌活性;活性氧物质
纳米银(silver nanoparticles)具有独特的光、电、磁及比表面大等特性,被广泛用于催化、防静电材料、低温超导材料、电子浆料、生物传感和医药领域[1-2];且以纳米银为材料的导电薄膜具有高透明、可弯曲折叠和拉伸特性,在折叠屏手机生产制造中也有重要应用,因此其制备方法备受关注[3-7]。近年来植物提取液、细菌、真菌和生物聚合物均被用于合成纳米银,即生物还原法;由于该方法绿色节能,制得纳米银生物活性多样、毒性低,已引起研究人员极大兴趣。迄今,多种植物已被用于合成纳米银,比如樱桃[8]、咖啡树[9]、马齿苋[10]、莲藕[11]、薄荷[12]、荷花[13]等。
根据文献报道[14],植物中包含的萜类、黄酮类、酮类、醛类等生物分子既作为还原剂使Ag+转变为Ag,又作为保护剂吸附在纳米银的表面防止纳米银团聚,此外还可以降低纳米银的毒性。有研究显示,如果植物提取液中包含的物质生物活性较强,协同效应使其制得的纳米银也具有较强生物活性[14]。因此,利用中药绿色合成纳米银是该领域目前研究的热点[15]。本课题组在近期利用沙棘[16]、大枣[17]、山茱萸[18-20]等成功制备了具有生物活性的纳米银。
然而,中药资源作为我国重要的战略资源,其开发利用面临“入不敷出”的状态,资源相对匮乏[21],限制了中药在绿色合成纳米银领域的应用。文献证实[22],中药渣中残留有大量生物碱、黄酮类、脂肪、多糖、蛋白质和氨基酸等成分。
本课题组前期利用八正合剂[23]和银翘解毒合剂药渣[24]成功制备了具有生物活性的纳米银,这些实验结果充分说明,中药渣可作为中药替代物用于绿色合成纳米银。然而,八正合剂和银翘解毒合剂属于复方药物,药渣为多味药的混合药渣,药渣混合的均匀程度会对纳米银的制备产生影响。使用单味药渣可以避免该问题,因此,本实验拟采用肿节风药渣制备纳米银。
肿节风是一种常见的中药,为金粟兰科草珊瑚属植物草珊瑚(Thunb.) Nakai的全株,具有清热凉血、活血消斑、祛风通络的功效,可用于治疗肺炎、阑尾炎、蜂窝组织炎、风湿痹痛、跌扑损伤、肿瘤等诸多疾病[25]。化学成分分析显示,肿节风主要包含倍半萜、香豆素、黄酮和皂苷等物质[25]。肿节风药渣成分稳定、易于获得。本实验以肿节风药渣为原材料,通过将其中残留的活性成分提取并作为还原剂和保护剂,在室温超声条件下将Ag+还原制备纳米银;并研究纳米银的体外抗癌活性,初步揭示其抗癌机制。该研究结果可有效克服中药渣绿色合成纳米银时混合药渣稳定性差的缺点,有望促进中药渣在绿色合成纳米银领域的应用。
1 仪器与材料
1.1 仪器
UV-2600型紫外-可见分光光度计,岛津(日本)公司;ZEN 3600激光粒度仪,英国马尔文仪器有限公司;JEM-2100 Plus型透射电子显微镜,日本JEOL公司;Thermo Multiskan GO多功能酶标仪,美国Thermo公司;BD FACS Canto流式细胞仪,美国BD公司。
1.2 试剂
硝酸银(质量分数>99%)、胰蛋白胨、氯化钠、酵母粉、琼脂粉均为分析纯,购于成都科隆化学品有限公司;2′,7′-二氯荧光素-二乙酸酯购于Sigma- Aldrich公司;MTT试剂盒、青霉素/链霉素双抗购于北京索莱宝科技有限公司;DMEM基础培养基、胎牛血清和胰蛋白酶购于Biological Industries公司;肿节风药渣由陕西中医药大学制药厂生产咽炎清丸(国药准字:Z20090559,批号18E01)时产生。人肝癌HepG2细胞从中国科学院细胞库购买。
2 方法与结果
2.1 肿节风药渣水提液的制备
准确称取干燥肿节风药渣5.0 g,粉碎过300目筛后得粉末,随后加入100 mL超纯水超声提取4.0 h,滤过得滤液,备用。经测定肿节风药渣水提液原液pH约为7.0。
2.2 肿节风药渣水提液制备纳米银
取5.0 mL肿节风药渣水提液(原液),加入10 mmol/L的AgNO3溶液5.0 mL,室温超声(60 kHz,400W);制备条件筛选实验中,提取液pH使用氢氧化钠调节;反应过程中使用紫外-可见光谱监测纳米银生成。待反应完成后取反应悬浮液,10 000 r/min离心10 min(离心半径13.5 cm),弃上清液取沉淀,用超纯水洗涤3次,收集沉淀,冷冻干燥12 h至恒定质量得纳米银。
2.2.1 生物合成参数对纳米银生成的影响 使用5.0 mL肿节风药渣水提液原液(pH 7.0)与5.0 mL AgNO3(10 mmol/L)在室温超声条件下反应,反应2.0 h后,反应混合液由淡黄色变为深褐色,表明反应混合液中生成纳米银,肿节风药渣水提液原液可以还原Ag+制备纳米银。因为纳米银在400~500 nm有等离子体共振吸收峰(SPR)[26-27],且肿节风药渣水提液和AgNO3在300 nm后没有明显吸收[18],所以可通过紫外-可见吸收(UV-Vis)光谱实验确认纳米银生成。如图1-A所示,经过2.0 h反应后,肿节风药渣水提液原液在300 nm后仍没有吸收,但是反应混合液却具有强吸收,吸收最大峰位于421 nm,与文献报道的纳米银SPR吸收峰一致,因此可以确定反应混合液中生成纳米银。
根据文献报道[28-29],生物合成参数对纳米银的生成效率、粒径以及分散性有影响,所以首先评价生物合成参数对还原反应效率的影响。如图1-A所示,将反应液pH由7.0变至9.0,反应混合液在420 nm附近的吸收峰强度逐渐减少,最大吸收峰位置从421 nm蓝移至401 nm。反应混合液吸收强度变化表明,随着反应液pH增加,体系中生成纳米银的数量减少;最大吸收峰移动可能源于不同pH值下生成的纳米银粒径不同。随后,将反应液pH升高至10.0发现,吸收峰强度虽然有所增强,但最大吸收峰(371 nm)处的强度小于pH 7.0时的强度,并且吸收峰变宽,同时在500 nm附近出现1个弱肩峰。吸收峰变宽及出现肩峰可能源于各向异性纳米银生成或聚集体产生[30]。可以看出,反应液pH对还原反应影响较大,单位时间内,中性条件(pH 7.0)时生成纳米银最多。
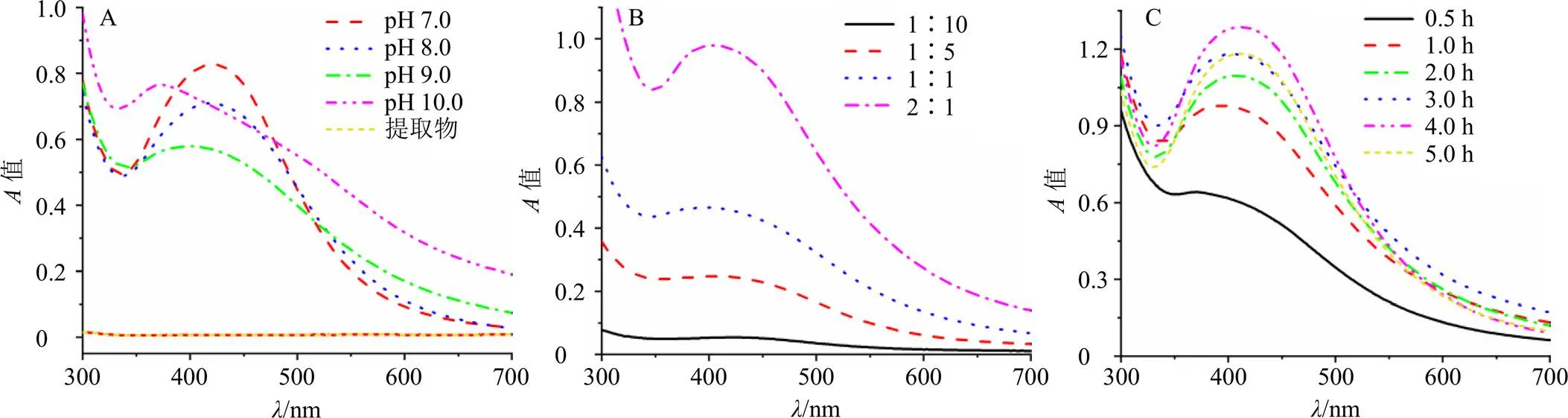
图1 不同pH值 (A)、物料比(B)、反应时间(C)下反应混合液的紫外-可见吸收光谱
接着,在pH 7.0,室温超声反应1.0 h的条件下,使用不同体积比的肿节风药渣提取液与硝酸银(10 mmol/L)评价物料比对还原反应的影响,结果如图1-B所示。可以看出,随着反应混合液中肿节风药渣提取液量增加,混合液在420 nm附近的吸收峰强度逐渐增加,最大吸收峰从438 nm蓝移至407 nm。这表明,1.0 h内物料比为2∶1时生成的纳米银最多,不同物料比导致生成纳米银的粒径有差异。
最后,在pH 7.0,肿节风药渣提取液-AgNO32∶1时评价反应时间对还原反应效率的影响。从图1-C看出,反应初始时刻(0.5 h)420 nm附近就有强吸收;反应4.0 h后,420 nm附近吸收峰强度达到最大;不同反应时间时最大吸收峰位置稍有不同。表明反应4.0 h时还原反应已经完成,反应时间对生成的纳米银粒径有影响。综合以上实验数据看出,在pH 7.0,肿节风药渣提取液-AgNO32∶1时反应效率最高,该条件下进行4.0 h还原反应即可完成。
2.2.2 生物合成参数对纳米银平均粒径的影响 使用动态光散射(dynamic light scattering,DLS)测量纳米银平均粒径,评价生物合成参数对纳米银粒径的影响。从表1可以看出,在肿节风药渣提取液- AgNO31∶1时,反应液pH值及反应时间对生成的纳米银粒径均有影响,但是反应相同时间,在pH 10.0时生成的纳米银粒径最小(除4.0 h),这与UV-Vis吸收光谱观测到的结果一致,也与文献报道的碱性条件下生成的纳米银粒径较小的结论一致[12]。在pH 10.0,反应3.0 h后得到的纳米银粒径最小,为(34.9±0.6)nm。此外,在pH 8.0和9.0,反应初始时刻(1.0 h)生成的纳米银粒径较大,这可能源于AgNO3在体系中分布不均匀,导致局部浓度较大使生长速度大于成核速度。
表2展示了pH 7.0时,不同物料比在反应不同时间后生成纳米银的平均粒径分布。由表可知,在相同反应时间内,肿节风药渣提取液-AgNO32∶1时生成纳米银的粒径较小(除3.0和4.0 h)。在肿节风药渣提取液-AgNO32∶1,反应2.0 h时得到的纳米银平均粒径为(34.0±0.7)nm。稍小于pH 10.0,反应3.0 h后得到的纳米银粒径。
表1 不同pH值和反应时间时合成的纳米银平均粒径分布(提取液-AgNO3 1∶1)
Table 1 Average size of biosynthesized AgNPs under different pH values and incubation time (extract-AgNO3 1∶1)
pH值平均粒径/nm 1 h2 h3 h4 h5 h 7.054.8±0.365.7±1.047.0±0.348.8±0.347.4±0.4 8.064.0±1.948.2±1.048.4±0.548.5±0.948.1±0.5 9.063.2±1.348.6±1.448.8±1.142.6±1.849.2±0.5 10.048.8±0.640.2±1.134.9±0.654.9±1.044.4±0.6
表2 不同提取液-AgNO3比例和反应时间时合成的纳米银平均粒径分布(pH 7.0)
Table 2 Average size of biosynthesized AgNPs under different material ratios and incubation time (pH 7.0)
提取液-AgNO3平均粒径/nm 1 h2 h3 h4 h5 h 2∶139.9±2.334.0±0.753.7±1.845.1±1.642.1±1.2 1∶154.8±0.365.7±1.047.0±0.348.8±0.347.4±0.4 1∶249.8±3.545.5±0.645.7±1.143.0±1.049.9±1.2 1∶1077.8±2.271.1±5.865.9±6.388.2±2.455.0±1.8
2.2.3 生物合成参数对纳米银多分散性的影响 纳米粒子的多分散性会影响其理化性质,根据文献报道[31],当纳米粒子的多分散指数(polydispersity index,PDI)小于0.3时,纳米粒子具有好的分散性。所以,使用DLS对不同生物合成参数下合成的纳米银PDI进行测量。表3展示了物料比1∶1时不同pH值和反应时间合成的纳米银PDI。由表3可知,随着反应液pH逐渐增加,PDI有变大趋势。表明在较高pH时合成的纳米银分散性相对较差,与UV-Vis吸收光谱上观测到的结果一致。在pH 7.0,反应时间3.0 h时PDI最小,为0.20±0.01。在pH 7.0时,考察不同物料比及反应时间对纳米银分散性的影响。
如表4所示,反应液中肿节风药渣提取液浓度增大到1∶1时得到的纳米银分散性最好;继续增加肿节风药渣提取液浓度至2∶1不会得到分散性更好的纳米银,这可能是由于体系中单位体积内生成的纳米银太多导致。
在pH 7.0,肿节风药渣提取液-AgNO32∶1,反应时间1.0 h时,考察温度对纳米银生成效率、粒径和多分散性的影响,发现升高温度可促进纳米银生成,但是3次平行实验测量发现平均粒径[(60.0± 0.4)nm]和PDI(0.43±0.01)会增大,所以选取室温作为反应温度。
表3 不同pH值和反应时间时合成的纳米银PDI(提取液- AgNO3 1∶1)
Table 3 PDI of biosynthesized AgNPs under different pH and incubation time (extract-AgNO3 1∶1)
pH值PDI 1 h2 h3 h4 h5 h 7.00.27±0.010.33±0.030.20±0.010.21±0.010.20±0.01 8.00.40±0.020.25±0.010.25±0.010.25±0.010.26±0.01 9.00.48±0.010.45±0.010.44±0.020.40±0.020.45±0.01 10.00.37±0.010.39±0.010.35±0.040.41±0.010.28±0.01
表4 不同提取液-AgNO3比例和反应时间时合成的纳米银PDI(pH 7.0)
Table 4 PDI of biosynthesized AgNPs under different material ratio and incubation time (pH 7.0)
提取液-AgNO3PDI 1 h2 h3 h4 h5 h 2∶10.40±0.030.36±0.040.45±0.010.46±0.010.43±0.02 1∶10.27±0.010.33±0.030.20±0.010.21±0.010.20±0.01 1∶20.39±0.020.38±0.010.37±0.020.29±0.030.38±0.01 1∶100.44±0.050.37±0.040.49±0.060.48±0.020.41±0.04
2.2.4 最佳工艺参数的确定及验证 最终,通过综合评价生物合成参数对纳米银生成效率、平均粒径及多分散性的影响,结合文献报道的纳米银生物活性与其粒径大小相关等信息,确定最佳工艺参数为pH 7.0,肿节风药渣提取液-AgNO32∶1,反应2.0 h。
另取3批不同生产批次的肿节风药渣在最佳工艺参数时反应,合成的纳米银平均粒径基本相同,分别为(33.5±0.5)、(34.0±0.2)、(34.1±0.4)nm。
2.3 纳米银的表征
使用JEM-2100 Plus型透射电子显微镜(TEM)表征纳米银的粒径、形貌;高分辨TEM(HRTEM)和选区电子衍射(SAED)表征晶型。
对最佳工艺参数下合成的纳米银平均粒径、形貌、分散性、晶型以及表面性质和稳定性等进行表征。使用能量色散X射线光谱仪(EDX)对肿节风药渣合成的纳米银进行表征,结果如图2-A所示。由图看出,在3 keV附近有大量的银元素峰,证实合成的粒子为纳米银;此外,在8 keV处观察到很强的Cu元素峰,这主要由载样的铜网导致。
使用TEM对纳米银形貌进行表征。由图2-B看出纳米银呈近球形;粒径分布在20~30 nm,与DLS得到的平均粒径[(34.0±0.7)nm,图2-C]一致;以单分散形式存在。
通过选区电子衍射(SAED)和高分辨TEM(HRTEM)表征纳米银晶型(图2-D、E)。从SAED图上观察到3个明显的环,值为0.219 4、0.138 4、0.115 2 nm,分别对应六方晶型(Hexagonal)结构纳米银的(1, −1, 2)、(1, 1, 2)和(2, 0, 3)晶面。表明使用肿节风药渣合成的纳米银为六方晶型结构。此外,HRTEM测得的晶格条纹参数为0.256 5 nm,归属为(0, 0, 4)晶面,进一步证实合成的纳米银为六方晶型结构。
采用DLS表征纳米银表面性质,测量得到ζ电势为−22.2 mV(图2-F),表明合成的纳米银表面吸附的物质带负电荷,这些物质可能为倍半萜、香豆素、黄酮和皂苷等[25]。
有研究显示,如果纳米银的ζ电势大于25.0 mV或者小于−25.0 mV,因为同种电荷之间的排斥作用,纳米银有较好的稳定性。本实验合成的纳米银ζ电势接近−25.0 mV,因此可预期其好的稳定性。实际上,将合成的纳米银放置1个月后其平均粒径并未发现明显变化[(35.2±0.6)nm],也证实纳米银具有良好的稳定性。
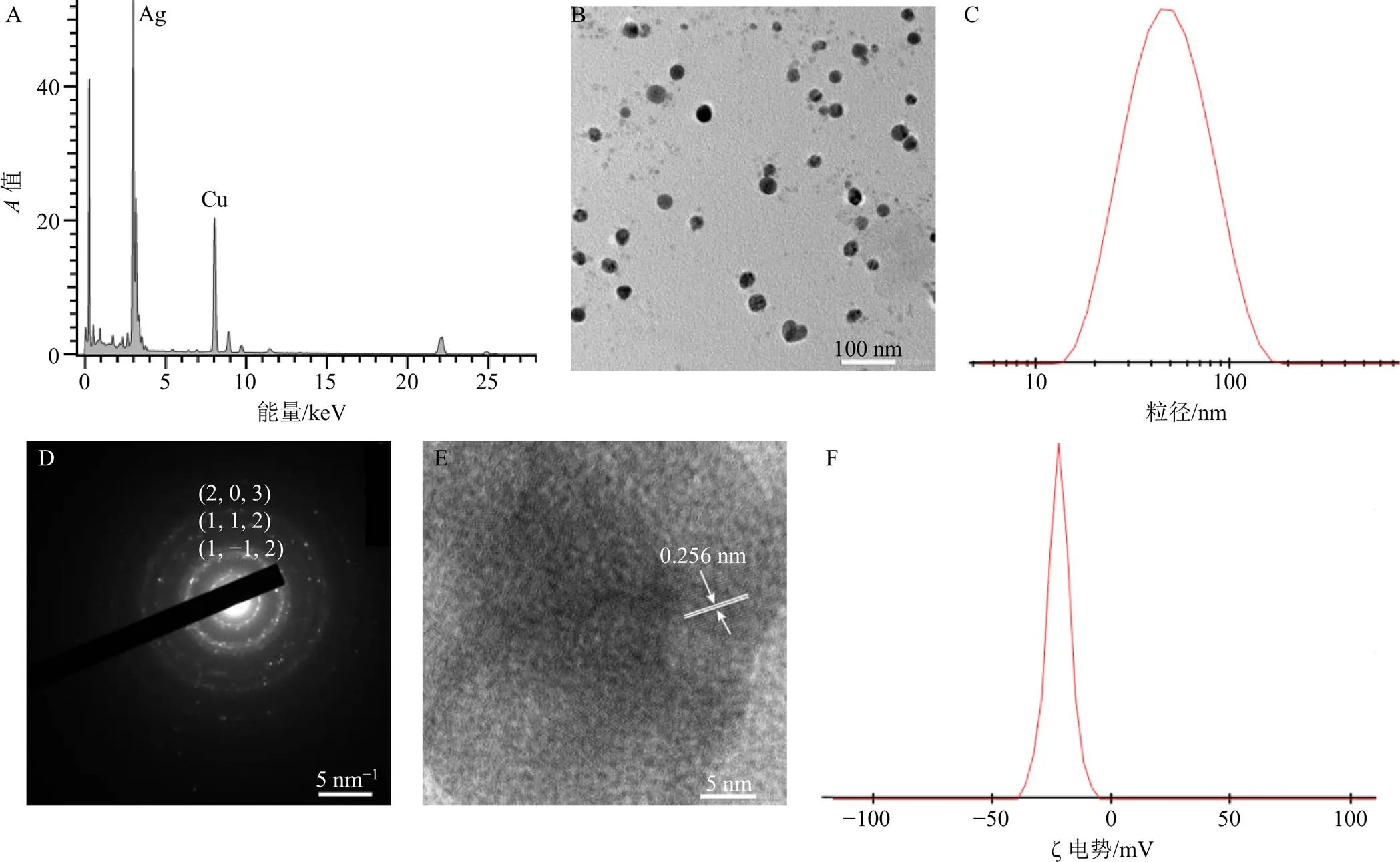
图2 纳米银的能谱(A)、TEM (B)、平均粒径(C)、选区电子衍射(D)、高分辨TEM(E)、ζ电势(F)
2.4 纳米银的抗癌活性
将纳米银配制成不同质量浓度的溶液,加入HepG2细胞系培养24 h。利用MTT法测量490 nm处的吸收强度,根据公式计算细胞存活率。
细胞存活率=(-b)/(0-b)
为纳米银+细胞吸光度,b为DMSO吸光度,0为细胞吸光度
如图3所示,在一定范围内,HepG2的存活率与纳米银质量浓度相关。当加入10.0 μg/mL纳米银后,HepG2细胞的存活率下降至78%,显示出抑制癌细胞增长的效果。当纳米银质量浓度增大至50.0 μg/mL后,HepG2细胞的存活率只有14%。继续增大纳米银质量浓度至100.0 μg/mL,HepG2细胞的存活率略降至10%。使用GraphPad Prism 8.0程序包拟合得纳米银对HepG2癌细胞系的半数抑制浓度(IC50)为44.22 μg/mL。
对不同质量浓度纳米银处理后的HepG2细胞形态学进行研究(图4)。从图4看出,HepG2细胞(0 μg/mL)形态规则、状态良好,呈网状分布;当加入20 μg/mL的纳米银后,有部分细胞皱缩变圆,从网状结构中脱离,可能是细胞膜结构遭到破坏使细胞间的突触折断导致;同时,在细胞内部观测到大量纳米银;增大纳米银质量浓度至40 μg/mL后,皱缩变圆且从网状结构中脱离的HepG2细胞数量明显增加,表明HepG2癌细胞更大范围死亡;当加入纳米银质量浓度超过IC50时,视野范围内很难观测到状态良好的HepG2细胞。该结果与MTT实验结果一致。
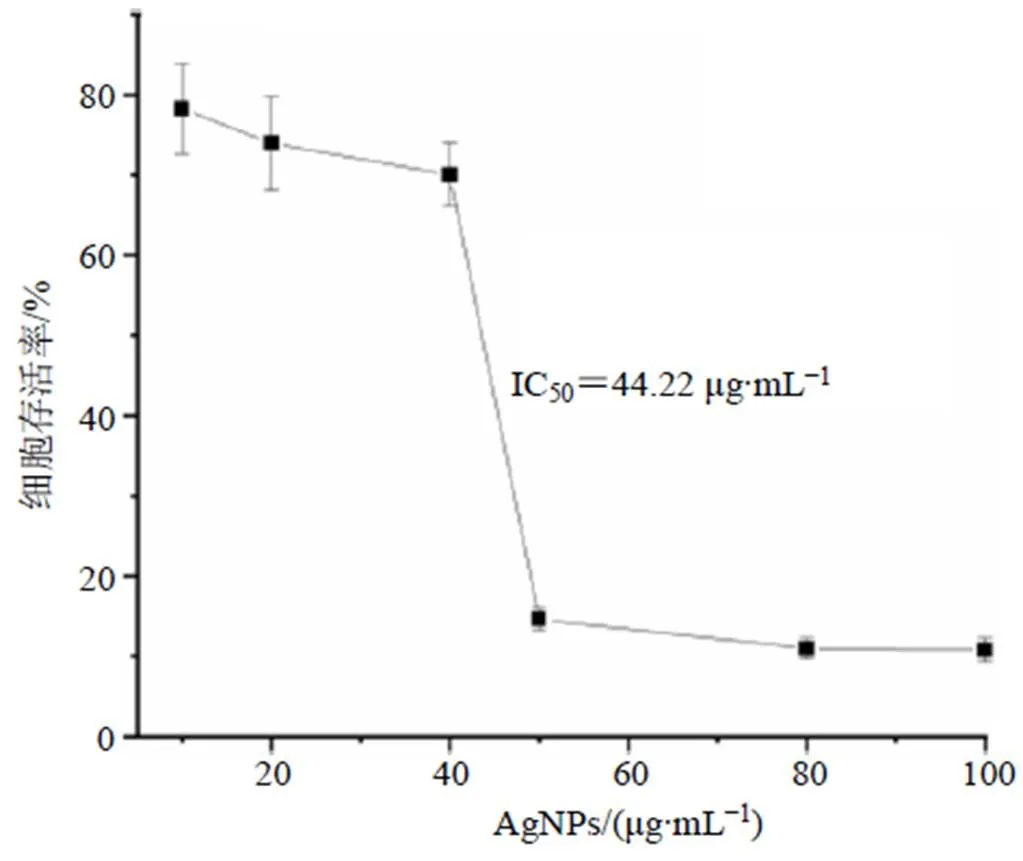
图3 纳米银对HepG2细胞的抑制作用
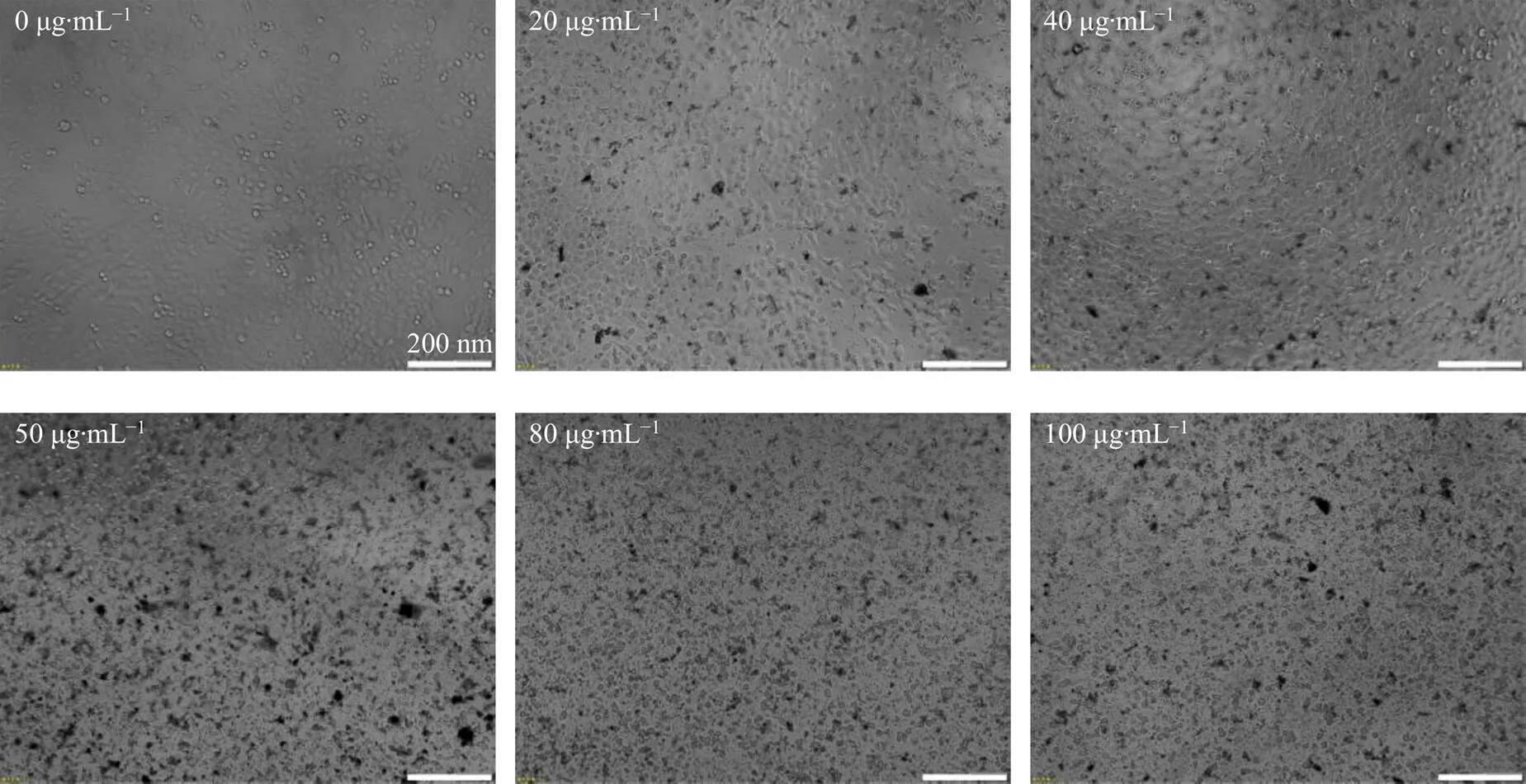
图4 不同质量浓度纳米银处理后HepG2细胞的形态 (图像放大倍数4)
本实验使用肿节风药渣合成的纳米银抗癌活性与传统中药,比如红叶苋(HeLa 51 μg/mL)[32]和山茱萸(HCT116 20.68 μg/mL,HepG2 69.72 μg/mL)等[18]基本一样,表明使用肿节风药渣合成的纳米银可以作为潜在的抗肿瘤药物。
2.5 纳米银抗癌机制初步探索
2.5.1 HepG2细胞对纳米银的内吞作用 通过流式细胞分析研究癌细胞对纳米银的内吞作用。将癌细胞种植在6孔板中,加入40 μg/mL纳米银培养12 h,然后使用流式细胞仪进行分析,激发光波长为488 nm。数据使用FlowJo 7.6.1程序包处理。
根据文献报道[33],纳米银会进入细胞,然后通过氧化应激等机制杀死细胞,所以为了初步揭示肿节风药渣合成的纳米银抗癌机制,首先研究HepG2细胞对纳米银的内吞作用。研究显示[34],将细胞暴露在纳米粒子中时,光散射信号可以提供细胞摄取纳米粒子的信息。当纳米粒子进入细胞后,其在细胞内的密度会增大,从而导致光散射信号增加。一般使用波长为488 nm的激光激发细胞后通过流式细胞仪探测激光垂直方向上光散射的信号(side scattering channel,SSC),用于评价细胞对纳米粒子的摄取水平。对纳米银处理后的HepG2细胞进行流式细胞分析,结果如图5-A、B所示。由图可知,与空白组相比较,加入40 μg/mL纳米银后,细胞SSC值从1.86%增加到4.08%。表明利用肿节风药渣合成的纳米银可以进入HepG2细胞,与观察细胞形态得出的结论一致。
2.5.2 活性氧物质的测量 纳米银处理HepG2细胞后活性氧物质(ROS)含量采用2′,7′-二氯荧光素-二乙酸酯(DCFH-DA)染色法检测。DCFH-DA是非极性化合物,能够迅速扩散到细胞内;当其进入细胞后会与酯裂解酶作用脱去乙酰基生成DCFH,DCFH会被细胞内的活性氧物质氧化生成DCF;DCF是绿色荧光分子,使用485 nm激光激发后在530 nm处具有强发光。因此可以使用荧光显微镜直接观察体系中活性氧物质的产生。将20.0、40.0 μg/mL纳米银加入HepG2细胞培养24 h,用无血清的培养基清洗细胞,然后加入10.0 μmol/L的DCFH- DA在37 ℃培养20 min。
如图6所示,随着体系中纳米银质量浓度增加,细胞内产生的绿色荧光物质DCF量逐渐增加,表明体系中产生的活性氧物质增加。该结果证实,纳米银处理后的HepG2细胞内产生了活性氧物质,且体系中产生的活性氧物质在一定范围内与加入的纳米银浓度呈正比。由此推测,使用本实验合成的纳米银处理HepG2细胞后,癌细胞死亡可能源于活性氧物质的产生。
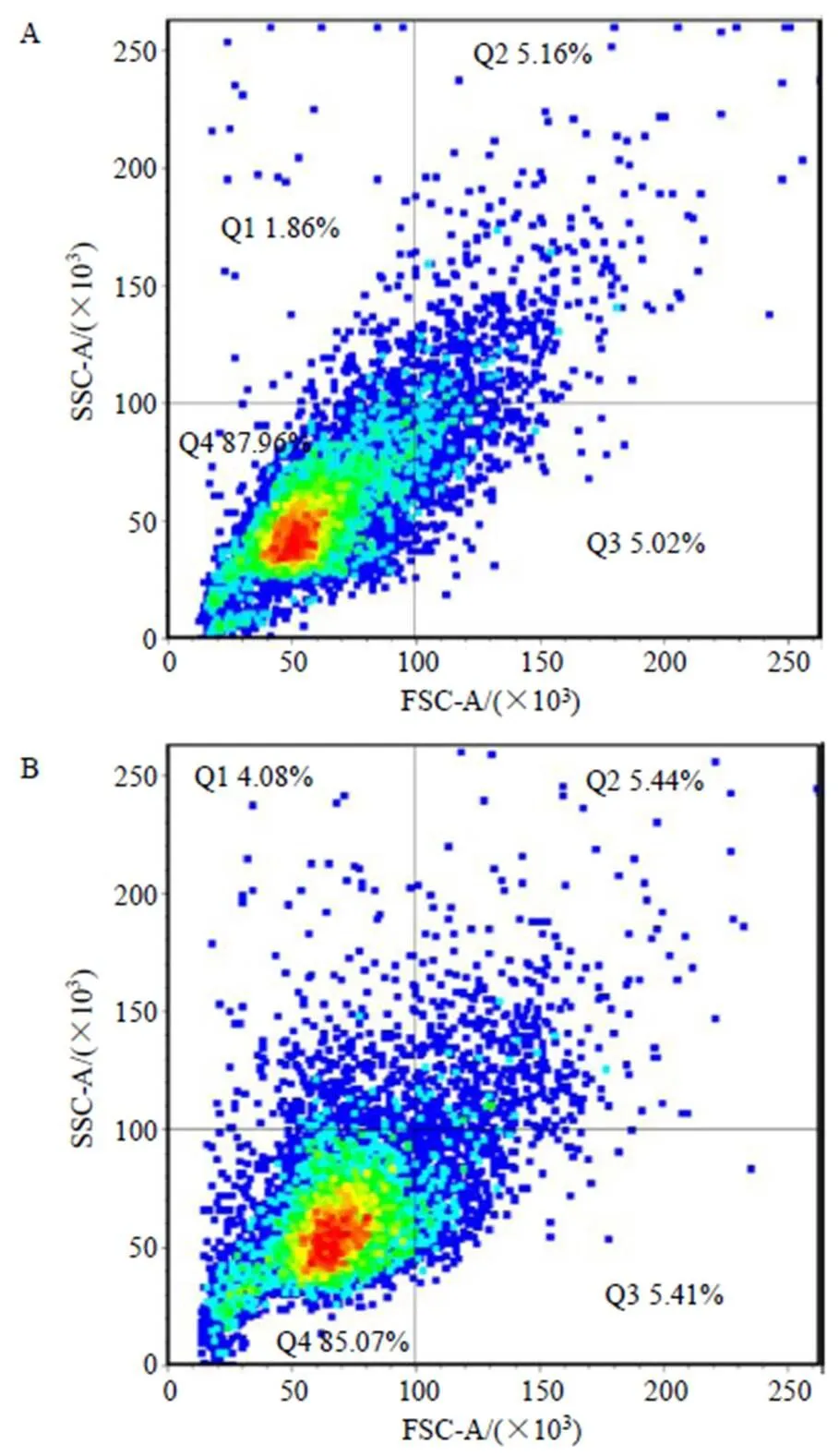
图5 0 (A)、40μg∙mL−1 (B) 纳米银处理后HepG2细胞对纳米银的内吞作用
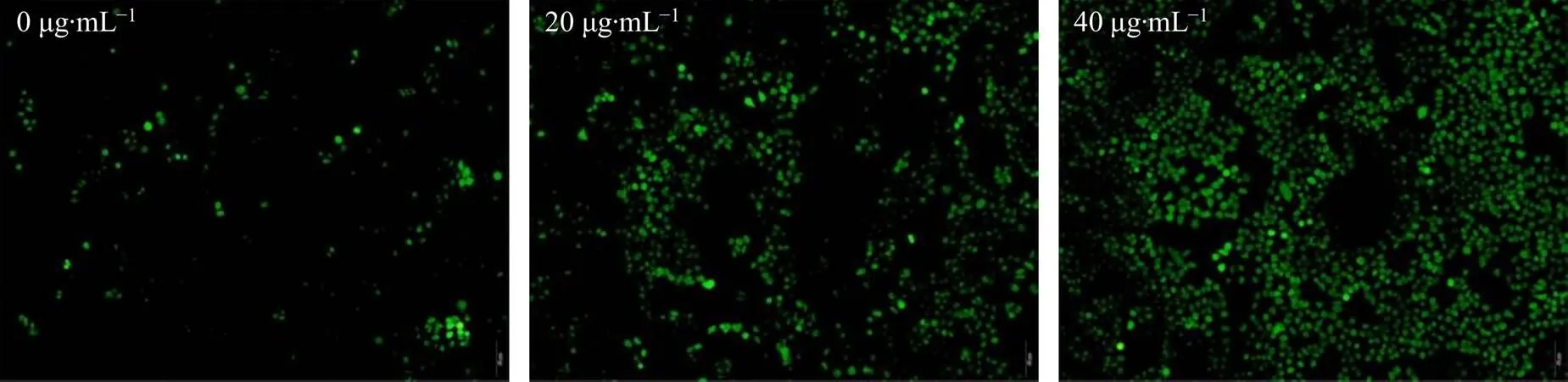
图6 DCFH-DA染色监测不同质量浓度纳米银处理24.0 h后HepG2细胞内的活性氧含量(图像放大倍数4)
3 讨论
本实验通过使用肿节风药渣提取液作为还原剂和保护剂,以AgNO3为银源,在室温超声条件下成功合成了纳米银;此方法有效改善了前期使用复方中药渣绿色合成纳米银时原材料组分不稳定的缺点。使用该方法合成的纳米银粒径分布在20~30 nm,分散状态良好,稳定性高,有望被发展成为一种绿色制备纳米银的方法。此外,抗癌活性研究表明,该方法获得的纳米银具有抗癌活性,这为此方法的推广应用提供了保障。抗癌机理的研究虽然在一定程度上反映了纳米银与癌细胞的相互作用机制,但是因为纳米粒子与癌细胞的作用机制很复杂,想要全面揭示该方法合成的纳米银与HepG2细胞的相互作用机制还需要进一步的研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Chen Y, Fan Z X, Zhang Z C,. Two-dimensional metal nanomaterials: Synthesis, properties, and applications [J]., 2018, 118(13): 6409-6455.
[2] Eckhardt S, Brunetto P S, Gagnon J,. Nanobio silver: Its interactions with peptides and bacteria, and its uses in medicine [J]., 2013, 113(7): 4708-4754.
[3] Yadi M, Mostafavi E, Saleh B,. Current developments in green synthesis of metallic nanoparticles using plant extracts: A review [J]., 2018, 46(Sup3): S336-S343.
[4] Akhtar M S, Panwar J, Yun Y S. Biogenic synthesis of metallic nanoparticles by plant extracts [J]., 2013, 1(6): 591-602.
[5] Jadhav K, Deore S, Dhamecha D,. Phytosynthesis of silver nanoparticles: Characterization, biocompatibility studies, and anticancer activity [J]., 2018, 4(3): 892-899.
[6] Wei L Y, Lu J R, Xu H Z,. Silver nanoparticles: Synthesis, properties, and therapeutic applications [J]., 2015, 20(5): 595-601.
[7] Zhao X X, Zhou L F, Riaz Rajoka M S,. Fungal silver nanoparticles: Synthesis, application and challenges [J]., 2018, 38(6): 817-835.
[8] Kumar B, Angulo Y, Smita K,. Capuli cherry- mediated green synthesis of silver nanoparticles under white solar and blue LED light [J]., 2016, 24: 123-128.
[9] Dhand V, Soumya L, Bharadwaj S,. Green synthesis of silver nanoparticles usingseed extract and its antibacterial activity [J]., 2016, 58: 36-43.
[10] Geethalakshmi R, Sarada D V L. Gold and silver nanoparticles fromdecandra: Synthesis, characterization, and antimicrobial properties [J]., 2012, 7: 5375-5384.
[11] Sreekanth T V M, Ravikumar S, Eom I Y. Green synthesized silver nanoparticles using Nelumbonucifera root extract for efficient protein binding, antioxidant and cytotoxicity activities [J]., 2014, 141: 100-105.
[12] Wang Y H, Wei S M. Green fabrication of bioactive silver nanoparticles usingextract under alkaline: An enhanced anticancer activity [J]., 2022, 7(1): 1494-1504.
[13] He Y Q, Li X, Zheng Y Y,. A green approach for synthesizing silver nanoparticles, and their antibacterial and cytotoxic activities [J]., 2018, 42(4): 2882-2888.
[14] Tarannum N, Divya D, Gautam Y K. Facile green synthesis and applications of silver nanoparticles: A state- of-the-art review [J]., 2019, 9(60): 34926- 34948.
[15] Islam R, Sun L M, Zhang L B. Biomedical applications of Chinese herb-synthesized silver nanoparticles by phytonanotechnology [J]., 2021, 11(10): 2757.
[16] Wei S M, Wang Y H, Tang Z S,. A size-controlled green synthesis of silver nanoparticles by using the berry extract of Sea Buckthorn and their biological activities [J]., 2020, 44(22): 9304-9312.
[17] 魏思敏, 王英辉, 唐志书, 等. 大枣水提液还原制备纳米银材料及抗氧化和抗菌活性研究 [J]. 天然产物研究与开发, 2020, 32(2): 182-189.
[18] Wang Y H, Wei S M, Wang K,. Evaluation of biosynthesis parameters, stability and biological activities of silver nanoparticles synthesized byOfficinalis extract under 365 nm UV radiation [J]., 2020, 10(45): 27173-27182.
[19] 魏思敏, 王英辉, 唐志书, 等. 紫外光辐射山茱萸水提液制备纳米银及生物活性 [J]. 高等学校化学学报, 2020, 41(6): 1391-1398.
[20] 魏思敏, 唐志书, 李慧敏, 等. 山茱萸水提液银纳米颗粒的制备及其抑菌活性的研究 [J]. 中草药, 2019, 50(1): 52-58.
[21] Cyranoski D. The big push for Chinese medicine for the first time, the World Health Organization will recognize traditional medicine in its influential global medical compendium [J]., 2018, 561(7724): 448-450.
[22] Zhou Y, Selvam A, Wong J W C. Effect of Chinese medicinal herbal residues on microbial community succession and anti-pathogenic properties during co- composting with food waste [J]., 2016, 217: 190-199.
[23] Wei S M, Wang Y H, Tang Z S,. A novel green synthesis of silver nanoparticles by the residues of Chinese herbal medicine and their biological activities [J]., 2021, 11(3): 1411-1419.
[24] 魏思敏, 王英辉, 唐志书, 等. 银翘解毒合剂药渣还原制备纳米银及抗氧化和抑菌活性研究 [J]. 中草药, 2020, 51(16): 4169-4175.
[25] 童胜强, 黄娟, 王冰岚, 等. 肿节风化学成分的研究 [J]. 中草药, 2010, 41(2): 198-201.
[26] Liu H Y, Zhang H, Wang J,. Effect of temperature on the size of biosynthesized silver nanoparticle: Deep insight into microscopic kinetics analysis [J]., 2020, 13(1): 1011-1019.
[27] He Y Q, Wei F F, Ma Z Y,. Green synthesis of silver nanoparticles using seed extract ofkatsumadai, and their antioxidant, cytotoxicity, and antibacterial activities [J]., 2017, 7(63): 39842-39851.
[28] Kaur G, Kalia A N, Sodhi H S. Size controlled, time-efficient biosynthesis of silver nanoparticles fromFlorida using ultra-violet, visible range, and microwave radiations [J]., 2020, 50(1): 35-41.
[29] Khan S, Singh S, Gaikwad S,. Optimization of process parameters for the synthesis of silver nanoparticles fromleaf aqueous extract, and evaluation of their antiphytofungal activity [J]., 2020, 27(22): 27221-27233.
[30] Polavarapu L, Mourdikoudis S, Pastoriza-Santos I,. Nanocrystal engineering of noble metals and metal chalcogenides: Controlling the morphology, composition and crystallinity [J]., 2015, 17(20): 3727-3762.
[31] Manosalva N, Tortella G, Cristina Diez M,. Green synthesis of silver nanoparticles: Effect of synthesis reaction parameters on antimicrobial activity [J]., 2019, 35(6): 88.
[32] Dipankar C, Murugan S. The green synthesis, characterization and evaluation of the biological activities of silver nanoparticles synthesized fromleaf aqueous extracts [J]., 2012, 98: 112-119.
[33] Xu L, Wang Y Y, Huang J,. Silver nanoparticles: Synthesis, medical applications and biosafety [J]., 2020, 10(20): 8996-9031.
[34] Suzuki H, Toyooka T, Ibuki Y. Simple and easy method to evaluate uptake potential of nanoparticles in mammalian cells using a flow cytometric light scatter analysis [J]., 2007, 41(8): 3018-3024.
Green synthesis of silver nanoparticles usingherb residues and anticancer activity
WANG Ying-hui1, ZOU Tai-yan2, SU Rui2, WEI Si-min2
1. College of Science, Chang’an University, Xi’an 710064, China 2. State Key Laboratory of Research & Development of Characteristic Qin Medicine Resources (Cultivation)/Shaanxi Innovative Drug Research Center, Co-construction Collaborative Innovation Center for Chinese Medicine Resources Industrialization by Shaanxi & Education Ministry, Shaanxi University of Chinese Medicine, Xianyang 712083, China
To develop a novel method to biosynthesize silver nanoparticles (AgNPs) by using the extractof single Chinese herbal waste to overcome the difficulty in obtaining raw materials. To evaluate the effect of biosynthesis parameters on the formation of AgNPs, average size and polydispersity, and investigating the anticancer activity.The formation of AgNPs was monitored by UV-visible spectroscopy; The average size, polydispersity, surface and morphology features of AgNPs were characterized by laser granularity analyzer and transmission electron microscopy; The anticancer activity of AgNPs were evaluated by MTT assay. The internalization of AgNPs inside HepG2 cancer cell line was determined by flow cytometric analysis. Reactive oxygen species (ROS) were measured by 2′,7′-dichlorofluorescein-diacetate staining.By using the extract ofherb residues, AgNPs could be prepared at ambient temperature under ultrasonic radiation. Biosynthesis of AgNPs- AgNO32∶1 at pH 7.0 would have the maximum efficiency. The AgNPs with small average size could be obtained at pH 10.0, extract-AgNO31∶1 or pH 7.0, extract-AgNO32∶1. But the AgNPs with superior polydispersity could be prepared under extract- AgNO32∶1. TEM, HRTEM and SAED characterization revealed that AgNPs (pH 7.0; material proportion 2∶1; 2.0 h) had a hexagonal structure, spherical shape with an average size of (34.0 ± 0.7) nm and existed in monodispersed form. The ζ potential of as-prepared AgNPs was −22.2 mV. The biosynthesized AgNPs displayed potent toxic effects against HepG2 cancer cell line with IC5044.2 μg/mL. The AgNPs as-prepared revealed significant uptake into cancer cell and could produce reactive oxygen species in HepG2 cancer cell lines.The extract ofresidues could be used to synthesize AgNPs at ambient temperature; The biosynthesis parameters have significant effects on the generation, average size and polydispersity of AgNPs; The biosynthesized AgNPs have potent anticancer activity, which may originate from the formation of ROS.
silver nanoparticles; single Chinese herbal; the residues of Chinese herbal medicine; green synthesis; biosynthesis parameter; anticancer activity; reactive oxygen species
R283.6
A
0253 - 2670(2022)07 - 1964 - 09
10.7501/j.issn.0253-2670.2022.07.005
2021-10-08
国家自然科学基金资助项目(22103007);陕西省高校科协青年人才托举计划(20190307);陕西省教育厅重点科研计划(21JY009);陕西省重点研发项目(2019SF-082);陕西省教育厅自然科学研究项目(19JK0233)
王英辉(1989—),男,博士,讲师,从事纳米材料的合成与表征研究。E-mail: wangyinghui@chd.edu.cn
魏思敏(1989—),女,硕士生导师,副教授,从事纳米材料的合成与表征研究。E-mail: weismiccas@163.com
[责任编辑 郑礼胜]

