铜绿假单胞菌对TLR4缺失鼠的致病性研究
白江松,张子卉,连朋敬,奚柳青,李静云,徐 彤,李鸿儒,张钟方,乔 健*
(1.中国农业大学动物医学院,北京 100193;2.河北北方学院动物科技学院,张家口 075000)
革兰阴性菌铜绿假单胞菌是一种机会致病菌,通常栖息在土壤和水环境的表面。它的适应性和固有的高抗药性使其能够在自然和人工环境中广泛生存[1]。铜绿假单胞菌感染会给养貂业带来巨大的经济损失,它能引起一种急性败血性传染病——水貂出血性肺炎。该病发病急、死亡快,常呈地方性爆发,发病貂死亡率在1%~50%[2]。自2000年以来,我国水貂感染铜绿假单胞菌的疫情报道逐渐增多,给养殖户造成了极大的经济损失,在山东、辽宁、河北、内蒙古等地均有报道[3]。铜绿假单胞菌也可以感染人,其严重感染通常是医院内感染,几乎所有铜绿假单胞菌感染的临床病例都与宿主防御能力受损有关,例如中性粒细胞减少、严重烧伤和囊性纤维化[4-6]。2017年,世界卫生组织将铜绿假单胞菌列为最危及生命的细菌之一和研发新型抗生素的优先病原体[7]。
Toll样受体(TLR)是Ⅰ型跨膜蛋白,是一类保守的模式识别受体(PRR),可被多种病原体相关分子模式(PAMPs)激活,从而在高等动物中引发先天性免疫应答和炎症[8]。据报道,在包括铜绿假单胞菌在内的革兰阴性细菌感染中,脂多糖(LPS)是细菌细胞壁的一种成分,它通过引起宿主炎症反应并诱导全身性炎症而引起急性器官损伤和败血症[9]。LPS主要通过激活Toll样受体4(TLR4)引起急性免疫应答[10]。一项研究表明,人肺泡巨噬细胞和单核细胞中TLR4 mRNA的表达水平在LPS暴露1 h后增加,而在LPS 暴露24 h后又降低,这表明LPS双相地影响肺泡巨噬细胞中TLR4的表达水平[11]。在铜绿假单胞菌的肺炎动物模型中,炎性细胞因子的释放和积累主要发生在被感染的肺泡中,肺中产生的炎性细胞因子能够传播到被铜绿假单胞菌分泌的毒素所破坏的整个肺上皮循环中,从而导致败血性休克[12]。近来,一些研究强调了TLR4在肺炎模型中的炎症作用。在肺部感染期间,IL-27通过促进TLR4表达,在肺成纤维细胞中增强了LPS诱导的促炎细胞因子IL-6和IL-8的产生[13]。还有研究表明,TLR4激活导致对机体有害的炎症应答[14]。因此,LPS-TLR4信号引发的过度炎症似乎是导致细菌性肺炎患者死亡的重要原因。
但是,LPS-TLR4信号传导的阻断可能是有害的,因为通过TLR4识别细菌LPS以及随后感染宿主中的促炎性反应对于抵抗病原体的先天免疫力至关重要。有研究发现,术后发生肺炎的患者的肺泡巨噬细胞中TLR4表达降低,这表明TLR4表达降低介导的局部免疫抑制是术后的危险因素[15]。此外,有研究表明存在TLRs的内源性配体[16],这意味着TLR信号不仅在针对感染性微生物的炎症和免疫反应中具有调节作用,而且还在针对内源性有害刺激的炎症和免疫反应中具有调节作用。基于这些报道,TLR4在感染性肺炎中具有双重作用。但TLR4仍然是抑制不良炎症反应的潜在靶标。
本研究使用致死剂量的铜绿假单胞菌对TLR4缺陷C3H/HeJ小鼠和野生型C3H/HeN小鼠进行感染,通过评估各组小鼠临床症状、存活率、肺病变程度、肺部细胞因子含量的动态变化来探讨TLR4对铜绿假单胞菌感染小鼠致病性的影响,有助于进一步了解铜绿假单胞菌感染的致病机理以及TLR4在铜绿假单胞菌感染引起的肺损伤中的作用,进而采取有效手段预防和治疗铜绿假单胞菌感染引起的肺损伤。
1 材料与方法
1.1 试验材料与实验动物
本试验采用购自广东环凯微生物科技有限公司的铜绿假单胞菌冻干粉,菌株标准编号:FSCC 206003,批号:B0102B。6~8周龄,18~21 g雄性C3H/HeJ和C3H/HeN小鼠各21只,野生型小鼠购自北京维通利华实验动物技术有限公司;TLR缺陷小鼠购自南京大学模式动物研究所,该小鼠Tlr4基因的cDNA的2342处发生由胞嘧啶突变为腺嘌呤的点突变,该突变导致TLR4受体蛋白的胞质TIR区712位点处保守的脯氨酸被组氨酸取代,而脯氨酸是TLR4信号通路的重要组成部分,从而导致TLR4信号通路的功能缺失。0.9% NaCl溶液购自石家庄四药有限公司。LB固体培养基购自北京路桥技术有限公司。小鼠TNF-α ELISA检测试剂盒(货号BMS607/3)购自eBioscience公司。小鼠IL-1β ELISA检测试剂盒(货号MLB00C)购自R & B system公司。
1.2 试验分组及样本采集
将C3H/HeJ小鼠和C3H/HeN小鼠各21只,随机按如下分组。C3H/HeJ和C3H/HeN感染组,每组18只小鼠,每只小鼠滴鼻接种100 μL铜绿假单胞菌浓度为1.8×108个·mL-1的细菌悬液。C3H/HeJ和C3H/HeN对照组,每组3只小鼠,每只小鼠滴鼻接种100 μL 0.9% NaCl溶液。感染细菌后0、8、16、32、54 h监测各组小鼠体温、体重变化,感染后72 h内观察并记录小鼠的精神状态和死亡情况。计算各组小鼠的中位生存期,即恰好有50%的个体尚存活的时间。中位生存期越长,表示疾病的预后越好;中位生存期越短,预后越差。在小鼠细菌感染后8、16、32 h进行采样,每次采样时在感染组随机选择3只小鼠,称重,麻醉后脱颈处死,采集肺组织,观察记录肺大体病理变化。称量肺重,计算肺系数(肺系数=肺湿重/体重×100%),观察记录肺大体病理变化。

表1 试验分组设计
1.3 肺组织病理切片的制作及HE染色
在细菌感染后16 h,采集各组小鼠肺组织。分离左、右肺,将左肺置于4 %多聚甲醛溶液中固定1周后,经冲洗、脱水、透明、浸蜡、包埋、切片、展片、苏木素-伊红染色、封片步骤,制作组织切片并观察。
1.4 肺组织细菌载量的测定
在细菌感染后8、16、32 h,采取各组肺组织,将肺组织在PBS中研磨,定容至4 mL,获得肺组织匀浆。10×倍比稀释至10-6。每个稀释度(包括原液)取100 μL于LB营养琼脂平板上,涂布培养24 h,菌落数在30~300个之间计数,计算细菌载量。
1.5 ELISA法测定肺组织匀浆中TNF-α、IL-1β含量
在细菌感染后8、16、32 h,采集各组肺组织,将肺组织在PBS中研磨,定容至4 mL,获得肺组织匀浆。并以5 000 r·min-1离心10 min,取上清进行检测。按照小鼠TNF-α和IL-1β ELISA检测试剂盒说明书操作,根据标准品数据在GraphPad Prism8上拟合曲线并计算待测样品含量。
1.6 统计学分析
所有试验数据均用“平均值±标准差”表示,采用GraphPad Prism8进行数据分析,并使用t检验分析两组间差异性,AVONA分析多组间差异性,以P>0.05为不存在显著差异,以P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 试验动物精神状态
TLR4缺失型鼠C3H/HeJ对照组和野生型C3H/HeN对照组,临床表现正常。TLR4缺失型鼠C3H/HeJ感染组和野生型C3H/HeN感染组,在接种铜绿假单胞菌8 h后均出现精神沉郁、活动减少、被毛粗糙的现象。细菌感染24 h时,C3H/HeJ感染组和野生型C3H/HeN感染组小鼠均表现出明显呼吸困难,C3H/HeJ感染组小鼠扎堆现象更为严重。
2.2 小鼠体温与体重变化
由图1可知铜绿假单胞菌感染后,两个对照组小鼠体温无明显变化,均在正常范围内。TLR4缺失C3H/HeJ感染组小鼠在感染后8 h内,体温急剧下降,感染后8~16 h,体温以较快速度回升,之后缓慢回升,到54 h时,体温接近正常水平。野生型C3H/HeN小鼠在感染后8 h内体温下降,但下降幅度远小于C3H/HeJ感染组小鼠,随后体温平缓地持续下降,到54 h时,体温低于正常水平。感染后8 h,C3H/HeJ感染组小鼠体温显著低于C3H/HeN感染组小鼠(P<0.01)。感染后54 h时,C3H/HeJ感染组小鼠体温显著高于C3H/HeN感染组小鼠(P<0.01)。两个对照组小鼠体重平缓上升,而铜绿假单胞菌感染后,两个感染组小鼠体重大幅下降。

**.P<0.01。下同

图2 铜绿假单胞菌感染后小鼠体重变化
2.3 存活率
接种铜绿假单胞菌后,TLR4缺失型C3H/HeJ感染组的8只小鼠中陆续死亡7只,存活1只,存活率为12.5%,中位生存期为27 h。野生型C3H/HeN感染组的8只小鼠陆续死亡7只,存活1只,存活率为12.5%,中位生存期为45 h。TLR4缺失型C3H/HeJ感染组小鼠先于野生型C3H/HeN感染组小鼠死亡。两个对照组小鼠存活率为100%(图3)。

图3 铜绿假单胞菌感染后小鼠生存曲线
2.4 肺大体病变和组织病理学变化
如图4,C3H/HeJ对照组和C3H/HeN对照组的小鼠肺组织无眼观病理变化。C3H/HeJ感染组与C3H/HeN感染组小鼠表现出肺体积增大,边缘钝圆。细菌感染后8 h,C3H/HeN感染组小鼠肺表面仅有少数淤血点;而C3H/HeJ感染组小鼠肺充血淤血严重。细菌感染后16 h,眼观两个感染组病变程度类似,表现为肺体积增大,边缘钝圆,表明有许多出血点。细菌感染后32 h,C3H/HeN感染组小鼠肺出现大面积实变区域,而C3H/HeJ感染组小鼠肺基本恢复正常(图4)。
组织学观察表明(图5),接种铜绿假单胞菌后16 h,C3H/HeJ感染组和C3H/HeN感染组的小鼠肺都有明显的病变,表现为肺间质增厚,肺泡毛细血管淤血、出血,肺泡中大量嗜中性粒细胞、淋巴细胞、巨噬细胞浸润。其中,C3H/HeN感染组小鼠肺组织学病变更为严重,肺间质严重增厚,肺基本结构丧失。

图5 铜绿假单胞菌感染后16 h小鼠肺病理切片(50×和100×)
2.5 肺水肿程度变化
如图6,铜绿假单胞菌感染后8 h,C3H/HeN感染组小鼠肺系数高于C3H/HeN对照组小鼠(P<0.05),C3H/HeJ感染组小鼠的肺系数极显著高于C3H/HeJ对照组小鼠的肺系数(P<0.01),C3H/HeJ感染组小鼠肺系数高于C3H/HeN感染组(P<0.05)。随后C3H/HeN感染组小鼠肺系数在16和32 h逐渐增加,在32 h其肺系数高于C3H/HeJ感染组,但差异不显著(P>0.05)。因铜绿假单胞菌感染而死亡的小鼠,C3H/HeN感染组小鼠的肺系数高于C3H/HeJ感染组小鼠的肺系数,差异极显著(P<0.01,图7)。
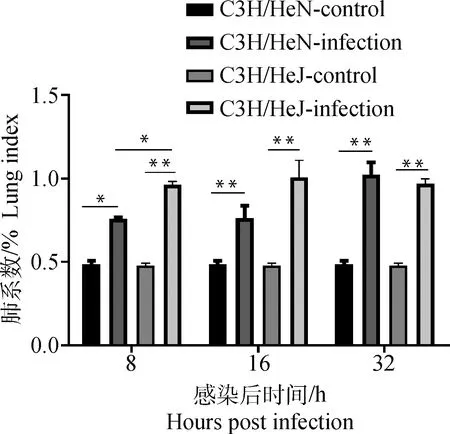
图6 铜绿假单胞菌感染后小鼠肺系数

图7 铜绿假单胞菌感染后死亡小鼠肺系数
2.6 肺部细菌载量变化
肺部细菌载量代表肺部对细菌的清除能力,能直接反映机体的抵抗力。与C3H/HeN感染组相比,感染后8 h,C3H/HeJ感染组小鼠肺细菌载量显著增加(P<0.05)。感染后16、32 h,C3H/HeJ感染组小鼠肺细菌载量均高于C3H/HeN感染组,但差异不显著(P>0.05,图8)。

图8 铜绿假单胞菌感染后小鼠肺部细菌载量
2.7 肺匀浆TNF-α、IL-1β含量比较
由图9可知,感染铜绿假单胞菌后,野生型C3H/HeN小鼠和TLR4突变型C3H/HeJ小鼠肺匀浆中TNF-α含量均极显著上升(P<0.01)。感染后8 h,测得C3H/HeN感染组小鼠肺匀浆中TNF-α浓度最高,而后随时间增加逐渐降低。而C3H/HeJ感染组小鼠在所测的3个时间点,肺匀浆中TNF-α浓度变化不大。感染后8 h,C3H/HeN感染组小鼠肺匀浆中TNF-α浓度极显著高于C3H/HeJ感染组小鼠(P<0.01)。

图9 铜绿假单胞菌感染后小鼠肺部细胞因子的变化
感染铜绿假单胞菌后,野生型C3H/HeN小鼠和TLR4突变型C3H/HeJ小鼠肺匀浆中IL-1β含量均极显著上升(P<0.01)。感染后8 h,测得C3H/HeN感染组小鼠肺匀浆中IL-1β浓度最高,而后随时间增加而降低。感染后8、32 h,C3H/HeN感染组小鼠肺匀浆中IL-1β浓度显著高于C3H/HeJ感染组小鼠(P<0.01、P<0.05)。
3 讨 论
LPS是细菌中研究最深入的免疫刺激成分之一,可以诱发全身性炎症和败血症[17]。Beutler和Rietschel[18]使用已知对LPS应答有缺陷的C3H/HeJ小鼠品系,证明TLR4是LPS的重要识别受体。本研究旨在了解TLR4信号通路在铜绿假单胞菌感染所致急性肺损伤中的作用,本试验对TLR4缺陷C3H/HeJ小鼠和野生型C3H/HeN小鼠感染致死剂量铜绿假单胞菌的致病性进行了比较。结果表明,与野生型C3H/HeN小鼠相比,TLR4缺陷型C3H/HeJ小鼠在铜绿假单胞菌感染后临床症状更为严重,感染后8 h,C3H/HeJ小鼠体温急速下降,显著低于C3H/HeN感染组小鼠体温。另外,TLR4缺陷型C3H/HeJ小鼠的中位生存期为27 h,显著短于C3H/HeN小鼠45 h的中位生存期。肺大体病变及肺系数的结果表明,感染后8 h,C3H/HeJ小鼠肺水肿及病变程度显著高于野生型C3H/HeN小鼠。这些结果均表明TLR4缺陷型小鼠对铜绿假单胞菌的抵抗力较弱。
本研究发现,与野生型C3H/HeN小鼠相比,在感染后8 h,C3H/HeJ小鼠肺组织中TNF-α和IL-1β显著降低。有研究表明,TNF-α通过结合并聚集大多数细胞膜上大量存在的高亲和力受体发挥作用[19],激活许多次级蛋白,这些蛋白会激活细胞内的各种反应,例如激活基因转录、产生活性氧以及氮自由基[20]。TNF-α可能通过中性粒细胞和血小板的活化,巨噬细胞和NK细胞杀伤能力的增强以及对免疫系统的刺激而对感染产生抵抗力[21]。IL-1β是关键的免疫调节和促炎细胞因子,被caspase-1加工,并在炎性小体中被激活[22]。IL-1β促进单核细胞分化为树突状细胞和M1样巨噬细胞,并促进活化B淋巴细胞的增殖和分化[23-24]。促炎性因子TNF-α和IL-1β显著降低,表明机体抵抗铜绿假单胞菌感染的能力减弱。细菌载量的结果也与其一致,C3H/HeJ小鼠肺组织细菌载量显著高于野生型C3H/HeN小鼠,表明TLR4缺陷型C3H/HeJ小鼠体内细菌清除能力受损。这些结果表明,TLR4信号传导在宿主对抗铜绿假单胞菌感染的保护性免疫反应中发挥了重要作用。有研究表明,与 TLR4野生型小鼠相比,TLR4突变小鼠对丁基化羟基甲苯(BHT)诱导的肺炎更易感[25]。而且BHT处理后,TLR4 野生型小鼠中独特的先天免疫细胞群与TLR4 突变小鼠中的不同[25]。此外,TLR4 在革兰阴性菌的吞噬中也起着至关重要的作用[26]。
先天和适应性免疫系统通过发现、中和、破坏或排出病原体,有助于宿主抵抗感染[27-29]。但对病原体的破坏和消除常常伴随着正常组织结构或功能的损伤[30-31]。本研究发现,和C3H/HeJ小鼠相比,虽然野生型C3H/HeN小鼠感染铜绿假单胞菌的致病性和细菌载量更低,但感染后期的组织学病变及肺水肿程度更严重,表明野生型小鼠肺损伤更严重。细菌抗原通过激活Toll样受体产生的促炎细胞因子,使转录因子NF-κB和AP-1表达上调,诱导介导炎症反应的其他细胞因子的合成,使肺毛细血管通透性增加,并从循环中募集中性粒细胞[32]。由于炎症介质、毒素、蛋白酶导致的肺细胞死亡使肺泡上皮基底膜暴露,使肺损伤进一步加重[33]。募集的中性粒细胞,进一步产生其他细胞因子,放大和维持炎症,对肺组织造成持续的损伤[32]。免疫防御对宿主产生的这种负面影响被称为免疫病理[34],细菌对宿主的致病性是宿主免疫防御与免疫病理共同作用的结果,最佳的免疫应答应使有效病原体清除力和免疫病理达到平衡。因此,需要更深入地研究TLR4信号的调节靶点,以治疗严重细菌感染。
4 结 论
致死剂量的铜绿假单胞菌感染后,相比于野生型小鼠,TLR4缺失型小鼠临床症状更为严重,存活时间缩短,细菌载量增高,促炎性细胞因子的产生减少。TLR4蛋白缺失显著增加了铜绿假单胞菌对小鼠的致病性,表明TLR4在宿主对抗铜绿假单胞菌感染的保护性免疫反应中发挥了重要的作用。

