鸡circ_PLXNA1鉴定及其在脂肪细胞分化中的功能预测
杨 婷,王来娣,胡晓丹,袁春友,白 皓,2,王志秀,江 勇,陈国宏,2,常国斌*
(1.江苏省动物遗传育种与分子设计重点实验室,扬州大学动物科学与技术学院,江苏 扬州 225009;2.教育部农业与农产品安全国际合作联合实验室,扬州大学农业科技发展研究院,江苏 扬州 225009)
环状RNA(circRNA)是继microRNA(miRNA)和长链非编码RNA(lncRNA)之后另一种新型内源性非编码RNA(ncRNA)。Sanger等首先在病毒中发现circRNA[1]。circRNA最初被认为是错误剪接产生的副产物或在mRNA合成过程中产生,不具有生物学功能[2]。随着测序技术和生物信息学技术发展,circRNA被发现广泛存在于人类、斑马鱼、小鼠、猪、鸡等多种真核生物中。由于circRNA无5´端、3´端和poly A尾,可避免核糖核酸酶R(RNase R)等核酸外切酶切割,因此比线性RNA更稳定。部分研究在人类口腔唾液中检测到超过400个circRNAs[3],高度稳定。此外,circRNA还具有细胞和组织特异性及时间特异性[4],生产效率一般高于线性同源mRNA,更稳定、保守,但一般不具有翻译功能[6]。
CircRNA可通过多种方式发挥作用,吸附miRNA(ceRNA)调节靶基因表达,与RNA结合蛋白结合。Xiong等发现circRNA0025813通过吸附miR-122调节其靶基因Cpeb1和Plp2表达参与肝细胞癌发生发展[7],Stoll等发现circHIPK3通过结合miR-124-3p和miR-338-3p增加Slc2a2、Akt1和Mtpn表达,增强胰岛素分泌以及β细胞活性[8]。
脂肪组织在维持机体稳态和提高肉质方面发挥重要作用,但过多异位脂肪沉积影响饲料转化率,与疾病发生密切相关。目前家禽中circRNA研究主要集中在肌肉发育[9],生长发育[10],繁殖性能和疾病预防[11],在家禽脂肪细胞分化中的作用机制研究相对较少。本课题组前期研究发现鸭circ_PLXNA1在鸭脂肪细胞分化中起重要作用[12]。另外,本课题组前期DF-1细胞转录组测序中也筛选到该circRNA,发现鸭circ_PLXNA1与鸡circ_PLXNA1具有高度同源性,且鸭circ_PLXNA1在脂肪细胞分化中有重要作用。本研究选择鸡circ_PLXNA1作验证分析,为进一步研究circRNA在鸡脂肪细胞分化中作用奠定基础。
1 材料与方法
1.1 材料
本研究以购自美国ATCC公司DF-1细胞为试验材料,验证鸡circ_PLXNA1在细胞水平中的表达。采集3只成年公鸡心脏、肝脏、脾脏、肺、肾脏、淋巴、法氏囊等组织,保存于-80℃条件下用于后期组织总RNA提取。Trizol试剂(购自Invitrogen,美国);2X Taq聚合酶(购自诺唯赞生物科技公司,中国南京);血液/细胞/组织基因组DNA提取试剂盒和FastKing一步基因组cDNA第一链合成预混试剂(购自天根生化科技,中国北京);TB Green qPCRPremix[购自宝日医生物技术(北京)有限公司,中国北京];RNase R(购自Epicenter公司,瑞典);琼脂糖(购自Bio-Rad,美国);PBS和DMEM(购自Hyclone,美国);胎牛血清(购自GIBICO,美国)。
1.2 方法
1.2.1 引物设计
基于鸡PLXNA1基因序列(Gene ID:416030)和鸡circ_PLXNA1接头序列和线性序列,使用Primer 5.0软件设计发散引物和收敛引物,其中发散引物也可用于定量PCR。鸡circ_PLXNA1和GAPDH引物序列如表1所示。
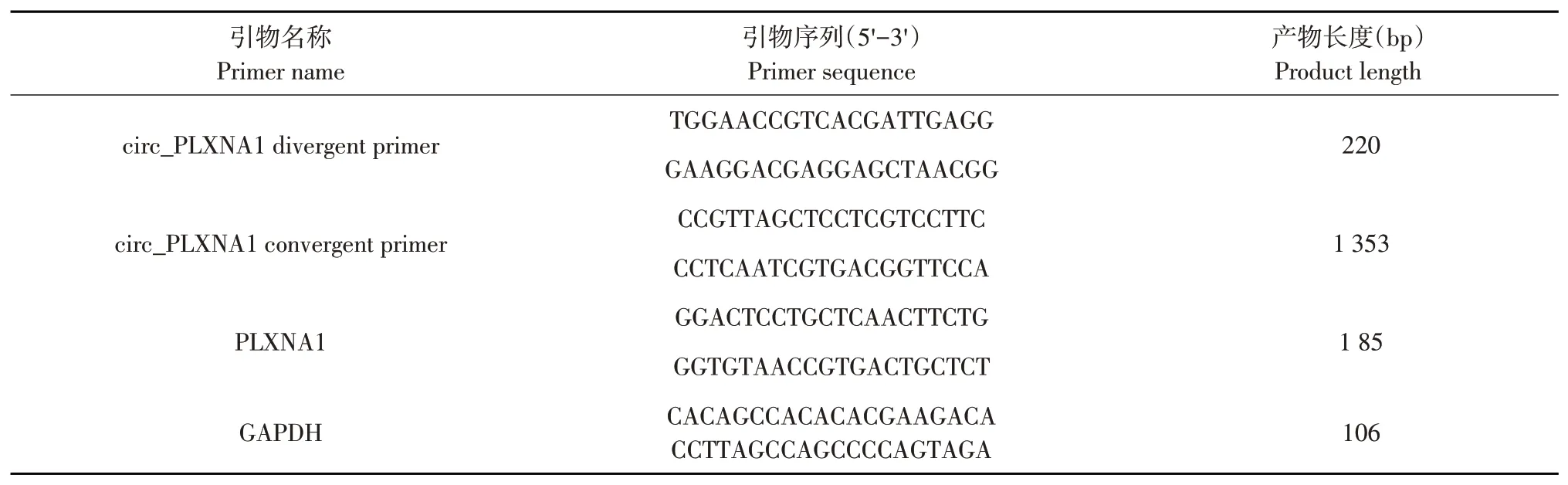
表1 PCR引物设计Table 1 Primersdesign for PCR experiments
1.2.2 DF-1细胞培养
DF-1细胞培养在添加10%FBS的DMEM完全培养基中,放置在温度为38.5℃,CO2浓度为5%,湿度为60%~70%培养箱中。
1.2.3 gDNA提取
当DF-1细胞融合度达90%时,收集细胞,按照血液/细胞/组织基因组DNA提取试剂盒说明书提取基因组DNA(gDNA)。
1.2.4 circ_PLXNA1验证
以肝脏组织cDNA为模板,使用收敛引物和发散引物通过PCR扩增目的片段。以gDNA为模板,使用收敛引物和发散引物通过PCR扩增目的片段。目的片段扩增完成后进行琼脂糖凝胶电泳,相应PCR产物送由擎科生物技术公司(中国北京)测序。
1.2.5 总RNA提取及质量检测
使用TRIzol试剂(Life Technologies,Carlsbad,CA)提取总RNA,使用Nanodrop ND-1000微型分光光度计检测提取的RNA质量和浓度。RNA的A260/280吸光度比值在1.8~2.1之间,A260/230大于2.0。
1.2.6 定量PCR分析
使用带有gDNA Eraser(TaKaRa)的PrimeScript RT试剂盒合成cDNA后,用SYBR Premix ExTaqII试剂(TaKaRa,Shiga,日本)和QuantStudio 5实时PCR仪器进行定量PCR分析。引物组使用Primer 5.0和Oligo 7设计,由擎科生物技术(中国北京)合成;作3次重复测定(表1提供引物序列)。
1.2.7 RNase R消化试验
将2.5μg总RNA与3 U·μg-1RNase R(Epicentre Technologies,Madison,WI)或作为对照的无酶水在37℃下孵育30 min,70℃,10 min酶灭活。重新提取RNA并反转录为cDNA,定量PCR检测鸡circ_PLXNA1和PLXNA1 mRNA表达情况。
1.2.8 核质分离试验
使用NE-PER细胞核和细胞质提取试剂(Thermo Scientific)按照说明书操作步骤分别提取细胞核和细胞质部分,-80℃保存备用。使用Trizol试剂提取细胞核和细胞质部分RNA,定量PCR检测鸡circ_PLXNA1和PLXNA1 mRNA在细胞核和细胞质中的表达情况。
1.2.9 生物信息学分析
Miranda(http://cbio.mskcc.org/microrna_data/mi Randa-aug2010.tar.gz)、miRDB(http://mirdb.org/)和Target Scan Human 7.2(http://www.targetscan.org/vert_72/)3个软件用于预测鸡circ_PLXNA1靶向miRNA及其对应靶基因,使用Cytoscape 3.7.1(https://cytoscape.org/download.html)软件对预测到的miRNA及其对应靶基因构建circ_PLXNA1/miRNA/mRNA的ceRNA网络,最后使用在线软件(http://enrich.shbio.com/index/ga.asp)对预测目标基因作GO和KEGG分析。
1.2.10 统计分析
荧光定量PCR数据结果采用2-ΔΔCt法分析。使用SPSS 22.0和GraphPad Prism 8软件(GraphPad Software Inc,San Diego,CA)单因素方差分析对荧光定量PCR数据作统计分析,并表示为mean±SD。P<0.05代表显著差异。
2 结果与分析
2.1 鸡circ_PLXNA1鉴定和稳定性检测
本课题组前期研究发现鸭circ_PLXNA1在鸭脂肪细胞分化中发挥重要作用。在DF-1细胞转录组测序中也筛选到这个circRNA,同时鸭circ_PLXNA1与鸡circ_PLXNA1具有91%同源性(见图1),因此筛选鸡circ_PLXNA1作验证分析。基因组结构显示鸡circ_PLXNA1是一个外显子型环状RNA(见图2),由来自PLXNA1基因外显子1和外显子2以及部分5´UTR序列组成,总长为1 533 bp(见图3A)。以cDNA为模板,对使用发散引物扩增序列进行sanger测序,结果表明该扩增序列与高通量测序得到序列一致,且剪接点前面和剪接点后面序列分别是AG和GG(见图3B)。如图4所示,发散引物从cDNA上扩增出目的片段而无法从gDNA上扩增出目的片段,而收敛引物既可从cDNA上扩增出目的片段,也可从gDNA上扩增出目的片段(由于收敛引物是跨内含子设计,所以收敛引物在gDNA上扩增的目的片段较长,收敛引物在gDNA上扩增的目的片段未能在琼脂糖凝胶电泳图上显示)。该结果均证实鸡circ_PLXNA1的存在。

图1 鸡circ_PLXNA1和鸭circ_PLXNA1序列比较Fig.1 Comparison of the sequence of duck circ_PLXNA1 and chicken circ_PLXNA1
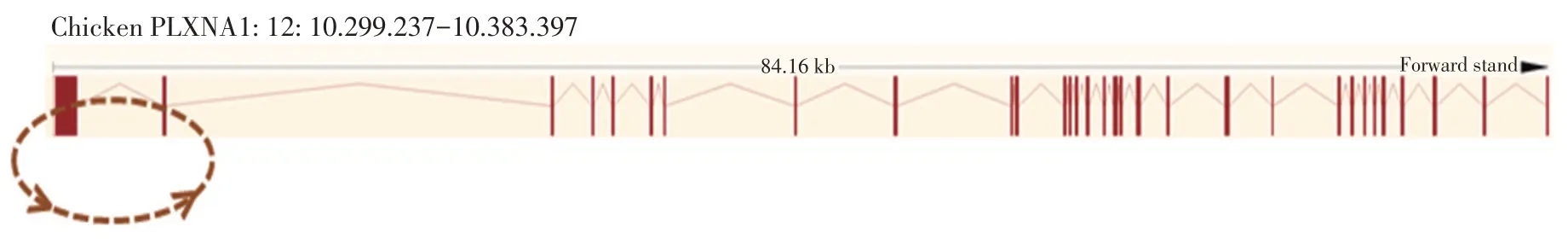
图2 鸡circ_PLXNA1基因组结构Fig.2 Genomic structureof chicken circ_PLXNA1

图3 鸡circ_PLXNA1模式图及接头序列测序峰图Fig.3 Chicken circ_PLXNA1 pattern maps and conjugated sequence sequencing peaks

图4 鸡circ_PLXNA1琼脂糖凝胶电泳Fig.4 Chicken circ_PLXNA1 agarose gel electrophoresis
2.2 鸡circ_PLXNA1稳定性检测和亚细胞定位
采用RNase R外切核酸酶消化RNA,进一步确定鸡circ_PLXNA1稳定性。qRT-PCR结果表明,鸡circ_PLXNA1对RNase R消化抗性较高,而相关线性转录物(PLXNA1 mRNA)则显著降解(见图5),证明鸡circ_PLXNA1具有稳定环状结构。

图5 鸡circ_PLXNA1在RNase R处理组与对照组相对表达量比较Fig.5 Comparison of the relative expression of chicken circ_PLXNA1 in RNase R-treated and control group
对DF-1细胞进行细胞核和细胞质分离后,提取相应核和质RNA,通过定量PCR检测鸡circ_PLXNA1和PLXNA1 mRNA在细胞核和细胞质中表达情况。定量PCR结果分析表明,鸡circ_PLXNA1主要定位于细胞质中(见图6)。
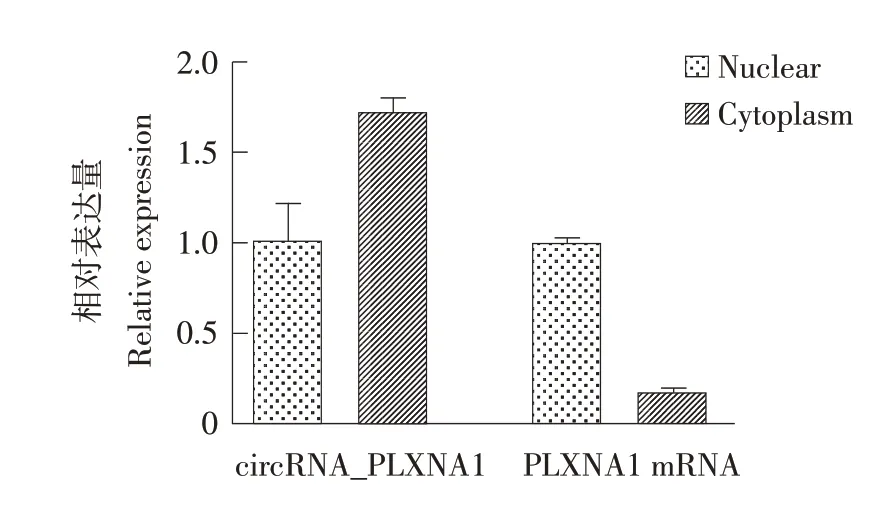
图6 鸡circ_PLXNA1的核质分离Fig.6 Subcellular localization of chicken circ_PLXNA1
2.3 鸡circ_PLXNA1在鸡不同组织中表达水平
从鸡心脏、肝脏、脾脏、肺、肾脏、淋巴、法氏囊等组织中提取RNA,采用定量PCR检测不同组织中鸡circ_PLXNA1和PLXNA1 mRNA表达。定量PCR分析结果表明,鸡circ_PLXNA1在心脏和肝脏中表达水平较高,其次是淋巴,脾脏中较少,在其他组织中几乎无表达;PLXNA1 mRNA在所有组织中均表达,且表达水平较高(见图7)。

图7 鸡circ_PLXNA1在鸡不同组织中相对表达量Fig.7 Expression of chicken circ_PLXNA1 in different tissuesof chicken
2.4 鸡circ_PLXNA1可能间接参与脂肪细胞分化
为进一步探索鸡circ_PLXNA1潜在功能,使用Miranda软件预测可靶向circ_PLXNA1的miRNA和mRNA。结果显示共预测296个miRNA,其中14个miRNA形成自由能大于30的复合结构,本试验选取前10个自由能较高miRNA进行靶基因预测。使用miRDB和TargetScan软件预测靶基因,总计预测到有549个基因可靶向前面提到的10个miRNA。Cytoscape软件用于构建鸡circ_PLXNA1-miRNAmRNA调控网络(见图8),结果表明circ_PLXNA1可能通过预测网络产生广泛影响。
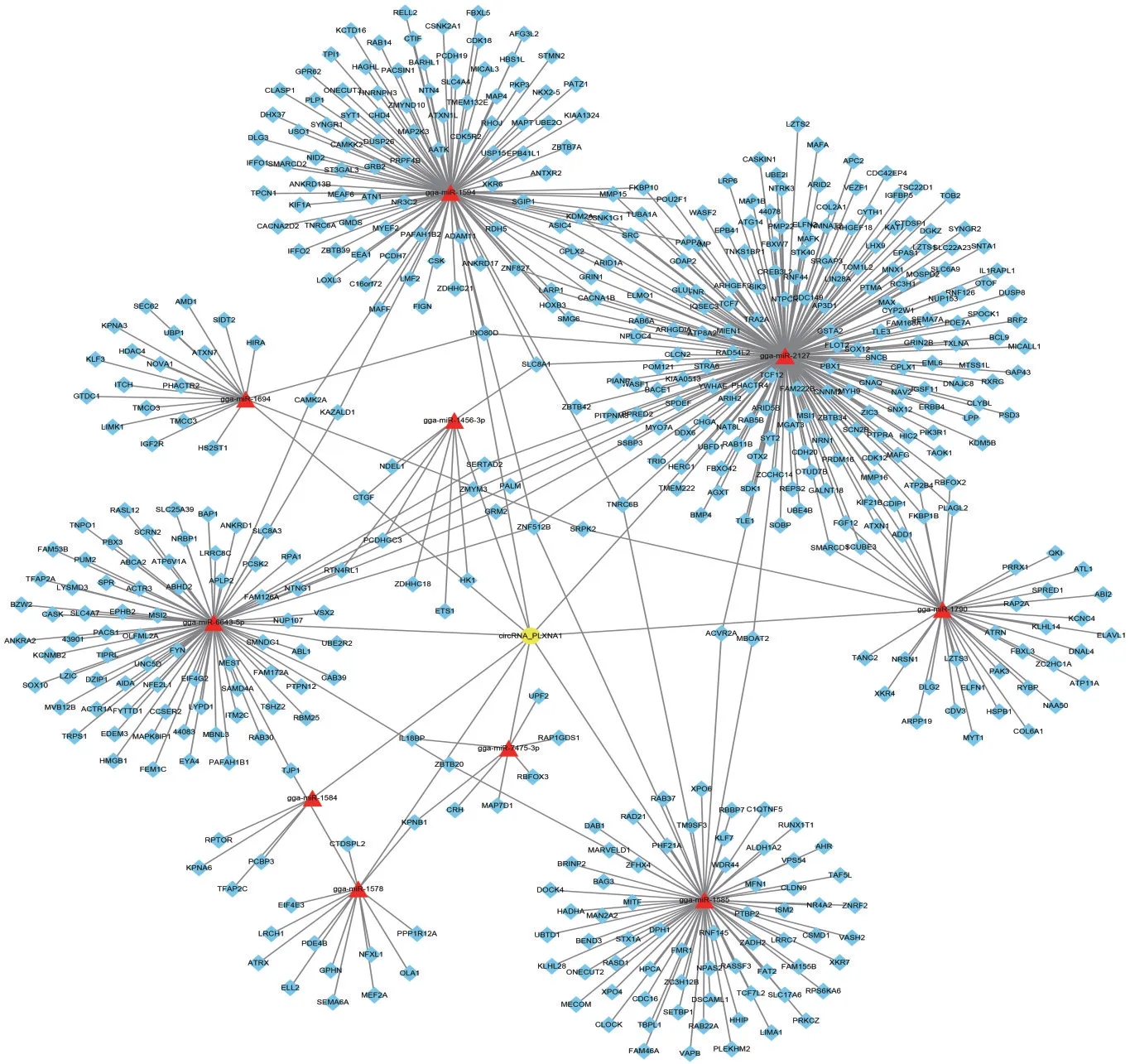
图8 鸡circ_PLXNA1的ceRNA调控网络(circ_PLXNA1-miRNA-mRNA)Fig.8 ceRNA(circ_PLXNA1-miRNA-mRNA)network diagram of chicken circ_PLXNA1
对预测到的549个基因进行GO功能注释和KEGG富集分析以预测其功能。GO分析主要从分子功能(MF)、细胞成分(CC)和生物过程(BP)3个方面分析基因功能(见图9),鸡circ_PLXNA1靶基因功能主要是转录因子活性(Transcription factor activity)、序列特异性DNA结合(Sequence-specific DNA binding)、蛋白激酶活性(Protein kinase activity)、磷酸转移酶活性(Phosphotransferase activity)、醇族体(Alcohol group as acceptor)、转录因子复合物(Transcription factor complex)、细胞前沿(Cell leading edge)、表皮发育(Epidermis development)、骨髓细胞分化(Myeloid cell differentiation)等。
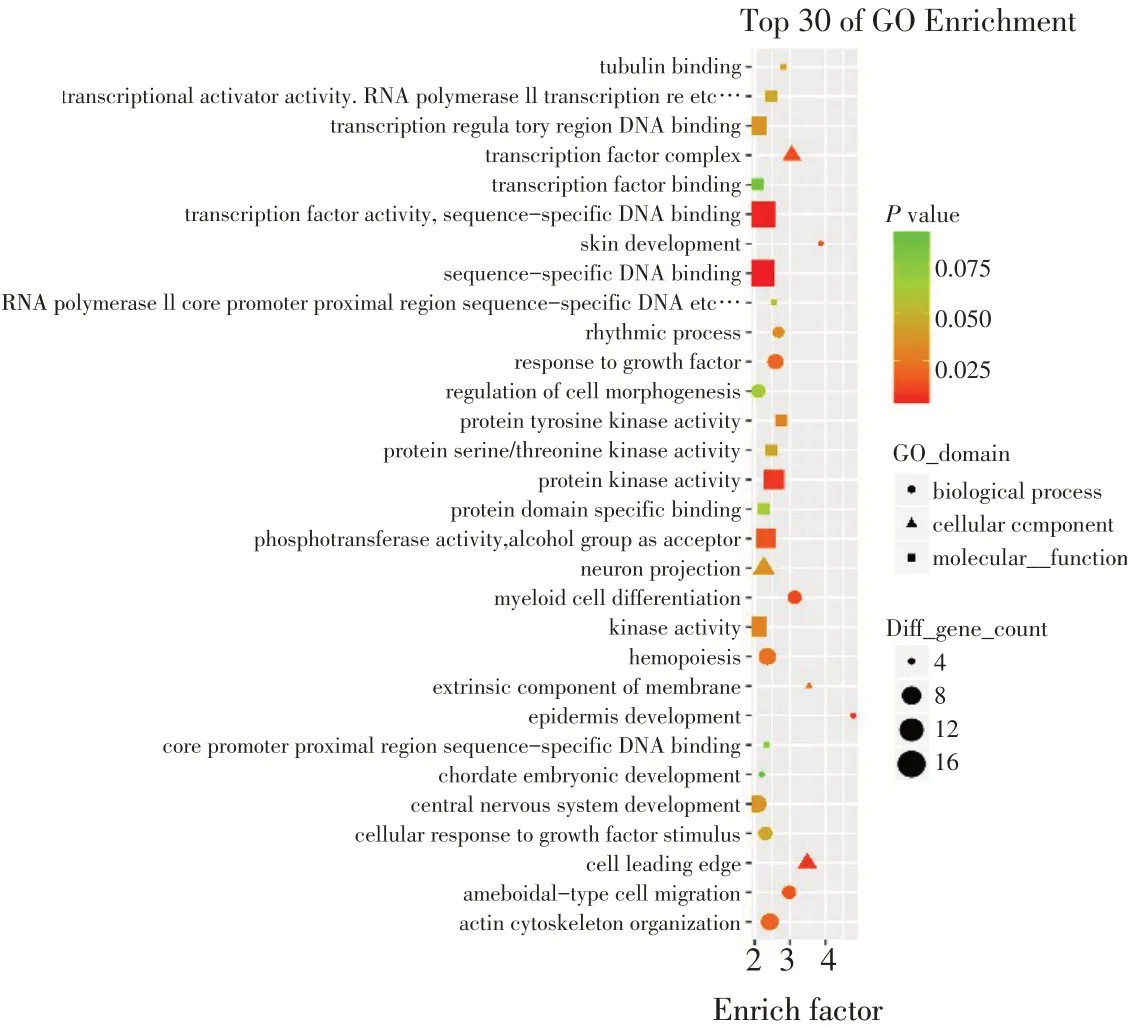
图9 549个靶标基因GO分析结果Fig.9 GO analysisresult of the549 target genes
KEGG富集分析表明,鸡circ_PLXNA1靶基因主要富集在Adherens连接(Adherens junction)、ErbB信号通路(ErbBsignaling pathway)、Tight连接(Tight junction)、泛素介导的蛋白水解(Ubiquitin mediated proteolysis)、肌动蛋白细胞骨架调控(Regulation of actin cytoskeleton)、MAPK信号通路(MAPK signaling pathway)、Hedgehog信号 通路(Hedgehog signalingpathway)等(见图10)。

图10 549个靶标基因的KEGG结果Fig.10 KEGG analysisof the 549 target genes
3 讨论
目前家禽circRNA研究主要集中在肌肉发育和繁殖性能等方面,脂肪细胞分化方向研究相对较少。郭行雅研究发现小鼠circRNA-0046367通过吸附miR-34a消除对PPARα表达的抑制,降低脂质代谢相关基因表达,减轻肝脏脂肪变性[13]。张贞贞研究发现miR-103是调节脂肪细胞重要miRNA,circARF3可通过海绵吸附miR-103促进线粒体自噬调节NF-κB信号通路,抑制脂肪炎症[14]。Jiang等研究发现在牛脂肪细胞中,能够靶向let-7c的circ-FUT10调节PPARGC1B表达从而促进脂肪细胞增殖并抑制脂肪细胞分化[15]。Zhang等首次在牦牛脂肪细胞分化过程中鉴定circRNA表达模式,共检测到7 203个候选circRNA,为牦牛脂肪细胞分化相关基因研究提供坚实基础[16]。Zhang等研究发现ciRS-133与胃癌患者白色脂肪组织(WAT)褐变有关,来自胃癌细胞的外泌体将ciRS-133递送到前体脂肪细胞中,通过激活PRDM16和抑制miR-133促进前脂肪细胞向棕色样细胞分化[17]。因此推测circRNA可能在鸡脂肪细胞分化过程中发挥重要作用。
本课题组前期研究发现鸭circ_PLXNA1在鸭脂肪细胞分化中起作用,在DF-1细胞转录组测序中也筛选到此circRNA。本研究中选择与鸭circ_PLXNA1具有91%同源性的鸡circ_PLXNA1验证其在鸡脂肪细胞分化中作用。通过对鸡circ_PLXNA1全长序列进行扩增测序,并与数据库比对发现,鸡circ_PLXNA1由PLXNA1基因的5´UTR部分序列、外显子1以及外显子2反向剪接而成,其中剪接点前面和剪接点后面序列分别是AG和GG,符合环状RNA剪接规律[18]。本试验通过对鸡circ_PLXNA1反向剪接位点处序列的PCR扩增和测序验证,且结合RNase R核酸外切酶消化处理试验,证明鸡circ_PLXNA1比线性PLXNA1更耐RNase R消化,是一个稳定转录本,与前人研究结果一致[10]。组织表达谱定量结果表明鸡circ_PLXNA1在鸡部分组织中含量丰富,其他研究也发现此结论[19]。此外,在鸡不同组织中,环状RNA表达方式较多,这与哺乳动物相同[20]。RNase R核酸外切酶消化处理试验、组织表达谱和亚细胞定位等试验证明鸡circ_PLXNA1为稳定、高丰度环状转录本,且主要存在于细胞质中。
研究表明,circRNAs可作为一种竞争性内源RNA(ceRNA)与miRNAs结合调节靶基因表达。CircRNA-Cdr1as在体外抑制膀胱癌细胞增殖、侵袭和迁移,在体内减缓肿瘤生长。此外,circRNA-Cdr1as可直接与miR-135a结合并抑制其在膀胱癌中活性[21]。Liu等研究发现沉默circRNA_100367可抑制KYSE-150R细胞增殖和迁移,并降低KYSE-150R细胞中β-连环蛋白(Wnt通路中的重要分子)表达,CircRNA_100367通过miR-217/Wnt3通路增强KYSE-150R细胞的放射抗性[22]。Chen等研究发现,circRNA_28313敲低在体外显著抑制RANKL+CSF1诱导的骨髓单核细胞以及巨噬细胞内破骨细胞分化,同时在体内抑制卵巢切除(OVX)小鼠的骨吸收,circRNA_28313通过ceRNA机制解除miR-195a介导对CSF1的抑制,调节骨髓单核细胞/巨噬细胞细胞中破骨细胞分化[23]。Zhang等研究发现hsa_circRNA_101237吸附miR-490-3p增强MAPK1表达,显著促进NSCLC细胞系增殖、迁移和侵袭[24]。本研究通过Miranda预测到296个miRNA,选取前10个miRNA进行靶基因预测。此外,使用miRDB和TargetScan预测靶基因,预测到549个能够靶向miRNA基因,预测网络表明鸡circRNA_PLXNA1影响更为广泛。
GO和KEGG可较好注释基因功能。GO和KEGG富集分析功能发现鸡circRNA_PLXNA1预测的靶基因富集ErbB信号通路、MAPK信号通路以及Hedgehog信号通路。李媛等发现猪肌内脂质差异circRNA的靶基因主要富集于MAPK通路、细胞因子受体相互作用等通路[25],与本研究结果一致。Lee等发现sinigrin(2-丙烯基硫代葡萄糖苷)通过AMPK、MAPK和ACC激活具有抗脂肪生成作用,表明sinigrin通过AMPK和MAPK信号通路抑制3T3-L1脂肪细胞早期脂肪生成[26]。Zhang等研究发现GDF5可以改善胰岛素敏感性和预防代谢综合征,皮下白色脂肪组织中的适应性产热可介导GDF5在小鼠中的肥胖抵抗效应,并导致部分p38 MAPK信号通路激活,说明GDF5可通过p38 MAPK信号通路促进白色脂肪组织产热[27]。在Hedgehog信号通路中,主要脂肪酶Brummer(Bmm)作用于Smoothened(Smo)下游,促进脂肪分解,从而促进三酰甘油(TAG)分解,Hedgehog信号通路激活导致脂质积累减少[28]。在家蚕幼虫模型中,在接受特定Hedgehog信号通路拮抗剂环巴胺处理的家蚕中观察到脂肪细胞分化增强和脂肪细胞尺寸增加,表明Hedgehog信号通路抑制脂肪形成[29]。Zhang等研究发现抑制Hedgehog信号通路活性促进白色脂肪组织褐变,而其激活则减弱去甲肾上腺素诱导褐变[30]。鸡circ_PLXNA1和预测的靶基因也富集许多与脂肪细胞分化相关通路,表明鸡circ_PLXNA1可能通过调控靶基因表达间接参与鸡脂肪细胞分化。
4 结论
本研究在细胞水平鉴定和验证鸡circ_PLXNA1,结果显示鸡circ_PLXNA1是主要在心脏和肝脏中表达且定位在细胞质中的稳定环状转录本。基于相关试验并结合生物信息学分析结果,推测鸡circ_PLXNA1可能通过调控靶基因间接参与脂肪细胞分化。本研究为进一步探究circ_PLXNA1对鸡脂肪细胞分化的调控及更深层次了解circRNA在鸡脂肪细胞分化过程中的调控作用提供基础。

