CT纹理特征预测肝癌微波消融术后局部复发分析
郑宇,郭子义
(锦州医科大学附属第一医院,辽宁 锦州 121000)
肝癌包括原发肝癌和肝转移癌是癌症患者的主要死亡原因之一[1]。以肿瘤射频消融或微波消融为代表的局部毁损性治疗(local ablative treatment,LAT)已经得到肿瘤治疗指南推荐[2]。然而,肿瘤消融术后局部复发是影响患者长期生存的关键问题之一[3-4]。CT纹理分析(CT texture analysis,CTTA)是一种利用像素属性表征特定感兴趣区域(region of interesting,ROI)内病变的异质性进而获得定量纹理参数的方法。已有研究表明CTTA能够预测肿瘤患者预后,总体生存率及评估肿瘤治疗反应[5]。
本研究拟通过对肝癌患者随访中,以机器学习(ML)分类模型方法为基础,分析肝癌门静脉期增强CT的CTTA所获得参数特征来预测肝癌消融术后复发与否。
1 资料和方法
本研究中的所有临床数据和影像学数据均来自锦州医科大学附属第一医院,CT图像以DICOM格式保存。所有实验方案均已获得锦州医科大学机构审查委员会的批准。
1.1 入选标准
回顾性的收集2016—2021年肝肿瘤微波消融术治疗病例,共146例,3~6个月后随访发现局部复发者45例。本研究中仅包括那些在肝肿瘤消融术后3个月以上,且行对比增强CT(contrast enhancement CT,CECT)检查并且保存有原始DICOM图像数据的患者。所有这些图像为最大管电压为120 kV的腹部增强CT,切片厚度5 mm,仅收集门静脉期增强CT图像。
1.2 排除标准
CECT图像质量差的患者,如明显的图像噪声、伪影或图像存在其他质量问题被排除在研究之外。
1.3 数据扩充
每位患者3~5个连续层面的样本,将数据扩充到总共528个标记样本(225个无局部复发的样本和303个局部复发样本)。图像选在感兴趣病灶的最大直径中心切片位置和上、下1~2层,因此在3~5个不同且连续的切片中进行采样。
1.4 图像分割与处理
在代表肿瘤最大横截面积的轴向图像切片上,使用3D Slicer软件(版本4.8.1)手动进行肿瘤分割[6],然后在相邻的连续上层和下层切片上执行其他分割。每个病灶最多可获取5次分割(连续5层),且距病变轮廓约2 mm的边缘缩进。全部针对DICOM图像格式进行提取数据,并进行归一化和标准化处理。
1.5 特征提取
使用开源软件包提取纹理特征(Pyradiomics,版本2.2.0)[7],提取过程按软件说明书进行。所提取的纹理特征包括一阶特征,灰度相关矩阵,灰度共现矩阵,灰度游程矩阵,灰度大小带矩阵,相邻灰度差矩阵和基于小波分析的纹理特征。每个病变提取的特征总数为828。这些特征的详细描述和数学公式已在其他文献进行了描述[8]。
1.6 选择高度可重复的特征
使用统计软件SPSS 18.0中运行内相关系数(internal correlation coefficient,ICC)为每个纹理特征计算类内相关系数值[9]。在特征选择步骤中,仅包含类ICC > 0.9的特征(表明具有高度可重复性)。
1.7 基于ML分类模型的特征选择与预测统计分析
基于ML的分类模型的统计使用Pycaret软件(2.1.2版)[10]。使用10倍交叉验证,共制作了18个分类模型。主要根据AUC值对分类模型的性能进行了评估和比较。主要使用AUC值测算不同分类模型的性能,显著性检查水平P<0.05。
2 结 果
本研究所纳入病例的一般特征:平均年龄(59.74 ± 27.5)岁;男性101例,女性45例;原发肝癌48例,肝转移癌98例;出现微波消融术后复发者原发肝癌10例,肝转移癌35例。在门静脉增强CT增强图像上的测定病变最大直径如下:(1)伴有局部复发肿瘤直径为直径:(2.95±1.38) cm;中位数:3.57 cm;IQR:2.88~4.40 cm;(2)无局部复发的肝肿瘤为(2.02±1.45) cm;中位数:2.95 cm;IQR:2.06~3.36 cm。每个含有肿瘤的ROI中的体素数量如下:(1)伴有局部复发肿瘤者4893± 4698;中位数:5875;IQR:2860~5578;(2)无局部复发肿瘤者3574 ± 5658;中位数:4984;IQR:1761~4430。肝肿瘤微波消融术后局部复发在门静脉期增强CT影像表现,见图1。
2.1 重复性分析与特征选择
目标变量是消融术后局部复发状态(是=1,否=0)。在828个纹理特征中,759个具有高度可重复性(ICC ≥ 0.9),因此以下分析中总共包括759特征和528个样本。训练集∶测试集∶验证集的样本比例为70∶20∶10。使用交叉验证对总共18个模型进行了训练和评估。
2.2 3种分类预测模型在训练集和测试集进行分类预测结果
在训练集上对所有18个分类模型进行了训练,并使用分层交叉验证对它们进行了评分,分别用AUC、准确率、精确率、Kappa值表示分类模型的优劣。最终将得分最高的3种分类模型Extra Trees、cat Boost和Gradient Boosting用作判定局部复发与否,3种分类模型在肿瘤局部复发与否预测的准确率、精确率、Kappa值和AUC值之间的比较,见表1。

星号所示A:最大径约为1.8 cm;B:行CT引导下微波消融术后3个月时复查CT提示可疑结节,未行进一步治疗;C:微波消融术后6个月复查增强提示病灶局部复发

表1 不同分类模型对有/无局部复发分类
在测试集上Extra Trees、cat Boost和Gradient Boosting这3种分类模型的预测准确率均超过80%,精确率超过80%,Kappa值约60%,特别是AUC值均超过85%(P<0.05),提示所选择的3种分类模型在预测效能和稳定性上具有显著优势。为了验证数据的预测模型功能,在从原始数据集中保留了53个样本记录(占10%),用于最终验证所用分类模型的AUC的性能,见图2。
在测试样本(test data为20%,105个样本)上判定经过训练集获得的3种模型的分类结果。图2显示了来自Extra trees分类模型,Cat Boost分类模型和Gradient Boosting模型的ROC曲线图,3种分类模型的分类准确性均超过85%。进一步对预测的精确率进行判定,见图3。Extra Trees、CatBoost、Gradient Boosting这3种分类模型方法,从肝癌的门静脉期增强CT的CTTA获得的所选10个特征预测AUC值分别为:0.85、0.88、0.89(P<0.05);预测精确度分别为90%、91%和92%(P<0.05)。
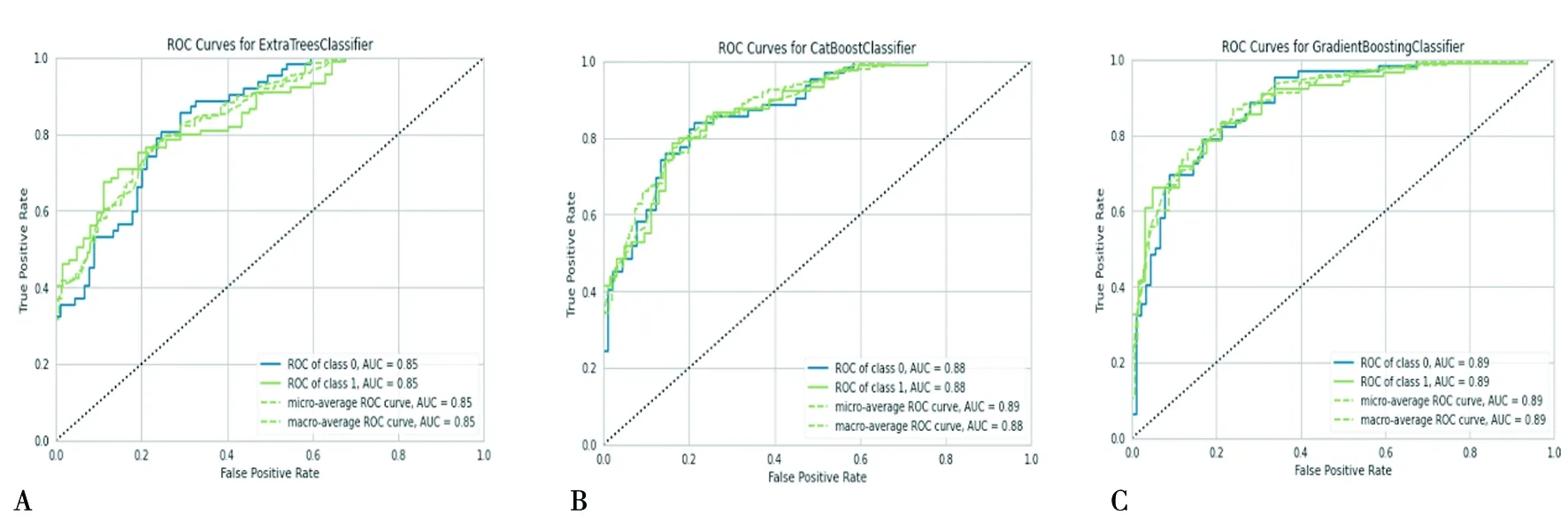
A:使用Extra Trees分类模型获得的AUC为0.85;B:使用Cat Boost分类模型获得的AUC值为0.88;C:使用Gradient Boosting分类模型获得的AUC分别为0.89。显著性检验水平设定为P<0.05
2.3 3种分类预测模型在验证集的分类预测结果
为了预测验证集并查看评估指标,最终模型功能将模型拟合到完整的数据集验证集样本(validation data 为10%,53个样本)。在测试集和验证集上,3种性能良好的模型分别是Extra Trees、Cat Boost和Gradient Boosting,模型之间预测准确性结果的比较如下,如图3所示:(1)测试样本(105个样本)上Extra Trees分类模型的准确性为0.85,验证集数据(53个样本)进行预测的准确性为0.9;(2)Cat Boost在测试集(105个样本)上的准确度为0.88,验证集数据(53个样本)的预测准确度为0.9;(3)Gradient Boosting在测试集(105个样本)上的准确度为0.86,验证集数据(53个样本)的预测准确度为0.9。
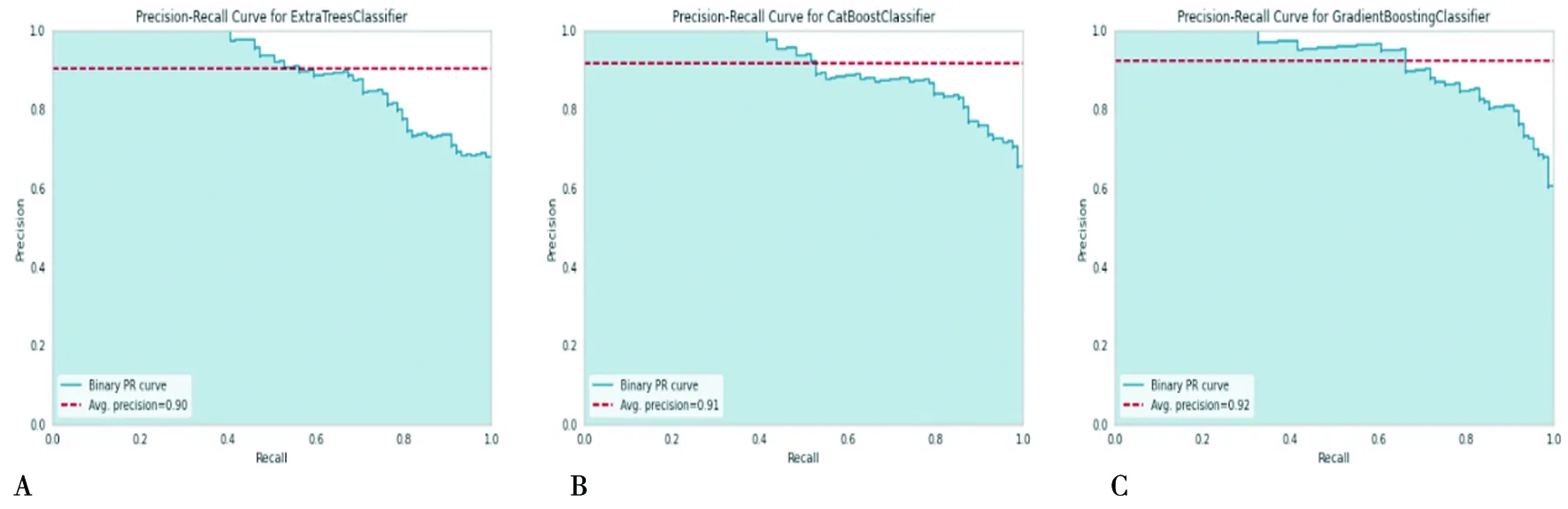
A:使用Extra Trees分类模型有效区分有/无局部复发分类的精确度为0.90;B:使用Cat Boost分类模型有效区分有/无局部复发分类的精确度为0.91;C:使用Gradient Boosting分类模型有效区分有/无局部复发分类的精确度为0.92。 3种分类模型(Extra Trees,Cat Boost和Gradient Boosting)判定复发与否的精确度均超过90%,显著性检验水平设定为P<0.05
3 讨 论
本文使用ML分类模型对肝肿瘤消融治疗后CTTA所获特征数据进行分析,来预测肿瘤消融局部复发与否。本研究结果表明,使用3种不同ML分类模型(如 Extra Trees、Cat Boost和Gradient Boosting分类模型)对CTTA分析均可能对预测肝肿瘤局部复发有用,预测的准确率可以达到90%以上。本研究结果与其他通过使用CTTA的作为肿瘤复发的生物标志物研究结论一致,判断正确率约88%~93%[11]。
本研究中仅通过分析肝癌门静脉期增强CT进行CTTA研究,而且使用120 kV的管电压完成肝增强CT检查,使得应用于本研究所需的CT检查放射剂量低于常规多期肝增强CT(平扫-动脉期-门静脉期-延迟期),有效的降低了CT放射剂量。特别是对于肝癌患者而言,需要反复多次进行CT为代表的放射线检查,能够行之有效地降低医疗相关辐射剂量。
基于CTTA的ML分类模型已用于预测转移性结直肠癌患者的生存[12],CTTA还成功用于预测单个HER2扩增的结直肠癌肝转移的化疗后反应[13]。从CTTA得出的特征参数可能会提供潜在的预后标记来预测肿瘤治疗后局部复发,我们可以预计通过进一步研究可能会开发出新的基于影像数据的预后标记物和模型,其中可能涉及更大的数据集和不同的特征选择算法以及支持ML分类模型。由于CTTA可以揭示成像特征与肿瘤治疗预后之间的关系,我们目前的研究可能具有重要的临床意义。
该研究尚存在一些局限有待解决:(1)作为一项回顾性研究设计,该研究提供了一些较低水平的证据;(2)基于ML的分类模型可能会因患者人数少且失衡而导致过拟合的风险,我们努力通过应用数据增强技术来增加标记样本的数量,以减少这种预期过拟合的问题,这是一种有效的方法,可以克服基于ML的分类模型中的过拟合;(3)尽管3D分割可以更有效地表示放射线影像学信息,但是我们仅将最大的2D切片及其相邻的连续上下切片用于CTTA,因为多数既往对肝癌的临床研究都是基于单个层面的分割或少数几个分割层面[14];(4)本文未分析非对比增强CT或动脉期增强CT的CTTA,因为非对比增强CT在诊断肝肿瘤复发缺乏组织对比度,因难于早期发现,易出现漏诊;肝动脉期增强CT可因肿瘤消融术后所致肝实质“异常灌注”,可能造成误诊,故本文仅选择门静脉期CT图像进行CTTA分析;(5)本文仅评估了肿瘤局部复发与否,对复发程度和范围未进行划分。
综上所述,基于ML分类模型的CTTA被证明是预测肝癌患者肿瘤消融治疗后复发与否的可行且可能成功的方法。由于本研究仅使用门静脉期增强CT即可实现对肿瘤消融术后复发的有效预测,并能够行之有效的降低CT检查放射剂量,而且可以将该方法用作大型和前瞻性临床试验中的临床决策支持工具之一。

