铁死亡研究进展与恶性肿瘤治疗
虞晶晶(综述),穆 丹,朱庆丰(审校)
(安庆师范大学生命科学学院综合教研室,安徽 安庆 246133)
铁死亡是近年来发现的一种新的死亡方式,铁死亡的发生往往是由于细胞内活性氧(reactive oxygen species,ROS)的积累,还原性谷胱甘肽(glutathione,GSH)的耗竭,最终导致铁依赖的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)氧化,脂质过氧化会破坏质膜结构,致使细胞死亡[1]。癌症是除了心血管疾病外致死率最高的疾病,癌症的发生必定伴随着原癌基因的活化和抑癌基因的失活[2]。调控铁死亡的基因经常发生突变,使得肿瘤对铁死亡更敏感。肿瘤细胞中原癌基因的活化会导致ROS的积累,肿瘤细胞为了抵抗过高的ROS,会提高细胞的抗氧化能力[3]。如果干预肿瘤细胞内的氧化还原平衡,很可能会发生铁死亡,达到治疗肿瘤的目的[4]。
1 铁死亡发现
铁死亡的第一次发现是在2003年,当时筛选能够杀伤大鼠肉瘤(rat sarcoma,Ras)突变肿瘤细胞的小分子药物时,找到了一种新型的药物erastin,erastin能够使细胞很快死亡,并且这是一种与凋亡、程序性坏死等完全不同的死亡方式。但是当时并没有找到erastin的靶点。随后在2008年,又发现了其他药物RSL3和RSL5也能导致同样的肿瘤细胞死亡。最终在2012年,将这种死亡方式命名为铁死亡,这是一种铁依赖性的,与凋亡、程序性坏死等完全不同的死亡方式,往往伴随着脂质ROS的积累,并且发现erastin的靶点是胱氨酸/谷氨酸反向转运体,erastin能抑制胱氨酸摄取,降低细胞内还原性谷胱甘肽的合成[5]。
在2014年,Yang等[6]发现了另一个重要的调节蛋白谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4),GPX4是细胞内产生还原性谷胱甘肽抵抗铁死亡的关键分子。在2017年Doll等[7]鉴定了乙酰辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)在铁死亡中的重要作用,ACSL4是合成多不饱和脂肪酸的关键酶,决定了细胞对铁死亡的敏感度。随后在2019年,又发现了铁死亡抑制蛋白在抵抗铁死亡中的作用[8]。近2年又有了很多新的突破性的发现,2020年,Riegman等[9]发现铁死亡可以在细胞之间传播(图1)。最新的研究又发现在小鼠体内,淋巴中的油酸会保护转移的黑色素瘤细胞免于铁死亡[10]。铁死亡的研究进展十分迅速,近年来随着CRISPR-Cas9技术的发展和成熟,基于全基因组的CRISPR-Cas9筛选对于发现铁死亡中的重要基因提供了极大帮助,其他一些关键节点分子也逐渐被鉴定出来[11]。
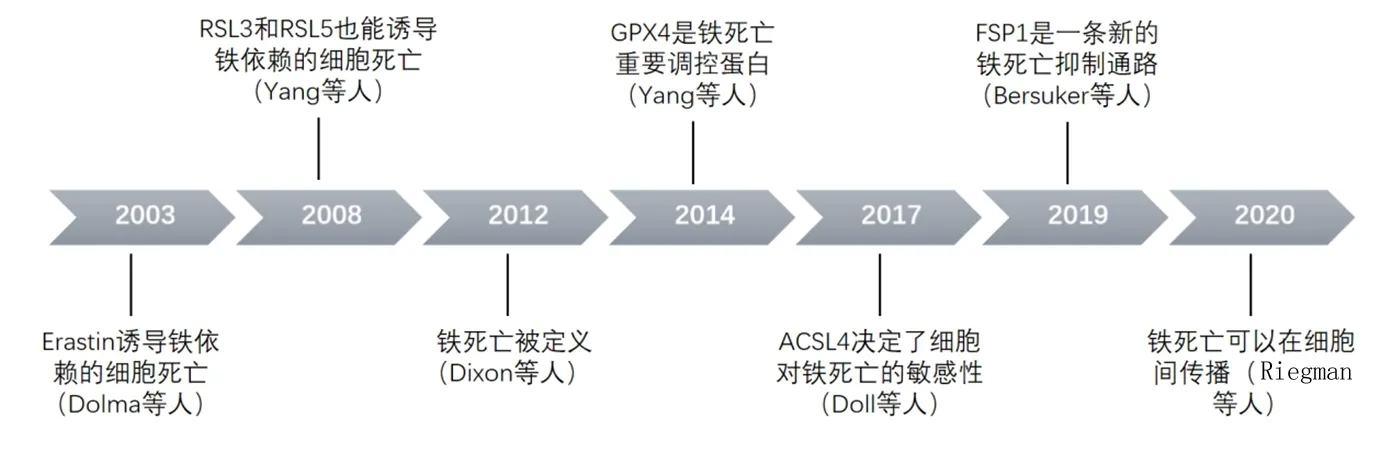
图1 铁死亡发现历程
2 铁死亡特征
2.1形态学特征 细胞铁死亡表现为细胞膜破裂、轻微的染色质凝集和细胞肿胀。与细胞凋亡、程序性坏死、细胞自噬不同的是,铁死亡细胞在电子显微镜下能观察到线粒体异常,如线粒体凝集或肿胀、膜密度增加、嵴减少或缺失以及线粒体外膜破裂,这些特征已经是作为检测铁死亡发生的重要标志[5,11]。
2.2生化特征 铁死亡是一种ROS导致的细胞死亡方式,有2个重要的标志:铁积累和脂质过氧化。细胞中积累的Fe2+通过芬顿反应产生额外的羟基自由基,造成氧化损伤。另外,铁可以提高脂氧合酶和脯氨酸羟化酶的活性[1],产生铁死亡的另一个生化特征:脂质过氧化(表1)。
细胞中的脂肪酸包括饱和脂肪酸、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)、PUFA,其中PUFA是细胞膜磷脂的重要组成成分,PUFA在ROS的攻击和脂氧合酶的作用下产生脂质过氧化物,发生断裂和缩短,并释放一些小的脂肪族产物4-羟基烯醛等,最终导致细胞膜破裂、细胞死亡。这也是检测铁死亡发生的重要依据[12]。

表1 铁死亡与凋亡、程序性坏死和自噬比较
GPX4:谷胱甘肽过氧化物酶4;TFR1:转铁蛋白受体1;SLC7A11:溶质载体家族7成员11;NRF2:核因子E2相关因子2;HSPB1:热休克蛋白β-1;ACSL4:酰基辅酶A合成酶长链家族成员4;FSP1:铁死亡抑制蛋白1;Caspase:含半胱氨酸的天冬氨酸蛋白水解酶;Bcl-2:B淋巴细胞瘤2;Bax:Bcl-2相关的x凋亡调节因子;RIP1:受体相互作用蛋白1;RIP3:受体相互作用蛋白3;ATG5:自噬相关蛋白5;ATG7:自噬相关蛋白7;LC3:微管相关蛋白1轻链3;TFEB:转录因子EB
3 铁死亡调控机制
3.1SystemXc-转运胱氨酸 SystemXc-是一个广泛分布在磷脂双分子层膜上的氨基酸转运蛋白,主要包含2个亚基SLC7A11和SLC3A2。SystemXc-负责将胱氨酸转运进入细胞,同时将等量的谷氨酸转运出细胞。胱氨酸进入细胞后被还原形成2个半胱氨酸,半胱氨酸是合成还原性谷胱甘肽(glutathione,GSH)的原料,GSH通过谷胱甘肽过氧化物酶降低细胞内的ROS和脂质过氧化。抑制SystemXc-的活性会降低胱氨酸吸收和还原性谷胱甘肽合成,最终导致氧化损伤和铁死亡。经典的erastin和索拉非尼能通过抑制SystemXc-来诱导铁死亡[13]。最近的文献表明P53蛋白也可以抑制SystemXc-的活性,从而降低细胞的抗氧化能力,导致细胞对铁死亡敏感[14]。
3.2GPX4抑制铁死亡 在所有的谷胱甘肽过氧化物酶家族中,GPX4在铁死亡的调控过程中占据着最重要的位置,同时也是调控铁死亡最关键的一环。GPX4利用GSH将过氧化的脂质还原为相应的醇类。抑制GPX4会诱导铁死亡发生,如RSL3及相关的衍生药物。敲低GPX4或者在GPX4表达水平较低的细胞中,对铁死亡也更加敏感[6]。另外,GPX4是人体中25个硒蛋白之一,GPX4发挥催化作用需要硒的参与,硒的水平也会影响GPX4的表达水平[15]。
3.3铁在铁死亡中的作用 从铁死亡的名称中可看出,铁死亡的发生依赖铁元素。首先,铁元素可以推动芬顿反应的进行,催化过氧化氢产生羟自由基。然后在GPX4受到抑制的情况下,羟自由基攻击多不饱和脂肪酸产生过氧化的脂质,过氧化的脂质又可以在铁的催化作用下产生新的自由基,导致链式反应进行,促进脂质过氧化的进一步传播[16]。
在体内,小肠吸收和红细胞裂解产生的Fe2+首先被铜蓝蛋白氧化为Fe3+,Fe3+可以结合细胞膜上的转铁蛋白,形成的复合物又被细胞膜上的转铁蛋白受体1(transferrin receptor-1,TFR1)识别并帮助其内吞进入细胞内。细胞内的Fe3+在金属还原酶家族3的作用下被还原成为Fe2+,Fe2+一方面以游离的铁离子形式构成细胞内的铁池,另一方面也可以储存在铁蛋白中,发挥广泛的作用。因此,如果干扰TFR1的表达,可以显著降低细胞内的铁离子浓度,抑制铁死亡。然而,血红素加氧酶1(heme oxygenase-1,HO-1)催化血红素降解产生游离的铁,HO-1的过表达能够加速erastin诱导的铁死亡。
3.4ROS 细胞内的ROS包括超氧阴离子(O2·-)、过氧化氢(H2O2)和羟自由基(·OH)。线粒体在进行氧化磷酸化产生ATP时,因电子传递过程发生电子渗漏或者通过细胞膜上的NADPH氧化酶产生超氧阴离子,超氧阴离子在超氧化物歧化酶的作用下形成H2O2,H2O2被铁等金属元素催化产生羟自由基,诱导脂质过氧化导致铁死亡(图2)[17]。
在肿瘤细胞中,由于原癌基因的活化,细胞会产生ROS。而且肿瘤细胞快速增殖需要大量的营养物质和能量,细胞会发生代谢重编程,线粒体功能异常,也会产生较多的ROS。有研究表明一定程度的ROS能够传导增殖信号,促进肿瘤发生发展[18]。但是过高的ROS也会导致细胞死亡,因此肿瘤细胞需要提高其抗氧化水平来维持氧化还原平衡。有效地促进肿瘤细胞发生铁死亡主要包括2种方法:一种方法是增加ROS产生,如一些传统的化疗药物5-氟尿嘧啶、奥利沙铂和紫杉醇等。另一种是降低肿瘤细胞内抗氧化能力,如抑制肿瘤细胞内抗氧化的核因子E2相关转录因子(nuclear factor E2-related factor 2,NRF2)[4]。
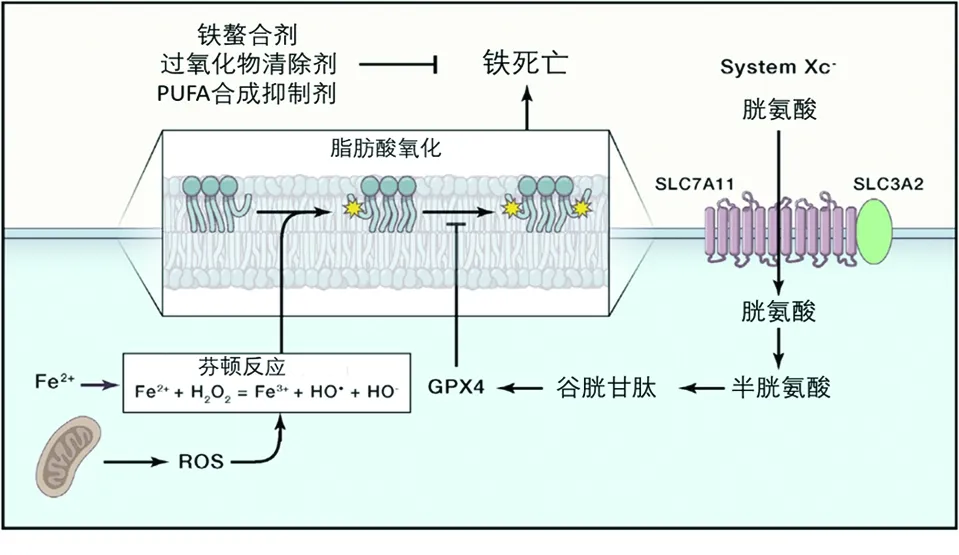
图2 铁死亡调控机制
4 铁死亡与恶性肿瘤治疗
肿瘤抑制因子如p53可以调控肿瘤细胞铁死亡的发生。此外,已经有许多FDA批准的用于肿瘤治疗的小分子临床药物被发现能活化铁死亡,并且在多种肿瘤模型中诱导铁死亡能够有效抑制肿瘤增殖。最重要的是发现铁死亡可以有效杀伤一些化疗抵抗的肿瘤[19]。
4.1p53介导的铁死亡调控 p53是重要的抑癌基因,肿瘤细胞中突变频率最高的基因,大约有50%以上的恶性肿瘤会发生p53的突变。p53的功能主要包括细胞周期阻滞,促进凋亡、衰老,调控细胞代谢,抑制细胞异常增殖[20]。野生型的p53主要被认为能促进铁死亡从而抑制肿瘤增殖,p53可以下调SystemXc-转运蛋白的表达水平来促进铁死亡。但是肿瘤中p53往往发生突变,当p53的K117,K161和K162发生突变时,p53会丧失对铁死亡的促进[14]。
4.2铁死亡诱导剂的抗肿瘤治疗潜力 依据诱导铁死亡发生的不同方式将药物分成4种类型。第1类:降低GSH水平;第2类:直接抑制GPX4;第3类:降解GPX4和CoQ10;第4类:提高铁水平诱导脂质过氧化(表2)。
4.2.1第1类铁死亡诱导剂 抑制肿瘤细胞的抗氧化系统会使它们更容易受到氧化损伤和细胞死亡,抗氧化的GSH被认为是肿瘤细胞的“阿喀琉斯之踵”。细胞内GSH合成原料的胱氨酸来源主要有systemXc-和转硫作用。而在部分肿瘤中,转硫作用通路会因为突变或表观修饰而失活,此时肿瘤细胞高度依赖于systemXc-来摄取胱氨酸,systemXc-的抑制剂可以发挥促进铁死亡抑制肿瘤的作用[21]。在第一类铁死亡诱导剂中,erastin在宫颈癌和卵巢癌中都有很好地抑制肿瘤的作用。另外2种erastin的衍生物piperazineerastin和imidazoleketoneerastin在纤维肉瘤和淋巴瘤模型中也有很好的作用[6,22]。FDA批准的systemXc-的另一种抑制剂sulfasalazine本身是用于治疗关节炎,现在发现也可以抑制淋巴瘤、胰腺癌和肺癌的增殖。另外一种老药索拉非尼也被提出可以抑制systemXc-诱导铁死亡。
4.2.2第2类与第3类铁死亡诱导剂 在部分肿瘤中抑制systemXc-并不能发挥作用,可能因为这些肿瘤并不依赖systemXc-来合成GSH,或是在抑制systemXc-后肿瘤细胞有补偿通路来提供抗氧化能力。此时直接靶向GPX4的第2类和第3类抑制剂成为更好的抑制肿瘤的策略[19]。RSL3是用的最多的GPX4抑制剂,在纤维肉瘤和众多细胞模型中能显著诱导铁死亡发生[6]。WithaferinA可以抑制神经母细胞瘤增殖,altretamine可以抑制弥散性大B细胞淋巴瘤和骨肉瘤增殖[23]。
4.2.3第4类铁死亡诱导剂 相比于正常细胞,肿瘤细胞对铁有更高的需求,被称为肿瘤细胞的“铁成瘾”,这使肿瘤细胞更容易在提高铁水平时发生铁死亡。比如,肾癌中富含铁的肿瘤微环境促进肿瘤细胞发生铁死亡[21]。withaferinA除了可以抑制GPX4外,也能通过降解血红素提高铁的含量诱导铁死亡,同样FINO2能够抑制GPX4和氧化三价铁来诱导肿瘤细胞发生铁死亡[23-24]。此外,一些搭载铁的纳米材料也能够诱导肿瘤发生铁死亡[25]。
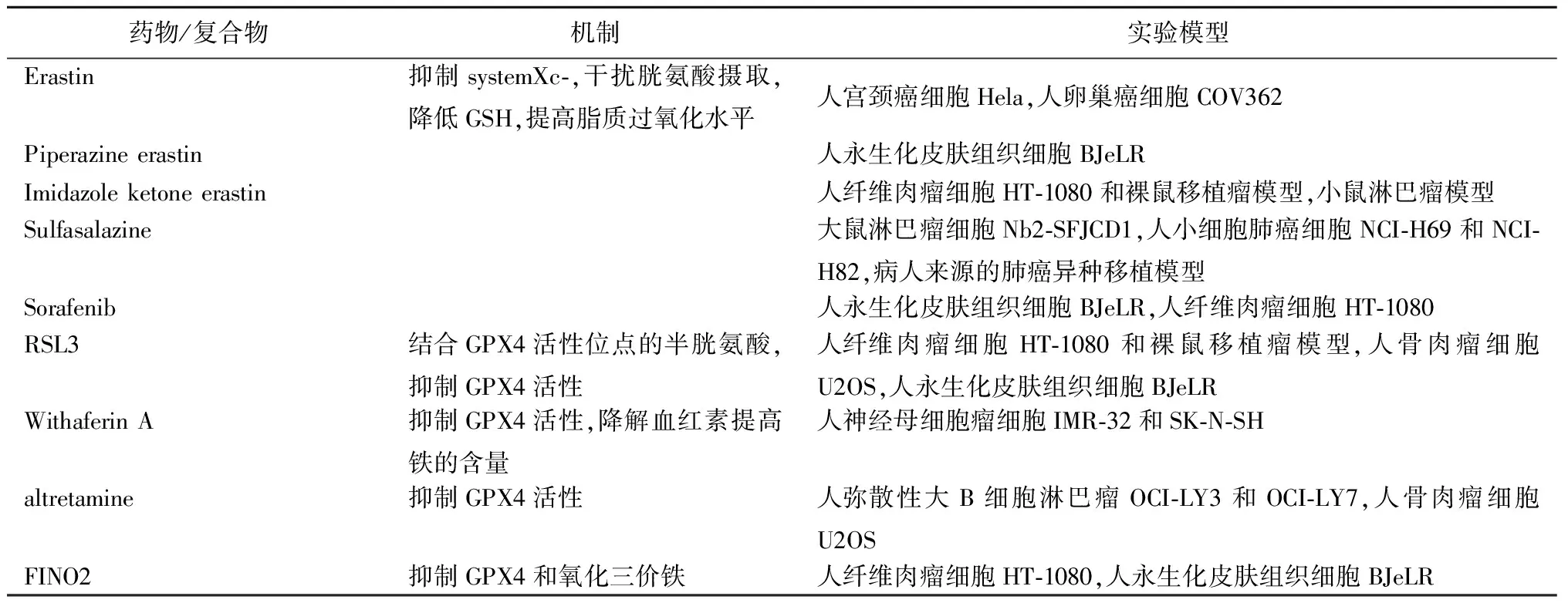
表2 铁死亡诱导剂
5 总结与展望
铁死亡是一种独特的细胞死亡方式,它将细胞代谢中不同元素聚集在一起,包括铁、硒、氨基酸、脂类和氧化还原稳态。随着铁死亡研究的进展,开始认识到其在广泛的生物过程中起着重要作用,包括正常生理和多种病理情况下。许多证据表明,铁死亡能够抑制肿瘤增殖[1]。利用铁死亡抑制增殖在针对化疗抵抗的肿瘤中发挥了很好的效果。很多FDA批准的小分子药物包括阿替拉胺、索拉非尼和纳米药物在诱导铁死亡抑制肿瘤方面表现出了良好的前景[26]。虽然对铁死亡的研究越来越深入,但仍然存在几点尚未清楚的地方值得继续探究。第一,如何定义细胞发生铁死亡。目前常用的方法是通过电镜直接观察细胞的线粒体形态,以及利用质谱和荧光探针检测细胞是否发生脂质过氧化。另一种方法是加铁死亡抑制剂观察细胞死亡是否减少,如果死亡减少则认为发生的细胞死亡是铁死亡。但是这2种方法都有明显的不足,电镜观察和检测脂质过氧化都十分繁琐并且难以普及,铁死亡抑制剂则不够直接,不完全令人信服,而且这2种方法无法在体内检测铁死亡。如果能够找到直接的铁死亡标志物,并且易于检测,那么对于铁死亡的研究进一步发展将是极大的提高。目前还在推进使用的方法是用探针检测铁的含量或者用抗体检测一些能调控铁死亡发生的重要节点蛋白,包括转铁蛋白受体1和谷胱甘肽过氧化物酶4,以及脂质过氧化释放的小的脂肪族产物4-羟基烯醛等。第二,对铁死亡深入机制的探究。找不到通用的广为接受的铁死亡标志物,很大一部分是因为对铁死亡机制的不完全了解。比如在进行到哪一步后铁死亡将不可停止和逆转,以及细胞最终死亡的机制等。铁死亡机制的深入探究,将会对铁死亡在临床上的应用发挥重要的作用。第三,在临床前和临床治疗肿瘤环境中,铁死亡诱导的特异性是什么?如何控制潜在的不良影响?肿瘤的基因突变能多大程度上影响铁死亡的敏感性?肿瘤细胞的表观修饰对调控铁死亡有何作用?肿瘤免疫治疗与铁死亡是否能相互协同?纳米材料在铁死亡治疗肿瘤中具体能发挥多大的作用等。
总之,铁死亡领域仍有很多值得探索的方向,在临床上的应用也越来越重要。随着更多现象的发现和机制的深入探究,这种与凋亡、细胞程序性坏死和细胞自噬完全不同的死亡方式必将能与之共同出现在教科书上。

