枇杷叶提取物通过激活磷脂酰肌醇3激酶/蛋白激酶B信号通路减轻脂多糖诱导的肺细胞损伤
陈宝磊,高映春,吴磊
作者单位:辽阳市中心医院重症医学科,辽宁 辽阳111000
急性肺损伤是一种感染、创伤等重症疾病诱发的肺部炎症及通透性增加综合征,其主要病理特征为肺泡毛细血管损伤、肺水肿、肺不张等。目前急性肺损伤发病机制尚未阐明,发病率逐年上升。脂多糖(LPS)引起的急性肺损伤是导致病人死亡的重要原因之一,LPS 属于革兰阴性杆菌细胞外膜成分之一,因而如何抑制LPS 诱导的肺损伤是提高治疗效果的重要环节[1]。许多天然植物提取物具有抗炎、抗氧化等作用,并可用于抗肺损伤,例如,桑白皮水提取物、百合固金汤、黄原腐酚可减轻LPS诱导的急性损伤[2-4]。枇杷属于蔷薇科植物,三萜酸类等是其主要活性成分,研究表明枇杷叶提取物具有抗炎、抗氧化等作用[5]。但关于其对急性肺损伤的治疗效果及可能作用机制尚未阐明。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路在多种疾病发生过程中发挥调控作用,信号通路活化后可减轻LPS诱导的急性肺损伤[6]。因此,本研究于2019年6月至2020 年7 月采用LPS 诱导的A549 细胞建立肺损伤模型,探讨枇杷叶提取物对LPS诱导的A549细胞增殖、凋亡及氧化应激的影响,探究其对PI3K/Akt信号通路的调控作用。
1 材料与方法
1.1 材料与试剂人Ⅱ型肺泡上皮细胞A549 购自美国ATCC 细胞库;PI3K/Akt 信号通路抑制剂LY294002 购自美国Selleck Chemicals 公司;枇杷叶购自亳州市绅枫堂药业有限公司;DMEM 培养基购自美国Gibco 公司;噻唑蓝(MTT)试剂购自上海信帆生物科技有限公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染法细胞凋亡检测试剂盒购自北京索莱宝科技有限公司;超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、丙二醛检测试剂盒购自南京建成生物工程研究所;兔抗人磷酸化磷脂酰肌醇-3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-Akt)抗体购自美国Abcam 公司;兔抗人B 细胞淋巴瘤-2(Bcl-2)、Bcl-2 相关X 蛋白(Bax)抗体购自美国CST 公司;辣根过氧化物酶标记的山羊抗兔二抗购自武汉博士德生物工程有限公司。HM-SY96 酶标仪购自山东食安生物科技有限公司;FACS Calibur流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 实验分组 枇杷叶提取物[7]:称取50 g 枇杷叶,研磨成粉状,加入70%乙醇溶解,55 ℃超声波提取1 h(料液比1∶10),过滤后重复提取滤渣1 次,合并两次滤液,应用旋转蒸发器抽取真空减压回收,精密称取提取物适量,加入二甲基亚砜溶液中溶解,制备浓度为10 g/L的母液,根据实验需求稀释浓度为1 mg/L、2 mg/L、4 mg/L的溶液。
A549 细胞置于含10%胎牛血清的DMEM 培养液中,于培养箱内继续培养24 h 后分别加入含有浓度为10 g/L LPS 的培养液干预24 h[8],记为LPS 组。同时将正常培养的细胞作为对照组。分别加入含有不同浓度(1 mg/L、2 mg/L、4 mg/L)的枇杷叶提取物与含有浓度为10 g/L LPS 的培养液干预24 h,分别记为LPS+枇杷叶-L组、LPS+枇杷叶-M组、LPS+枇杷叶-H 组。后续实验中添加PI3K/Akt 信号通路抑制剂LY294002 处理细胞,分别加入含浓度为40µmol/L LY294002[9]、4 mg/L 枇杷叶提取物与10 g/L LPS 的培养液干预24 h,记为LPS+枇杷叶-H+LY294002组。
1.2.2 MTT 检测细胞增殖 取对数生长期A549 细胞接种于96 孔板(5×103个/孔),按照“1.2.1”分组处理后,于培养箱内继续培养24 h,加入MTT 试剂(20微升/孔),于37 ℃、体积分数5%二氧化碳培养箱继续培养4 h 后弃上清,加入二甲基亚砜(150 微升/孔),充分混匀后室温振荡孵育5 min,应用酶标仪检测各孔吸光度。
1.2.3 流式细胞术检测细胞凋亡率 取各组A549
细胞加入预冷PBS 洗涤后弃上清,随后在细胞沉淀中加入500µL Binding Buffer,分别加入5µL Annex‑in V-FITC 与5µL PI,充分混匀后孵育10 min,于1 h内应用流式细胞仪检测各组细胞凋亡率。
1.2.4 检测SOD、LDH、丙二醛的含量 取各组
A549细胞培养上清液,采用2,4-二硝基苯肼显色法检测LDH 的含量,严格按照试剂盒说明书进行操作。采用反复冻融法裂解细胞,用黄嘌呤氧化酶法检测SOD 的含量,用硫代巴比妥酸法检测丙二醛的含量,严格按照试剂盒说明书进行操作。
1.2.5 蛋白质印迹法(Western blotting)检测Bax、Bcl-2、p-PI3K、p-Akt 蛋白表达 取各组A549 细胞加入400 µL RIPA 裂解液提取细胞总蛋白,采用BCA 法测定蛋白浓度后蛋白变性,SDS-PAGE 电泳反应分离蛋白,转移至PVDF 膜(分离的蛋白凝胶)后进行封闭2 h(5%脱脂奶粉),孵育一抗稀释液(1∶1 000)24 h(4 ℃)后洗涤,孵育二抗稀释液(1∶5 000)1 h(室温)后使用等渗缓冲盐溶液洗涤,暗室内曝光显影后应用ImageJ软件分析各条带灰度值。
1.3 统计学方法采用SPSS 21.0 统计学软件分析数据,计量资料以±s表示且均符合正态分布,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 枇杷叶提取物对LPS诱导A549细胞活性的影响以下五组吸光度比较,F=263.62,P<0.001。与对照组(1.38±0.06)比较,LPS 组(0.55±0.02)吸光度降低(P<0.05);与LPS 组比较,LPS+枇杷叶-L 组(0.56±0.02)吸光度差异无统计学意义(P>0.05),LPS+枇杷叶-M 组(0.86±0.03)、LPS+枇杷叶-H 组(1.18±0.05)吸光度升高(P<0.05),且LPS+枇杷叶-H组吸光度高于LPS+枇杷叶-M组(P<0.05)。
2.2 枇杷叶提取物对LPS 诱导A549 凋亡的影响与对照组比较,LPS 组凋亡率升高,Bax 蛋白水平升高,Bcl-2 蛋白水平降低(均P<0.05);与LPS 组比较,LPS+枇杷叶-M 组、LPS+枇杷叶-H 组凋亡率降低,Bax 蛋白水平降低,Bcl-2 蛋白水平升高,且LPS+枇杷叶-M 组、LPS+枇杷叶-H 组各指标间比较均差异有统计学意义(均P<0.05)。见图1、表1。
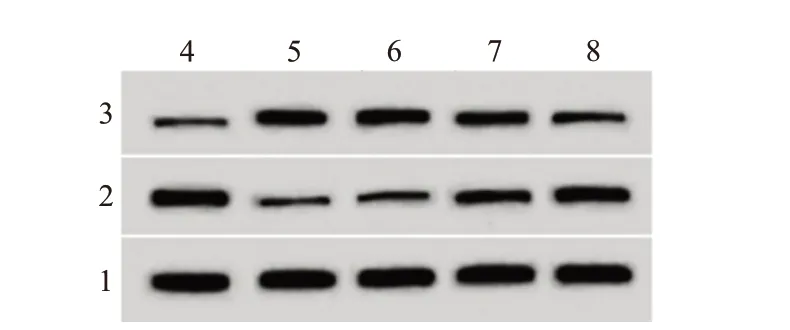
图1 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549凋亡蛋白表达的影响
表1 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549凋亡的影响/± s
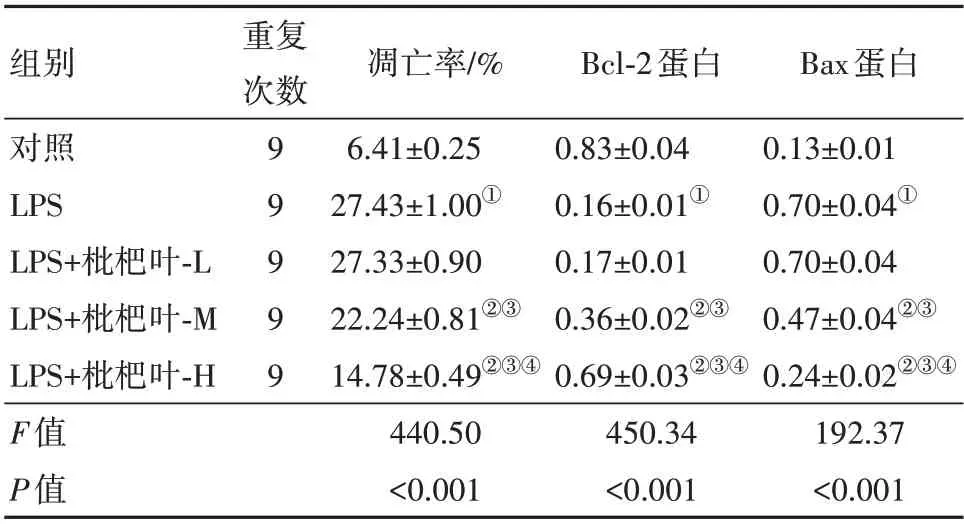
表1 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549凋亡的影响/± s
注:Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X。①与对照组相比,P<0.05。②与LPS组相比,P<0.05。③与LPS+枇杷叶-L组相比,P<0.05。④与LPS+枇杷叶-M组相比,P<0.05。
重复次数Bax蛋白0.13±0.01 0.70±0.04①0.70±0.04 0.47±0.04②③0.24±0.02②③④192.37<0.001组别对照LPS LPS+枇杷叶-L LPS+枇杷叶-M LPS+枇杷叶-H F值P值99999凋亡率/%6.41±0.25 27.43±1.00①27.33±0.90 22.24±0.81②③14.78±0.49②③④440.50<0.001 Bcl-2蛋白0.83±0.04 0.16±0.01①0.17±0.01 0.36±0.02②③0.69±0.03②③④450.34<0.001
2.3 枇杷叶提取物对LPS诱导A549氧化应激的影响与对照组比较,LPS 组SOD 的含量降低,LDH、丙二醛的含量升高;与LPS 组比较,LPS+枇杷叶-M组、LPS+枇杷叶-H组SOD的含量升高,LDH、丙二醛的含量降低(均P<0.05),见表2。
表2 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549氧化应激的影响/± s
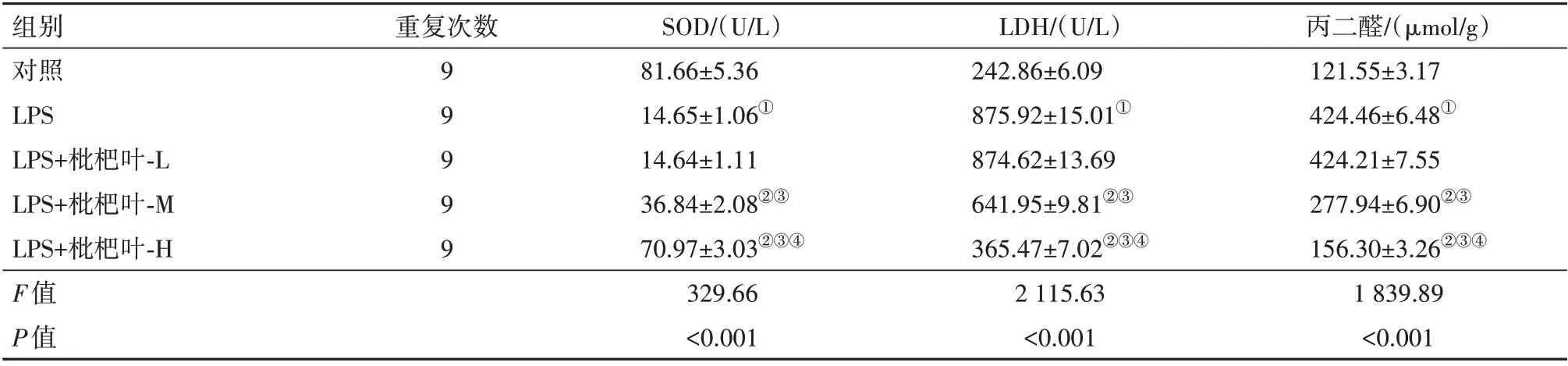
表2 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549氧化应激的影响/± s
注:SOD为超氧化物歧化酶,LDH为乳酸脱氢酶。①与对照组相比,P<0.05。②与LPS组相比,P<0.05。③与LPS+枇杷叶-L组相比,P<0.05。④与LPS+枇杷叶-M组相比,P<0.05。
组别对照LPS LPS+枇杷叶-L LPS+枇杷叶-M LPS+枇杷叶-H F值P值丙二醛/(µmol/g)121.55±3.17 424.46±6.48①424.21±7.55 277.94±6.90②③156.30±3.26②③④1 839.89<0.001重复次数99999 SOD/(U/L)81.66±5.36 14.65±1.06①14.64±1.11 36.84±2.08②③70.97±3.03②③④329.66<0.001 LDH/(U/L)242.86±6.09 875.92±15.01①874.62±13.69 641.95±9.81②③365.47±7.02②③④2 115.63<0.001
2.4 枇杷叶提取物对LPS 诱导A549 中PI3K/Akt信号通路的影响与对照组比较,LPS 组p-PI3K、p-Akt 蛋白水平降低;与LPS 组比较,LPS+枇杷叶-M组、LPS+枇杷叶-H 组p-PI3K、p-Akt 蛋白水平升高(均P<0.05),见图2、表3。
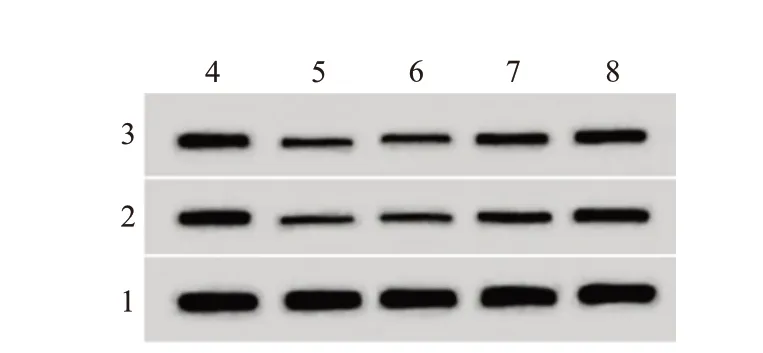
图2 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路的影响
表3 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路的影响/± s
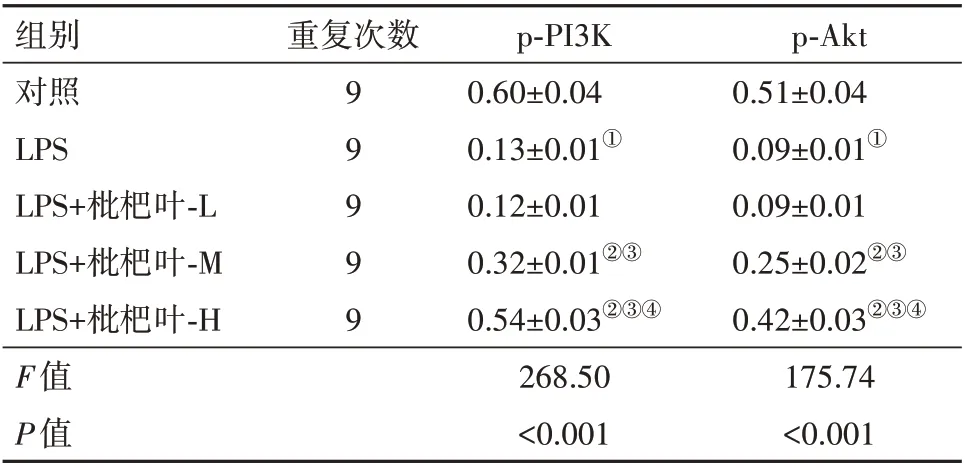
表3 枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路的影响/± s
注:p-PI3K为磷酸化磷脂酰肌醇-3-激酶,p-Akt为磷酸化蛋白激酶B。①与对照组相比,P<0.05。②与LPS组相比,P<0.05。③与LPS+枇杷叶-L组相比,P<0.05。④与LPS+枇杷叶-M组相比,P<0.05。
p-Akt 0.51±0.04 0.09±0.01①0.09±0.01 0.25±0.02②③0.42±0.03②③④175.74<0.001组别对照LPS LPS+枇杷叶-L LPS+枇杷叶-M LPS+枇杷叶-H F值P值重复次数99999 p-PI3K 0.60±0.04 0.13±0.01①0.12±0.01 0.32±0.01②③0.54±0.03②③④268.50<0.001
2.5 LY294002 对枇杷叶提取物处理的LPS 诱导A549细胞活性和凋亡的作用与LPS+枇杷叶-H 组比较,LPS+枇杷叶-H+LY294002 组吸光度降低,凋亡率升高,Bax 蛋白水平升高,Bcl-2 蛋白水平降低(均P<0.05),见图3、表4。
表4 磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路抑制剂LY294002可逆转枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549活性和凋亡的作用/± s
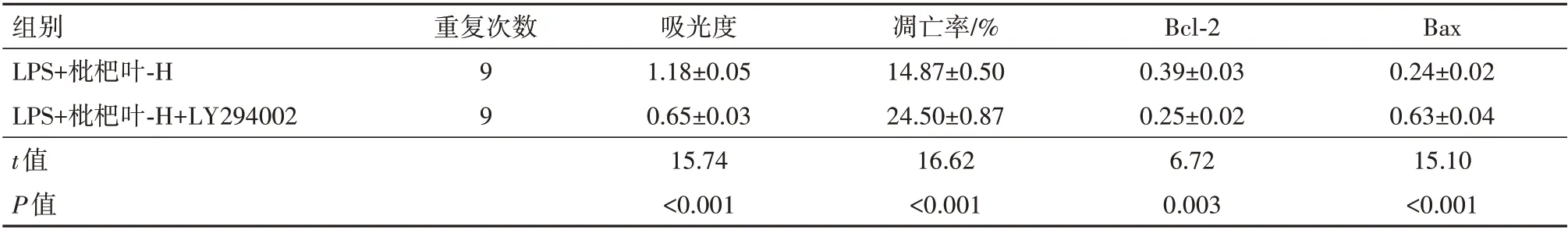
表4 磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路抑制剂LY294002可逆转枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549活性和凋亡的作用/± s
注:Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X。
组别LPS+枇杷叶-H LPS+枇杷叶-H+LY294002 t值P值Bax 0.24±0.02 0.63±0.04 15.10<0.001重复次数99吸光度1.18±0.05 0.65±0.03 15.74<0.001凋亡率/%14.87±0.50 24.50±0.87 16.62<0.001 Bcl-2 0.39±0.03 0.25±0.02 6.72 0.003

图3 磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路抑制剂LY294002可逆转枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549凋亡蛋白表达的影响
2.6 LY294002 对枇杷叶提取物处理的LPS 诱导A549细胞氧化应激的影响与LPS+枇杷叶-H 组比较,LPS+枇杷叶-H+LY294002 组SOD 的含量降低,LDH、丙二醛的含量升高(均P<0.05),见表5。
表5 磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路抑制剂LY294002可逆转枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549氧化应激的影响/± s
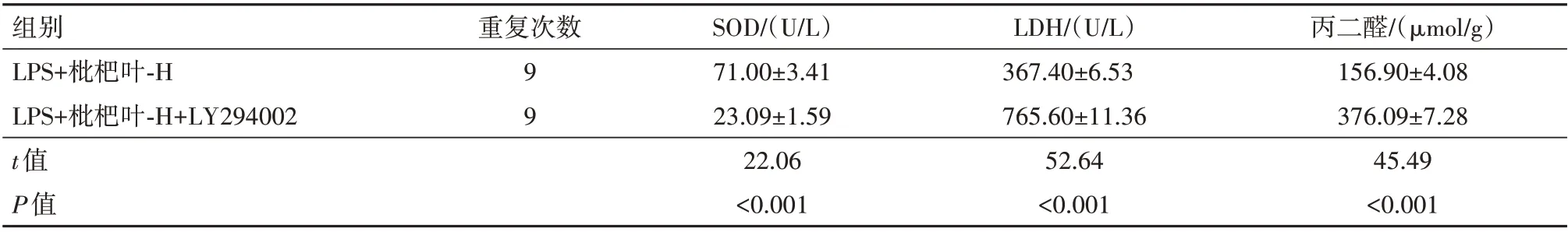
表5 磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路抑制剂LY294002可逆转枇杷叶提取物对脂多糖(LPS)诱导的人Ⅱ型肺泡上皮细胞A549氧化应激的影响/± s
注:SOD为超氧化物歧化酶,LDH为乳酸脱氢酶。
组别LPS+枇杷叶-H LPS+枇杷叶-H+LY294002 t值P值丙二醛/(µmol/g)156.90±4.08 376.09±7.28 45.49<0.001重复次数99 SOD/(U/L)71.00±3.41 23.09±1.59 22.06<0.001 LDH/(U/L)367.40±6.53 765.60±11.36 52.64<0.001
3 讨论
急性肺损伤是临床常见的一种急危重症,中药在治疗急性肺损伤方面具有一定作用,黄酮类樱草素可改善LPS诱导的急性肺损伤[10]。黄芪素通过诱导血红素加氧酶-1 减轻脂多糖诱导的大鼠急性肺损伤[11]。但其对急性肺损伤的作用机制尚未阐明。
枇杷叶提取物具有抗炎、抗病毒等作用,并可保护心脑血管,但关于其作用机制尚未阐明[12]。本研究结果显示,A549 细胞经LPS 诱导后细胞活力降低,而枇杷叶提取物可明显提高细胞活力,且显示剂量依赖关系,随着枇杷叶提取物剂量增加细胞活力明显提高,提示枇杷叶提取物可解除LPS 诱导的A549 细胞增殖抑制。Bcl-2 属于抗凋亡蛋白,Bax 属于促凋亡蛋白,其表达水平升高可激活线粒体途径从而诱导细胞凋亡[13]。本研究结果显示,LPS 诱导的A549 细胞凋亡率升高,并可促进Bax 表达及抑制Bcl-2 表达,枇杷叶提取物可明显降低细胞凋亡率,并可抑制Bax 表达及促进Bcl-2 表达,提示枇杷叶提取物可明显抑制LPS诱导的A549细胞凋亡,且呈剂量依赖性。活性氧可诱导支气管上皮细胞释放炎性因子从而诱导肺组织炎症反应,还可造成线粒体膜损伤从而引起细胞凋亡,SOD 可清除氧自由基从而减轻机体氧化损伤,丙二醛是脂质过氧化的中间产物,并可作为脂质过氧化的指标,LDH 含量升高可引起氧化损伤[14]。本研究结果显示,LPS 诱导的A549 细胞中SOD 的含量降低,LDH、丙二醛的含量升高,而枇杷叶提取物可明显提高SOD 的含量及降低LDH、丙二醛的含量,且枇杷叶提取物不同剂量氧化应激指标间比较差异有统计学意义,提示枇杷叶提取物可抑制LPS 诱导的A549 细胞氧化应激从而抑制细胞凋亡。
甘草酸通过活化PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mTOR)途径改善LPS 诱导的急性肺损伤[15]。人参皂苷Rg3 可通过激活PI3K/AKT/mTOR途径减轻LPS 诱导的急性肺损伤[16]。PI3K/AKT 信号通路活化可抑制急性肺损伤中细胞凋亡、内质网应激和炎症反应[17]。PI3K/AKT 信号通路激活剂SC79 可减轻d-Gal/LPS 诱导的肝损伤[18]。本研究结果显示,LPS 诱导的A549 细胞中p-PI3K、p-Akt 蛋白水平降低,枇杷叶提取物可明显提高p-PI3K、p-Akt蛋白水平,且呈剂量依赖性,提示枇杷叶提取物可能通过激活PI3K/Akt信号通路从而减轻LPS诱导的急性肺损伤。同时本研究结果显示,添加PI3K/Akt信号通路抑制剂LY294002 后可明显降低LPS 诱导A549 细胞活力,提高细胞凋亡率,并可降低SOD 的含量及提高LDH、丙二醛的含量,提示抑制PI3K/Akt 信号通路可明显逆转枇杷叶提取物对LPS 诱导A549细胞增殖、凋亡及氧化应激的作用。
综上所述,枇杷叶提取物可以对LPS 诱导的A549 细胞的增殖、凋亡及氧化应激产生影响,而PI3K/Akt信号通路活化同样可抑制急性肺损伤中细胞凋亡、内质网应激等,因此推测枇杷叶提取物可以通过PI3K/Akt 信号通路对肺损伤中细胞凋亡等进程产生治疗作用。枇杷叶提取物可通过激活PI3K/Akt 信号通路而解除LPS 诱导的A549 细胞增殖抑制及氧化应激引起的细胞凋亡,减轻LPS 诱导的细胞损伤,为进一步揭示枇杷叶提取物治疗急性肺损伤的分子机制提供依据。

