金茵利胆胶囊的高效液相色谱指纹图谱及其抗氧化作用的灰色关联分析
曹凡,陈琳,宋忠兴,唐志书,3*,倪健(.陕西中医药大学,陕西 咸阳 7000;.陕西省中药资源产业化协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西省创新药物研究中心,陕西 咸阳 7083;3.中国中医科学院,北京 00700;4.北京中医药大学北京中医药研究院,北京 0009)
中药复方制剂金茵利胆胶囊由茵陈、金钱草、郁金和枳壳四味药材加工制成,具有疏肝利胆、清热除湿之功效,临床上广泛应用于肝胆湿热证的改善,疗效显著。茵陈、金钱草作为“保肝要药”“排石金药”,常作为保肝利胆的药材在复方中发挥作用。现代药理学研究表明,茵陈中主要是绿原酸、对羟基苯乙酮、6,7-二甲氧基香豆素、茵陈色原酮等化学成分发挥利胆作用,且绿原酸有很好的保肝作用。金钱草全草含有槲皮素等黄酮类化合物以及多糖等成分,具有清热解毒、抗炎、利湿退黄等药理活性。
金茵利胆胶囊现行企业标准“含量测定”项下,规定采用枳壳中柚皮苷作为检测指标进行含量测定,本品每粒含枳壳以柚皮苷(CHO)计,不得少于0.8 mg,以达到对金茵利胆胶囊进行质量控制的目的。单一成分的含量测定不能对制剂的质量进行全面有效控制。市面上金茵利胆相关复方制剂还包括金茵利胆口服液、金茵利胆灵合剂以及金茵利胆颗粒。笔者通过查阅文献,发现仅有金茵利胆口服液指纹图谱、柚皮苷和橙皮苷含量测定以及金茵利胆颗粒中绿原酸含量测定的相关报道,未见金茵利胆胶囊化学成分的定性定量分析。本研究采用HPLC 对15 批金茵利胆胶囊样品进行相似度分析,建立其谱效关系,以期为金茵利胆胶囊的指标性成分筛选以及质量控制提供有效的分析方法和数据支持。
1 材料
1260 型高效液相色谱仪(美国Agilent 安捷伦);Milli-Q 纯水/超纯水一体机(美国Millipore公司);ME204 电子天平[梅特勒-托利多仪器(上海)有限公司];CPA225D 电子天平[赛多利斯科学仪器(北京)有限公司];KQ-300DE数控超声波清洗器(昆山超声仪器有限公司);VORTEX-5 漩涡混匀仪(海门其林贝尔仪器有限公司)。
新绿原酸(批号:HR20422B1)、隐绿原酸(批号:HR20423B1)、绿原酸(批号:HCD21133198)、1,3-二咖啡酰奎宁酸(批号:H0071330198)(对照品,宝鸡辰光生物科技有限公司);对羟基苯乙酮(批号:111897-201602)、柚皮苷(批号:110722-201815)、新橙皮苷(批号:1108091857-201804)(对照品,中国食品药品检定研究院);各对照品纯度均大于98%。金茵利胆胶囊(S1 ~S15,批号:20200301,20200302,20200401,20200402,20200403,20200404,20200501,20200601,202000901,20200902,20201001,20201002,20201003,20201004,20201101,陕西盘龙药业集团股份有限公司)。甲醇(分析纯,成都市科隆化学品有限公司);甲醇、乙腈(色谱纯,Honeywell公司);磷酸(色谱纯,天津市科密欧化学试剂有限公司)。
2 方法与结果
2.1 色谱条件
色谱柱InertSustain C(4.6 mm×150 mm,5 μm);流动相0.05% 磷酸水(A)-乙腈(B),梯度洗脱(0 ~8 min,5%~12%B;8 ~14 min,12% ~15%B;14 ~26 min,15% ~27%B;26 ~30 min,27% ~28%B;30 ~41 min,28% ~40%B;41 ~54 min,40% ~80%B;54 ~55 min,80%~5%B;55 ~65 min,5%B;后运行5 min); 流速1.0 mL·min; 柱温30 ℃;检测波长282 nm;进样量5 μL。
2.2 溶液的制备
2.2.1 对照品溶液的制备 精密称取新绿原酸、隐绿原酸、绿原酸、1,3-二咖啡酰奎宁酸、对羟基苯乙酮、柚皮苷和新橙皮苷对照品适量,加甲醇配成单一对照品储备溶液。吸取各对照品储备液适量,稀释成质量浓度分别为0.3、0.3、0.167、0.1、0.133、0.6、0.3 mg·mL的混合对照品储备溶液,4℃保存,备用。
2.2.2 供试品溶液的制备 取金茵利胆胶囊内容物约0.3 g,精密加入70% 甲醇9 mL,密塞,称重,超声处理30 min(功率300 W,频率40 kHz,超声温度45 ℃),放冷,70% 甲醇补足,摇匀,3000 r·min离心2 min,0.22 μm 微孔滤膜滤过,取续滤液作为供试品溶液。
2.2.3 阴性样品溶液的制备 按处方比例取金钱草、茵陈、郁金和枳壳单味药材以及缺金钱草、缺茵陈、缺郁金和缺枳壳的样品,按金茵利胆胶囊生产工艺制备,过滤,浓缩,喷雾干燥,得到各单味药材以及阴性样品干燥粉末,按“2.2.2”项下方法制备即得。
2.3 指纹图谱方法学考察
2.3.1 精密度 取同一批金茵利胆胶囊样品(批号:20190902)制备成供试品溶液,连续进样6次,记录色谱图中各峰面积。以21 号峰(柚皮苷)为参照峰,23 个共有峰相对保留时间RSD
值均小于1.0%,相对峰面积的RSD
值均小于3.0%,表明仪器精密度良好。2.3.2 重复性 取同一批金茵利胆胶囊样品(批号:20190902)制备成供试品溶液6 份,进样测定。以21 号峰(柚皮苷)为参照峰,23 个共有峰相对保留时间RSD
值均小于1.0%,相对峰面积的RSD
值均小于3.0%,表明本方法的重复性良好。2.3.3 稳定性 取同一批金茵利胆胶囊样品(批号:20190902)制备成供试品溶液,分别在0、2、4、8、12、24 h 各进样1 次,记录色谱峰面积。以21 号峰(柚皮苷)为参照峰,23 个共有峰相对保留时间RSD
值均小于1.0%,相对峰面积的RSD
值均小于3.0%,表明供试品溶液在24 h 内稳定。2.4 指纹图谱建立
2.4.1 多批样品指纹图及共有峰 精密称取15批金茵利胆胶囊内容物约0.3 g,制成供试品溶液。取供试品溶液各5 μL,进样测定,记录色谱图。采用国家药典委员会的“中药色谱指纹图谱相似度评价系统(2012 版)”,分析15 批样品HPLC 色谱图,时间窗宽度设为0.3 min,采用中位数法;通过多点校正后,全峰匹配图谱;得到15 批金茵利胆胶囊样品的指纹图谱共有模式见图1,得到23 个共有峰。
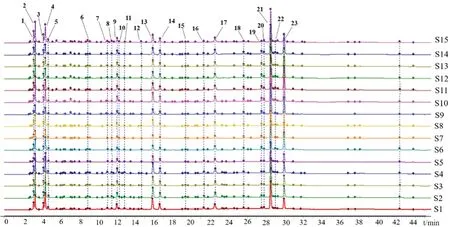
图1 15 批金茵利胆胶囊的HPLC 指纹图谱Fig 1 HPLC fingerprint of 15 batches of Jinyin Lidan capsules
2.4.2 相似度评价 以S1 为对照图谱,对金茵利胆胶囊样品的指纹图谱进行相似度计算。结果显示,15 批金茵利胆胶囊样品的指纹图谱与对照图谱的相似度均大于0.900。
2.4.3 特征峰的指认及归属 根据色谱峰保留时间稳定、峰面积相对较高及检测率达100%的原则,经过与混合对照品PDA 光谱图对比,共指认了其中7 个共有峰,分别为新绿原酸(9 号峰)、隐绿原酸(13 号峰)、绿原酸(14 号峰)、1,3-二咖啡酰奎宁酸(16 号峰)、对羟基苯乙酮(17 号峰)、柚皮苷(21 号峰)、新橙皮苷(23 号峰)。混合对照品和代表性样品(S1)的HPLC 图见图2。

图2 混合对照品(A)、金茵利胆胶囊 S1(B)的HPLC 图Fig 2 HPLC chromatogram of mixed control(A)and Jinyin Lidan capsule S1(B)
分别吸取供试品溶液、阴性样品溶液各5 μL,记录色谱图。依据各色谱峰的紫外吸收光谱和相对保留时间,确定各特征峰的归属。其中,9 号峰新绿原酸、13 号峰隐绿原酸、14 号峰绿原酸、16 号峰1,3-二咖啡酰奎宁酸17 号峰对羟基苯乙酮归属于茵陈,21 号峰柚皮苷归属于枳壳,23 号新橙皮苷归属于茵陈、枳壳。各药材、阴性样品以及样品的HPLC 图见图3。
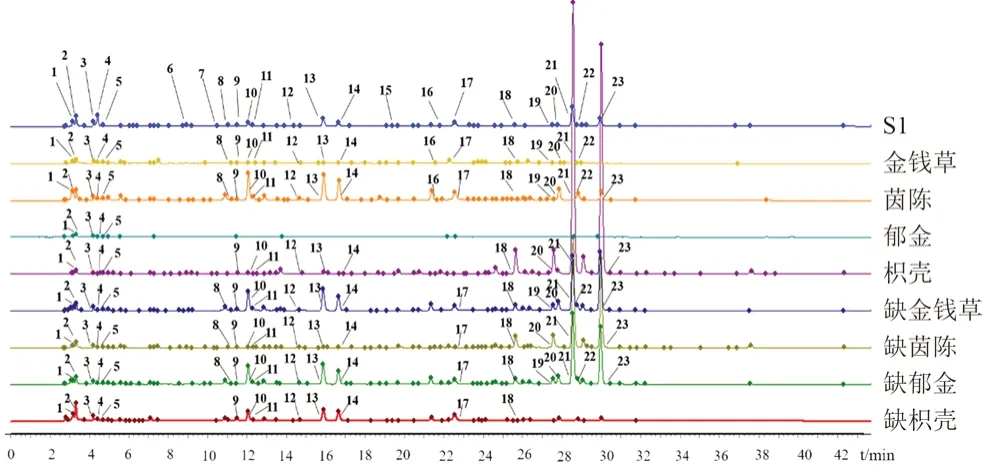
图3 金茵利胆胶囊、单味药材以及各阴性药材HPLC 图Fig 3 Chromatogram of Jinyin Lidan capsule,single medicinal materials and negative medicine materials
2.5 抗氧化活性分析
2.5.1 供试品溶液的制备 对金茵利胆胶囊中的4 味药材粉末进行U(7)均匀设计,茵陈按0 ~2400 mg,金钱草、郁金均按0 ~1200 mg,枳壳按0 ~600 mg 配比,得到7 组样品配比,另外按处方原配比增设一组样品N0,共计8 个样品配比组(见表1)。根据均匀设计表的配比,加入样品总重量10 倍量的70%甲醇溶解提取药材粉末,超声50 min,离心,取上清液,过0.45 μm 滤膜,水浴挥干甲醇。用原样本体积15%DMSO 复溶,涡旋超声溶解,作为供试品储备溶液,4 ℃保存备用。
表1 金茵利胆胶囊U (7)均匀设计表
Tab 1 U (7) uniform design of Jinyin Lidan capsules
序号茵陈/mg金钱草/mg郁金/mg枳壳/mg N01200600600300 N10200400500 N24006001000400 N38001000200300 N412000800200 N516004000100 N620008006000 N7240012001200600
2.5.2 DPPH 自由基清除率 精密称取7.88 mg DPPH 粉末,加无水乙醇定容至100 mL,得0.2 mmol·LDPPH 自由基储备液,现配现用。取“2.5.1”项下一定量的供试品储备溶液,加70% 甲醇配成系列质量浓度的供试品溶液(1.0、0.5、0.25、0.125、0.0625、0.031 25 mg·mL)。各吸取供试品溶液100 μL、DPPH 自由基溶液100 μL 于96 孔板中,室温下避光反应30 min,采用酶标仪于517 nm 处测定DPPH 自由基溶液+系列质量浓度的供试品溶液吸光度(A
),系列质量浓度的供试品溶液(100 μL)+70% 甲醇(100 μL)吸光度(A
),DPPH 自由基溶液(100 μL)+70%甲醇(100 μL)同法测吸光度(A
)。维生素C 作为阳性对照,清除率=[A
-(A
-A
)]/A
,采用SPSS Statistics 25 中Probit 模型预测半数抑制浓度(IC
),结果见表2。2.5.3 ABTS 自由基清除率 分别配制7 mmol·LABTS 水溶液和2.45 mmol·LKSO水溶液,同体积混合,暗处放置12 ~16 h,使用前加蒸馏水稀释,使其在734 nm 处吸光度为(0.8±0.02),即得ABTS 工作液。取“2.5.1”项下一定量的供试品储备溶液,加70%甲醇配成系列质量浓度的供试品溶液(1.0、0.5、0.25、0.125、0.0625、0.03125 mg·mL)。分别吸取各供试品溶液20 μL、ABTS 自由基工作液180 μL 于96 孔板中,室温下避光反应10 min,采用酶标仪于734 nm 处测定ABTS 自由基溶液+系列质量浓度的供试品溶液吸光度(A
),系列质量浓度的供试品溶液(180 μL)+70% 甲醇(20 μL)的吸光度(A
),DPPH 自由基溶液(180 μL)+70% 甲醇(20 μL)的吸光度(A
)。维生素C 作为阳性对照,采用SPSS Statistics 25 中Probit 模型预测半数抑制浓度(IC
),结果见表2。表2 样品N0 ~N7 结果
Tab 2 of sample N0 ~N7
编号IC50/(mg·mL-1)DPPHABTS维生素C0.0370.016 N00.1780.085 N10.8930.160 N20.2470.157 N30.1700.130 N40.2550.135 N50.2340.151 N60.2000.146 N70.2010.118
由表2 可以看出,不同配比的N0 ~N7 样品均具有一定的抗氧化活性,且都弱于维生素C。综合来看,N0抗氧化活性较强,N1抗氧化活性最弱。
3 指纹图谱与抗氧化活性的灰色关联分析
将清除DPPH 自由基和清除ABTS 自由基的IC
作为母序列,23 个共有峰峰面积作为子序列,参照文献方法,进行灰色关联分析。对数据进行无量纲化处理,标准化处理后,计算母序列与子序列绝对差得到绝对差序列,进而求得关联系数得到关联度,分辨系数ρ
取0.5。各子序列对母序列的关联系数平均值即得各色谱峰与DPPH 和 ABTS 活性的关联度值,见表3 和4。将各子序列对母序列的关联度按大小顺序排列起来,组成关联序。依据关联度大小,确定了N0 ~N7 样品中各成分对清除DPPH 和ABTS 自由基活性贡献的大小顺序。
表3 金茵利胆胶囊的指纹图谱与DPPH 自由基清除活性的关联序
Tab 3 Correlation between the fingerprint of Jinyin Lidan capsule and DPPH free radical scavenging activity
关联序峰号关联度关联序峰号关联度1120.780 13 30.735 2 90.757 14 40.735 3140.757 15190.726 4100.757 16210.726 5230.755 17110.724 6 80.755 18220.720 7170.754 19 20.719 8130.754 20180.709 9 70.754 21150.664 10200.750 22 10.636 11 50.744 23160.503 12 60.739
表4 金茵利胆胶囊的指纹图谱与ABTS 自由基清除活性的关联序
Tab 4 Correlation between the fingerprint of Jinyin Lidan capsule and ABTS free radical scavenging activity
关联序峰号关联度关联序峰号关联度1120.702 13190.646 2140.675 14210.646 3230.675 15 30.643 4100.674 16 40.642 5170.671 17220.638 6 80.671 18110.633 7130.671 19 20.623 8 90.669 20180.621 9 70.667 21150.565 10200.663 22 10.508 11 50.655 23160.403 12 60.649
对不同配比的N0 ~N7 样品的HPLC 指纹图谱中23 个共有峰峰面积与其抗氧化活性进行灰色关联度以及关联序分析,根据关联度的大小确定各色谱峰对抗氧化活性的贡献度。综合两者结果可以看出,峰12 抗氧化活性贡献度最强,峰14 抗氧化活性贡献度次之,峰16(1,3-二咖啡酰奎宁酸)抗氧化活性贡献度最弱,其中指纹图谱指认出峰14 为绿原酸、峰9 为新绿原酸、峰17 为对羟基苯乙酮、峰13 为隐绿原酸、峰23 为新橙皮苷关联度排名靠前,具有一定的抗氧化贡献力,反映出这几个峰是其抗氧化药效较为重要的色谱峰,在复方中发挥抗氧化的作用较大。
4 讨论
本研究对15 批次金茵利胆胶囊进行指纹图谱分析。考察了乙腈-水、甲醇-水以及乙腈-不同比例(0.05%,0.1%)的甲酸、磷酸等含酸溶液作为流动相,不同检测波长(256、282、310、320 nm),不同柱温(25、30 及45℃)以及不同流速(0.8、1.0 mL·min)对金茵利胆胶囊中化学成分的分离能力,结果乙腈-0.05%磷酸水溶液作为流动相,柱温为30 ℃、流速为1.0 mL·min,检测波长为282 nm 下进行梯度洗脱时,主要色谱峰分离度>1.5,出峰数量较多,谱图清晰,具有很好的分离效果。接着考察不同提取溶剂(50%甲醇、70%甲醇、100%甲醇以及水)、药材 ∶ 溶剂比例(1∶20、1∶30、1∶40、1∶80)、超声时间(30、60、90 min)以及超声温度(25、45、60℃)对金茵利胆胶囊内容物化学成分提取的影响,最终选择70% 甲醇,药材∶溶剂比为1∶30,30 min 作为超声时间,45℃作为超声温度为最优条件对金茵利胆胶囊化学成分进行提取。
本研究还以清除DPPH 自由基和ABTS 自由基的IC
来评价均匀设计的8 个金茵利胆胶囊样品的抗氧化活性。结果表明均匀设计的8 个金茵利胆胶囊样品均具有一定的抗氧化活性,综合分析,N0 抗氧化活性最强,N1 抗氧化活性最弱,N0 抗氧化活性最强可能的原因为原方中四味中药的配比比较合适,所提取出的复方中的成分使其抗氧化活性最强。本研究还采用灰色关联度分析方法,将N0 ~N7 样品HPLC 谱图与其抗氧化作用的关联度进行量化分析。结果显示,不同配比的N0 ~N7 样品23 个共有峰与DPPH 清除率的关联度在0.780 ~0.503,与ABTS 清除率的关联度在0.702 ~0.403。其中,峰9 为新绿原酸、峰14 为绿原酸、峰17 为对羟基苯乙酮、峰13 为隐绿原酸、峰23 为新橙皮苷,这几个峰是其抗氧化药效较为重要的色谱峰,峰12 抗氧化活性最大,具体是哪种成分有待进一步鉴定。综上所述,本研究采用HPLC 的方法建立了金茵利胆胶囊的指纹图谱,共标定了23 种共有峰,结合灰色关联度分析的统计方法,将金茵利胆的“谱”与“效”进行关联分析,为金茵利胆抗氧化活性成分的筛选及其质量控制与评价提供参考。

