用氯酸盐从杂铜阳极泥浸铜渣中氯化浸出金钯银铅
朱小磊,马 昀,冯 晖
(南京工业大学 化工学院,江苏 南京 211816)
杂铜阳极泥浸铜渣的处理工艺有火法和湿法。火法是先将物料投入电炉熔炼成锡铅锑合金,再分步回收其他有价金属,污染较大、能耗较高、设备成本高[1-4]。湿法中较成熟工艺是用氰化钠浸出,再分步回收稀贵金属;由于浸出剂氰化钠有剧毒,近年来已明令禁止使用。因此,选择适宜的浸出剂是湿法处理杂铜阳极泥浸铜渣的核心问题[5-8]。
试验研究了采用氯酸钠配加氯盐作浸出剂[9-10],同时浸出金、钯、银、铅,再利用氯化物在溶液中溶解度的差异,通过控制温度使金、钯进入液相,银、铅进入固相,分步回收有价金属。
1 试验部分
1.1 试验原料、试剂及仪器
杂铜阳极泥浸铜渣的元素分析结果见表1,粒度分布如图1所示,XRD分析图谱如图2所示。杂铜阳极泥浸铜渣中含铜较少,以锡、铅为主,贵金属金、银、钯在一定程度上得到富集。杂铜阳极泥浸铜渣粒径很小,大部分颗粒粒径在10 μm左右,平均8.65 μm;其中的锡主要是以二氧化锡形式存在,铅主要以硫酸铅形式存在。
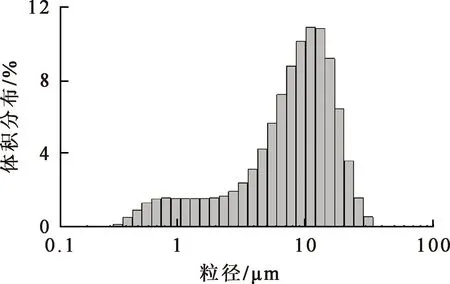
图1 杂铜阳极泥浸铜渣的粒度分布
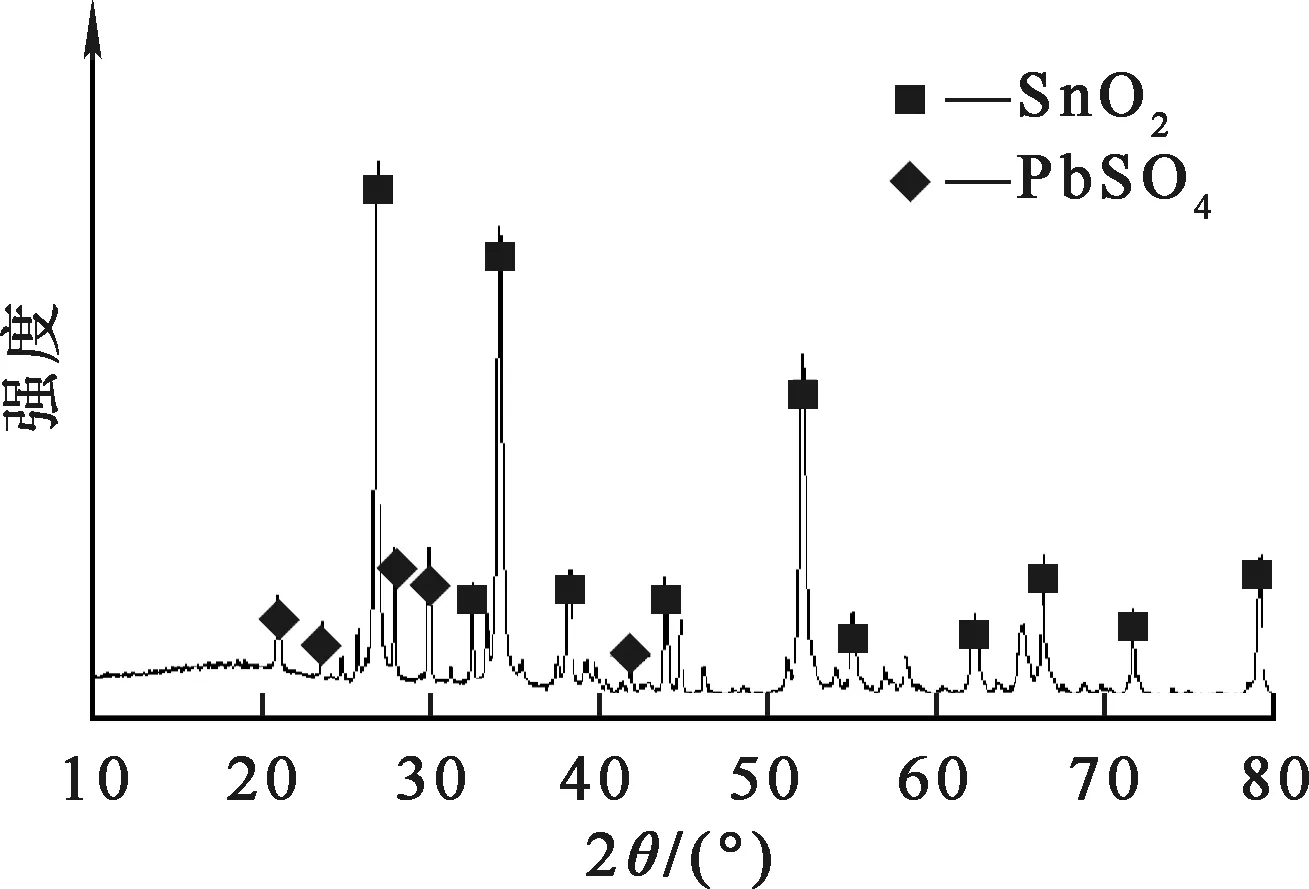
图2 杂铜阳极泥浸铜渣的XRD图谱
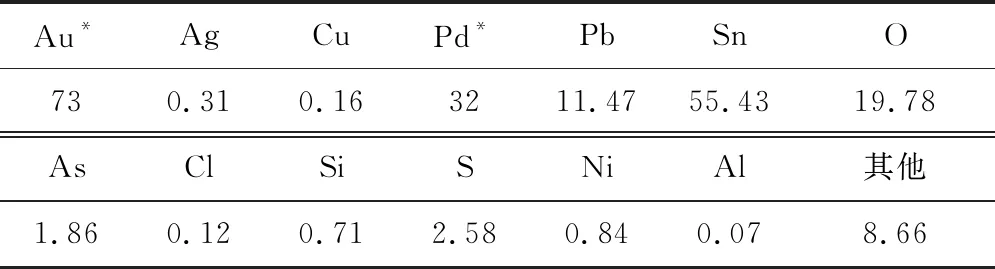
表1 杂铜阳极泥浸铜渣的元素分析结果 %
试验所用试剂:盐酸、氯化钠、氯化钙、氯酸钠、氢氧化钠,均为分析纯;水为去离子水。
试验所用仪器:恒速电动搅拌器,pH计,循环水式真空泵,集热式恒温磁力搅拌器,电热鼓风干燥箱,分析天平,恒温水浴锅,原子吸收分光光度计,X射线衍射仪,激光粒度分析仪,X射线荧光光谱仪。
1.2 试验原理与方法
金、钯的标准电极电势分别为:

(1)

(2)
将金和钯从单质变为离子需要高电极电势的氧化剂。当以氯酸钠为氧化剂时,酸性条件下的标准电极电势为:
(3)
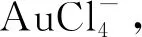
(4)
(5)
反应式(5)的标准吉布斯自由能小于零,标准状态下可以自发进行。
(6)
反应式(6)的标准吉布斯自由能也小于零,标准状态下也可自发进行。所以,氯酸钠可用于氧化溶解金、钯。
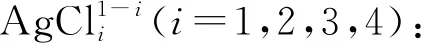
(7)
(8)
根据式(8)可计算出,氯化银配合物的累计生成常数βi:lgβ1=2.69,lgβ2=4.75,lgβ3=5.40,lgβ4=5.92。
铅在杂铜阳极泥浸铜渣中主要以硫酸铅物相存在,在氯盐溶液中的反应如下:

(9)
(10)
(11)
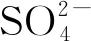

(12)
不同温度下,溶液中氯化银与氯化铅的溶解度与氯离子浓度之间的关系[11]见表2。
根据表2及杂铜阳极泥浸铜渣中铅、银质量分数可定量确定铅、银完全溶解时的条件。计算过程如下:
假设杂铜阳极泥浸铜渣质量1 kg,在液固质量比4/1条件下进行反应,可得铅、银质量摩尔浓度:
1.38×10-1mol/kg;
7.18×10-3mol/kg。
根据计算结果,参考表2数据可知,只有当温度超过75 ℃,氯离子质量摩尔浓度超过4 mol/kg时,才能保证铅、银完全浸出。
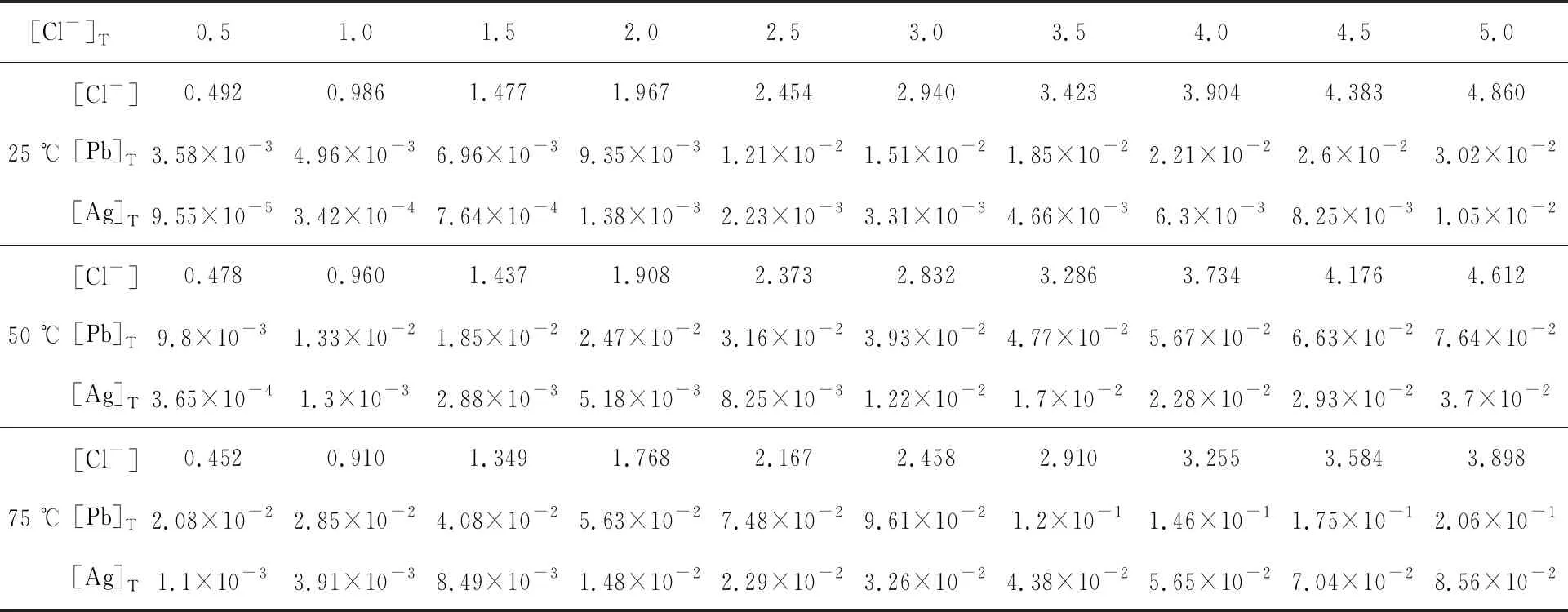
表2 不同温度下,氯化银、氯化铅溶解度与氯离子浓度之间的关系 mol/kg
1.3 试验步骤
将烘干研磨后的杂铜阳极泥浸铜渣置入烧杯中,按液固质量比4/1加入预先配制好的一定浓度的盐酸溶液,再加入一定质量氯化钠和氯化钙,开启搅拌。至氯化钠和氯化钙完全溶解后,放入恒温水浴锅中开始升温。达到一定温度后,缓慢加入氯酸钠,反应一定时间后,趁热过滤,滤渣经洗涤、干燥、称重后分析其中金、银、钯、铅质量分数,计算浸出率。滤液为氯化液,静置冷却至室温,用于循环浸出,待金、钯达到一定浓度后,回收金、钯。
1.4 计算方法
金、钯、银、铅浸出率计算公式为
式中:mB—杂铜阳极泥浸铜渣中金、钯、银、铅质量,g;mB′—浸出渣中金、钯、银、铅质量,g。
2 试验结果与讨论
2.1 金、钯浸出
2.1.1 氯酸钠质量浓度对金、钯浸出率的影响
盐酸浓度3.0 mol/L,氯化钠加入量200 g/L,氯化钙加入量50 g/L,反应时间4 h,反应温度80 ℃,氯酸钠质量浓度对金、钯浸出率的影响试验结果如图3所示。可以看出:金、钯浸出率随氯酸钠质量浓度增大而升高,氯酸钠质量浓度为12 g/L后趋于稳定。提高氯酸钠质量浓度有利于反应正向进行;但氯酸钠质量浓度过大,会增加生产成本,且氯酸钠是强氧化剂,溶液中残留量太高不利于后续金、钯的还原:综合考虑,确定适宜的氯酸钠质量浓度为12 g/L。
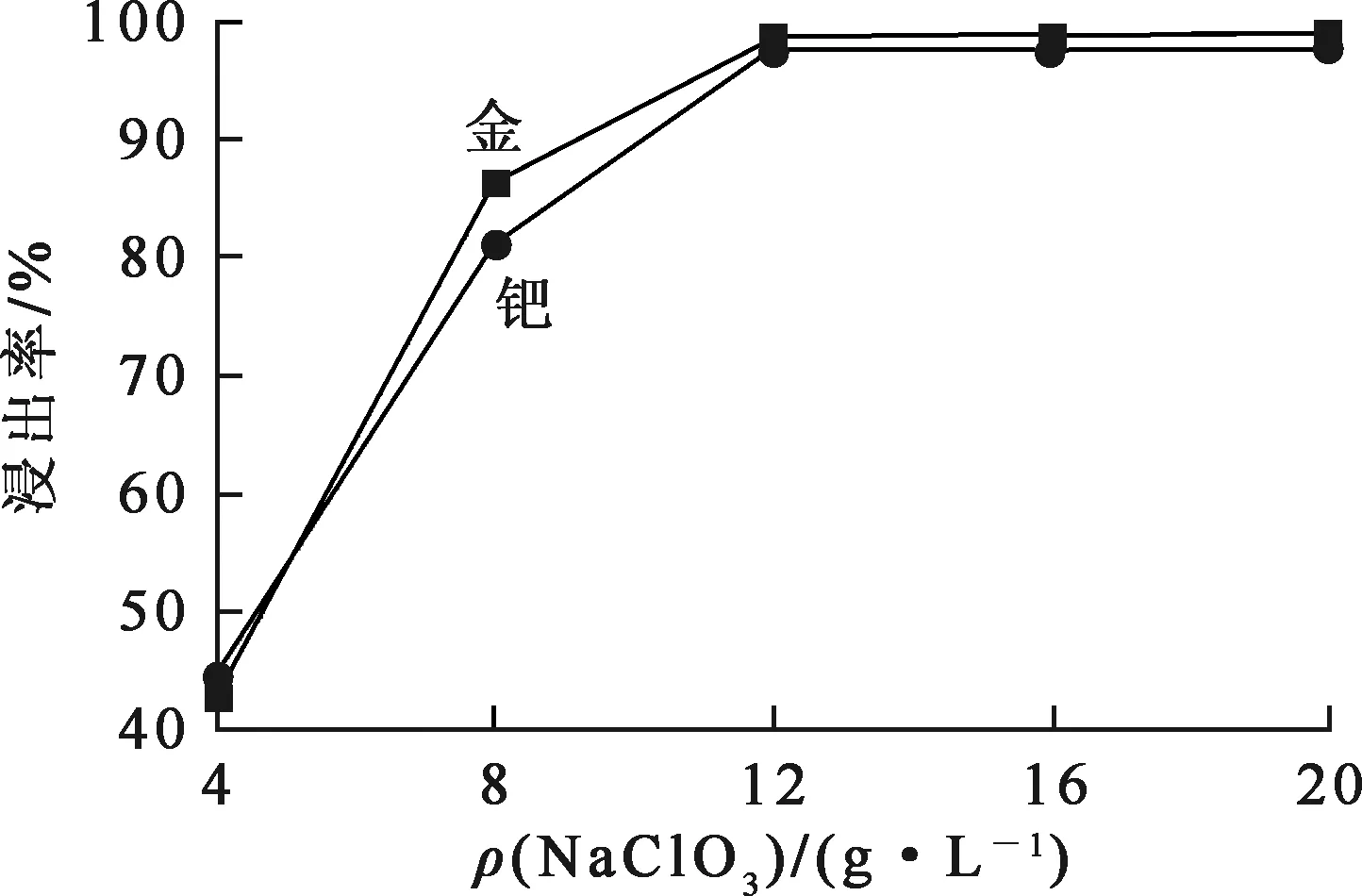
图3 氯酸钠质量浓度对金、钯浸出率的影响
2.1.2 盐酸浓度对金、钯浸出率的影响
氯酸钠质量浓度12 g/L,氯化钠加入量200 g/L,氯化钙加入量50 g/L,反应时间4 h,反应温度80 ℃,盐酸浓度对金、钯浸出率的影响试验结果如图4所示。
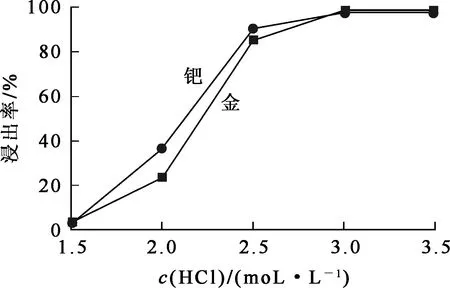
图4 盐酸浓度对金、钯浸出率的影响
由图4看出:金、钯浸出率随盐酸浓度增大而升高;盐酸浓度增至3.0 mol/L后,金、钯浸出率变化不大。因为氯酸钠只有在一定酸度溶液中才具有强氧化性,盐酸浓度过低,溶液酸度不够,不利于氯酸钠发挥氧化作用,综合考虑,确定适宜的盐酸浓度为3.0 mol/L。
2.1.3 反应时间对金、钯浸出率的影响
盐酸浓度3.0 mol/L,氯酸钠质量浓度12 g/L,氯化钠加入量200 g/L,氯化钙加入量50 g/L,反应温度80 ℃,反应时间对金、钯浸出率的影响试验结果如图5所示。
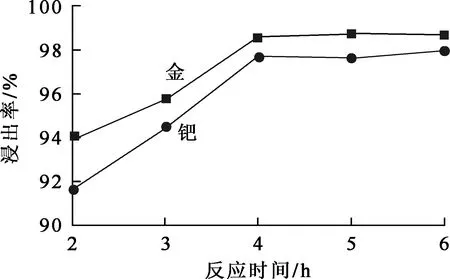
图5 反应时间对金、钯浸出率的影响
由图5看出:金、钯浸出率随反应进行不断提高,反应4 h后趋于稳定。金、钯的化学性质非常稳定,氯酸钠的浸出速率较慢,需要较长时间。综合考虑,确定适宜的反应时间为4 h。
2.1.4 反应温度对金、钯浸出率的影响
盐酸浓度3.0 mol/L,氯酸钠质量浓度12 g/L,氯化钠加入量200 g/L,氯化钙加入量50 g/L,反应时间4 h,反应温度对金、钯浸出率的影响试验结果如图6所示。
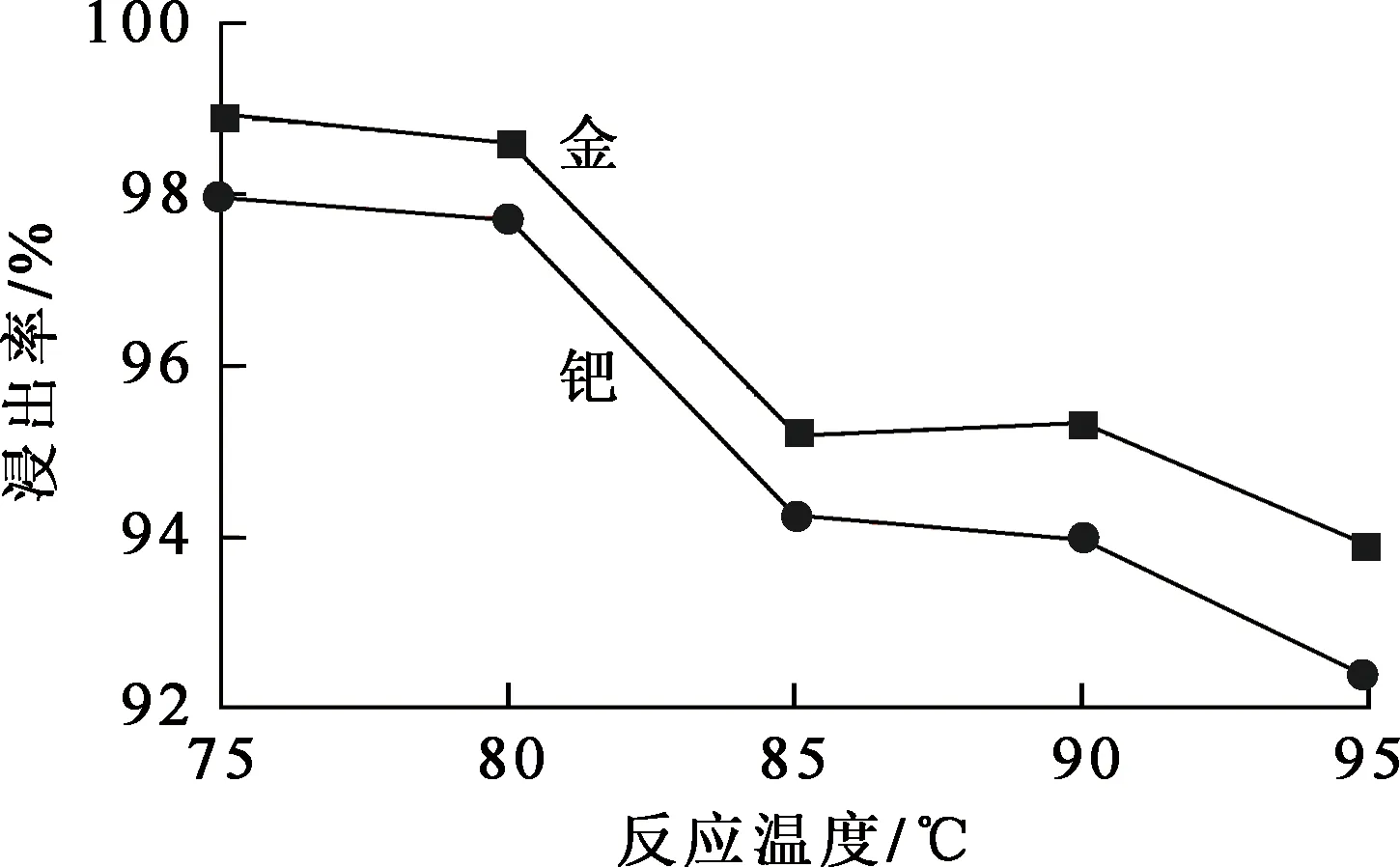
图6 反应温度对金、钯浸出率的影响
由图6看出,金、钯浸出率随反应温度升高而降低。这是因为氯酸钠分解产生氯气,而氯气是起重要作用的氧化剂;氯酸钠在溶液中的溶解度随温度升高而降低,且会加快氯气逸出,导致参与反应的氯气减少,金、钯浸出率下降。综合考虑,确定适宜的反应温度为75 ℃。
2.2 验证试验
根据条件试验确定适宜浸出条件为:盐酸浓度3.0 mol/L,氯酸钠质量浓度12 g/L,氯化钠加入量200 g/L,氯化钙加入量50 g/L,反应时间4 h,反应温度75 ℃。重复进行5次验证试验。浸出渣的主要成分见表3,物相分析结果如图7所示。
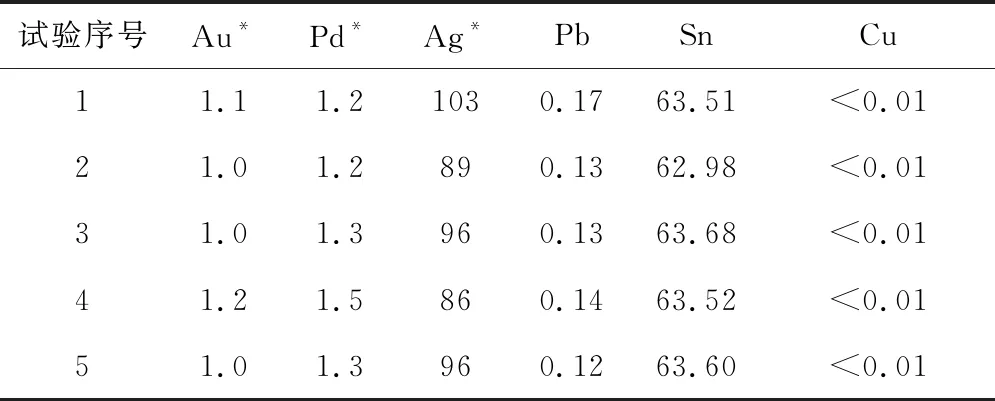
表3 浸出渣的主要成分 %
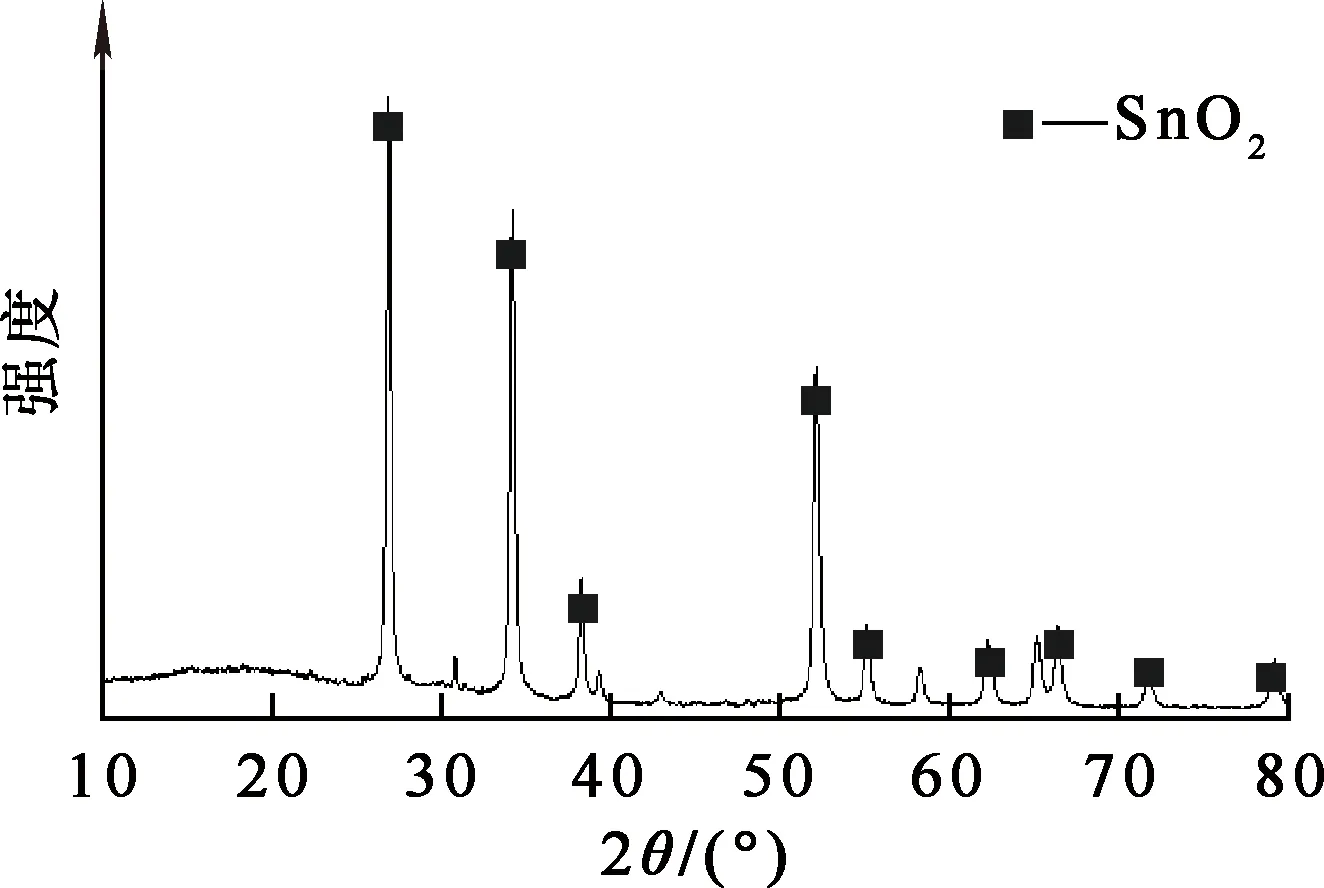
图7 浸出渣的XRD图谱
对比表1、3看出:浸出渣中Au、Pd、Ag、Pb、Cu质量分数均有所下降,而锡质量分数有很大幅度提高。
由图7看出:浸出渣中,锡得到富集,主要以二氧化锡形式存在,且衍射峰明显,强度大,杂峰少。说明锡不参与高氯盐的氯化反应,其存在形式未发生改变。浸出渣中其他杂质很少,是精炼锡的优质原料。
根据反应前后固体渣质量及渣中金属质量分数,计算5次氯化浸出试验的金、钯、银、铅浸出率,试验结果见表4。可以看出,Au、Pd、Ag、Pb浸出率都很高,浸出效果较好。
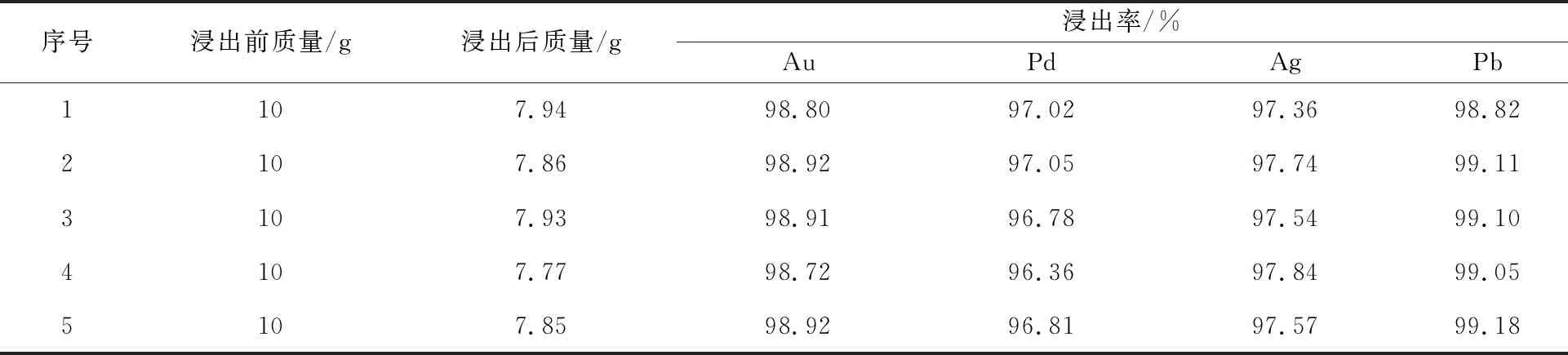
表4 5次氯化浸出试验的金、钯、银、铅浸出率
3 结论
用氯酸盐从杂铜阳极泥浸铜渣中氯化浸出金、钯、银、铅是可行的。适宜条件下,金、钯、银、铅浸出效果较好;浸出渣中锡质量分数达63.5%,锡得到较好富集,且以二氧化锡物相形式存在,可用于回收锡。此方法对环境无污染,处理成本低,可以实现杂铜阳极泥浸铜渣的综合回收。

