大麻素受体1抑制剂促进线粒体生物发生改善脓毒症小鼠肠麻痹的机制研究
杨亚男 刘 英 冯安琪 马 磊 殷 敏
脓毒症是临床上手术、创伤、烧伤以及休克等疾病的常见并发症,往往合并多器官衰竭导致患者死亡。肠道是严重脓毒症受累最早和最严重的器官之一[1]。脓毒症诱发肠道运动功能障碍及肠黏膜屏障损伤,使细菌和毒素侵入循环系统向全身转移,形成第二次感染(肠源性感染),是启动多器官功能障碍综合征的重要因素[2,3]。因此,改善脓毒症合并肠麻痹是治疗该类患者的重要手段。研究表明,脓毒症时机体释放大量内源性大麻素,通过刺激大麻素受体1(cannabinoid receptor 1,CB1)抑制肠道动力而引起肠麻痹[4]。CB1受体抑制剂可促进肠道运动功能,但其作用机制尚不明确。本研究拟探索CB1受体抑制剂是否通过促进肠神经元线粒体生物发生改善脓毒症小鼠肠动力。
材料与方法
1.实验材料:(1)动物:雄性C57小鼠,6~8周龄,体质量为18~25g,由空军军医大学实验动物中心提供,在空军军医大学基础医学部神经生物研究所动物房统一喂养,每笼3~4只,将饲养环境的温度调节至19~23℃,湿度调节在61%~71%,模拟正常白天黑夜。(2)试剂:LPS、AM251、伊文思蓝、甲基纤维素试剂购自西格玛奥德里奇(上海)贸易有限公司,Nrf-1抗体、TFAM抗体、COX-Ⅳ抗体和HRP山羊抗兔IgG购自深圳欣博盛生物科技有限公司,ACTIN抗体购自上海佰晔生物科技有限公司,BCA蛋白定量试剂盒购自赛默飞世尔科技(中国)有限公司。
2.LPS动物模型制备:依据既往文献报道,选择腹腔注射脂多糖(LPS)30 mg/kg建立小鼠脓毒症模型[5]。造模后小鼠逐渐出现竖毛、闭眼、眼角出现分泌物、腹泻、浓尿,表现出饮水、进食及活动次数明显减少、嗜睡,解剖后肠道表现为脓性糜烂状。
3.动物分组:C57小鼠随机分为3组,每组20只。sham组,腹腔注射LPS等量0.9%NaCl注射液,30min后再注射AM251等量0.9%NaCl注射液。LPS组,腹腔注射LPS 30mg/kg,30min后注射AM251等量0.9%NaCl注射液。AM251组,腹腔注射LPS 30mg/kg,30min后腹腔注射AM251 3mg/kg。48h后按组别分别测定小鼠肠动力变化、检测线粒体生物发生相关蛋白的变化及结肠神经元线粒体数量和体积的变化。
4.肠动力实验:(1)肠运输时间实验:前一天晚上禁食、自由饮水,每只小鼠灌胃100μl伊文思蓝甲基纤维素溶液,将小鼠分笼饲养,笼中铺白布观察蓝色物质排出时间。以第1次出现蓝色粪便为终点,每只小鼠观察8h。(2)结肠排珠时间实验:前一天晚上禁食、自由饮水,小鼠用异氟醚麻醉,将直径为2mm的玻璃通过肛门插入,用定制的覆盖硅管的套管轻轻推入2cm。退出套管,等待小鼠苏醒,观察玻璃珠排出时间。(3)小肠推进率实验:前一天晚上禁食自由饮水,每个小鼠灌胃100μl伊文思蓝甲基纤维素溶液,20min后脱颈处死小鼠,轻轻剥离后取出整个消化道贲门至结肠末端,测量小肠全长及推进距离。计算小肠推进率(%)=推进距离/小肠全长×100%。
5.Western blot法检测:取整个结肠组织用0.9%NaCl注射液冲洗组织,滤纸吸干净水后称重、标记并置于干净的EP管中放至-80℃冰箱,以备提蛋白所用;使用RIPA裂解液经研磨、超声震荡、冰上静置、离心后取上清即为提取的结肠组织蛋白,使用BCA 试剂盒进行蛋白定量,然后制样、煮样;使用碧云天试剂盒,按照配方配置SDS-PAGE凝胶(12%凝胶),每孔加入100μg蛋白,根据目的蛋白电泳位置停止电泳,电泳完转膜,在转膜结束后将带有目的蛋白的PVDF膜浸入封闭液中封闭2h,后将PVDF膜放入一抗孵育袋中(Nrf-1:1∶500;TFAM:1∶2000;COX-Ⅳ:1∶3000;β-actin:1∶5000),4℃摇床中孵育过夜。山羊抗兔二抗(1∶1000),室温在摇床上孵育2h,准备发光液,A∶B=1∶1,混匀,避光,将发光液均匀滴在PVDF膜上,尽量去除残夜,将 PVDF 膜置于凝胶成像系统发光成像,并分析条带灰度值。
6.透射电镜观察线粒体数量和体积:取材方法如上,后浸泡于空军军医大学电镜室专用固定液固定,并由其做后续处理并拍摄电镜图片。

结 果
1.AM251能够促进肠麻痹小鼠肠动力恢复:与sham组比较,C57小鼠腹腔注射LPS 30mg/kg 30min后48h,肠运输时间延长(192s vs 325s,P=0.006);小肠推进率降低(68% vs 47%,P<0.001),结肠排珠时间延长(71s vs 375s,P<0.001);与LPS组比较, AM251组可缩短肠运输时间(325.0s vs 187.5s,P=0.006),增加小肠推进率(47% vs 70%,P<0.001),降低结肠排珠时间(375s vs 82s,P<0.001),差异有统计学意义,详见图1。

图1 AM251对肠麻痹小鼠肠动力的影响(n=5)与sham组比较, *P<0.01;与LPS组比较,#P<0.01
2.CB1受体抑制剂能够促进肠麻痹小鼠线粒体的生物发生:与sham组比较,C57小鼠腹腔注射LPS 30mg/kg 30min后48h,线粒体生物发生相关蛋白分子Nrf-1、TFAM、COX-Ⅳ蛋白表达明显降低(Nrf-1:0.651 vs 0.414,P=0.028;TFAM:0.565 vs 0.332,P=0.009;COX-Ⅳ:0.846 vs 0.371,P=0.006), 与LPS组比较,给予AM251后可明显增加线粒体生物发生相关蛋白分子Nrf-1(0.414 vs 0.807,P=0.028)、TFAM(0.739 vs 0.332,P=0.0091)、COX-Ⅳ(0.371 vs 0.817,P=0.006)的表达,差异有统计学意义,详见图2。
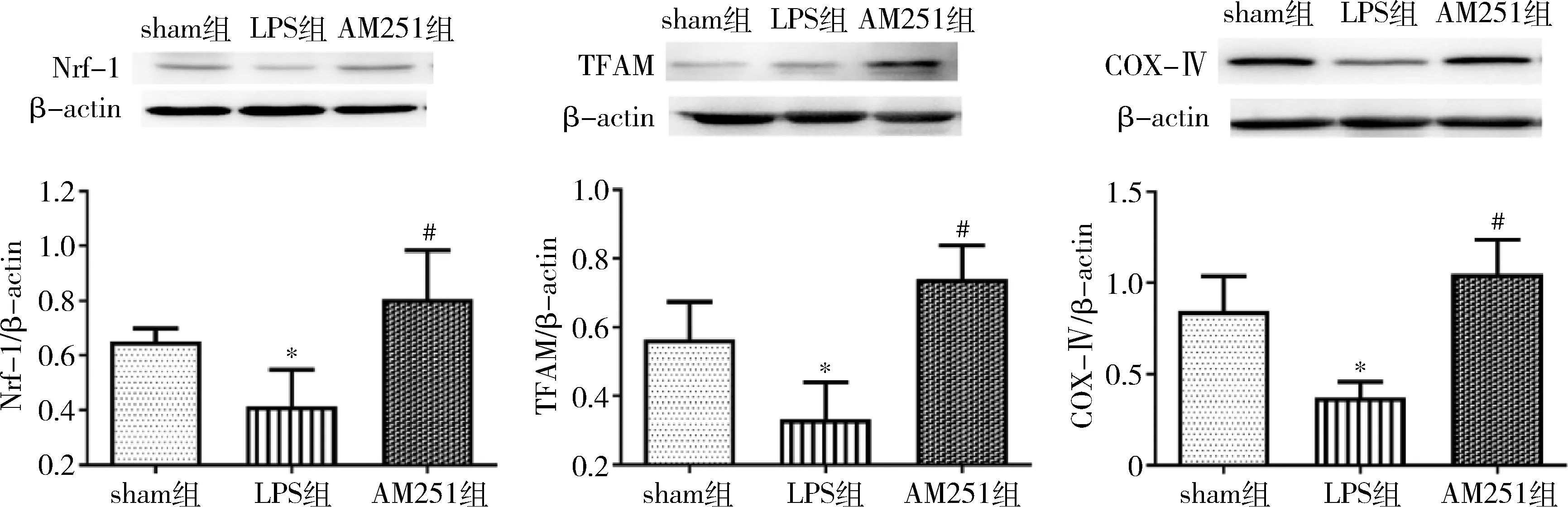
图2 AM251对肠麻痹小鼠线粒体生物发生相关蛋白表达的影响(n=5)与sham组比较, *P<0.01;与LPS组比较,#P<0.01
3.CB1受体抑制剂能够增加肠麻痹小鼠肠神经元线粒体数量及质量:通过透射电镜观察小鼠肠神经元线粒体形态,发现sham组线粒体的大小基本正常,基质均匀,边界及结构清晰,线粒体的嵴致密饱满; LPS组小鼠肠神经元线粒体的数量明显减少,大小不一无规律,形态不规整,边界不清,线粒体大部分有明显的肿胀和空泡样变性,基质不均匀,结构模糊,肿胀的线粒体嵴有较明显的断裂。给予CB1受体抑制剂AM251后,形态学上可以看出,线粒体的损伤明显被改善,详见图3A。利用透射电镜观察肠麻痹小鼠结肠肌间神经丛肠神经元线粒体数量和体积,统计分析结果显示,与正常组比较,LPS组小鼠线粒体数量明显降低,线粒体体积也有所降低,给予CB1受体抑制剂AM251后可明显增加LPS小鼠线粒体的数量(P=0.015)和体积(P=0.004),详见图3B、C。
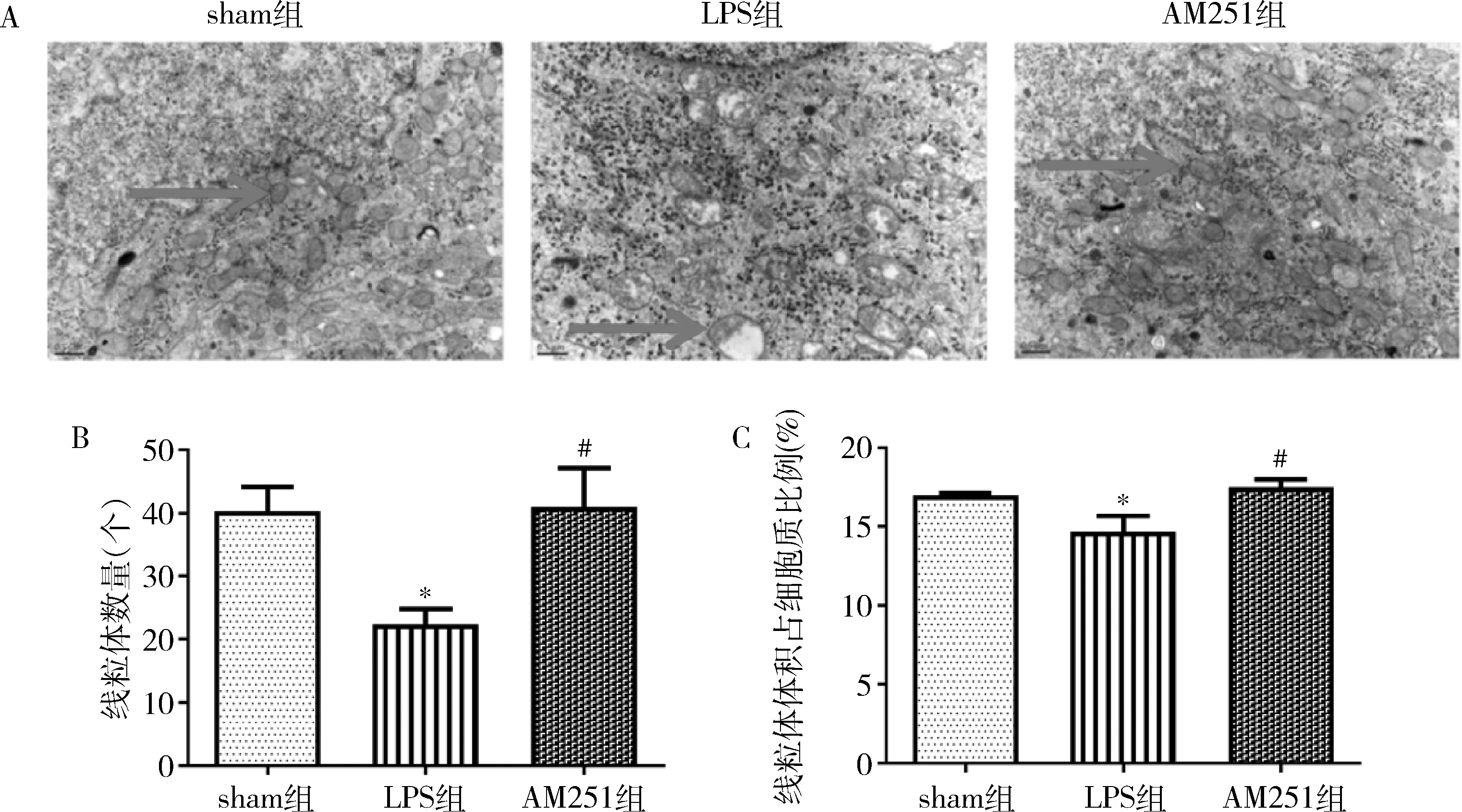
图3 肠神经元及其线粒体形态及数目变化(n=5)
讨 论
脓毒症是细菌、真菌、病毒等感染因素诱发的伤害性炎性反应,严重脓毒症影响的首要器官之一就是肠道。大麻素是胃肠道运动的重要调节剂,近年来,内源性大麻素系统在肠道病理生理中的作用,尤其是对胃肠道炎症及动力变化的调节作用越来越被重视。调节内源性大麻素的生物合成和降解可用于短期治疗肠易激综合征和其他功能性肠病[6,7]。有研究表明,脓毒症时肠道炎症刺激会促进大量内源性大麻素的释放,给予CB1受体抑制剂会促进肠动力恢复[8,9]。因此,早期改善脓毒症患者胃肠道功能是防止脓毒症发展的关键环节,也是提高此类患者治疗及预后效果的重要途径。
肠神经系统是内源性大麻素系统表达的主要部位,肠神经系统单独或与外源性神经元(如交感神经或非交感神经)共同作用,调整几乎全部的肠道功能,包含营养物质的吸收与分泌、肠道运输功能、血运以及免疫反应等[10,11]。肠道神经元在其中有着至关重要的作用,大量研究表明,肠道神经元损伤、功能缺失将严重影响胃肠道动力功能,包括胃排空时间、小肠运输时间及结肠运动功能[12]。在啮齿动物中给予CB1受体抑制剂可增加胃肠道动力,而给予CB1受体激动剂可抑制胃肠道动力[13]。研究发现,敲除CB1受体的小鼠胃肠动力明显增强。CB1受体的抑制剂可分别用于治疗由乙酸和LPS诱导的麻痹性肠梗阻,CB1受体抑制剂AM251,也能减轻长春新碱引起的麻痹性肠梗阻[14]。和本研究结论AM251能够促进肠麻痹小鼠肠动力恢复的结论一致。
线粒体是真核生物细胞有氧呼吸、氧化代谢的关键部位,为细胞制造能量。维持线粒体活力是细胞应对外界生物反应的基础,对神经元完成其正常功能至关重要。线粒体作为高度动态变化的细胞器,通过调节线粒体的形态、数量及功能结构与功能的完整对于维持肠神经系统正常的生理学功能至关重要[15]。研究发现,肠神经系统对线粒体功能障碍特别敏感,小鼠肠神经系统的线粒体代谢障碍会导致显著的胃肠功能障碍和运动障碍,破坏Tfam-ENSKO小鼠肠神经系统的线粒体代谢导致显著的胃肠功能障碍和运动障碍[16]。
透射电镜对线粒体的形态及数目进行观察和计数发现,正常小鼠肠神经元线粒体的大小基本正常,基质均匀,边界及结构清晰,线粒体的嵴致密饱满,未见明显的线粒体肿胀及空泡样改变,而脓毒症肠麻痹小鼠肠神经元线粒体的数量明显减少,大小不一,形态不规整,边界不清,排列不规则,线粒体大部分有明显的肿胀和空泡样变性,基质不均匀,结构模糊,肿胀的线粒体嵴有较明显的断裂,给予CB1受体抑制剂AM251后,形态学上可以看出,线粒体的损伤明显被改善。统计分析结果显示,肠麻痹小鼠线粒体数量及体积均明显降低,而给予CB1受体抑制剂AM251后可增加线粒体的数量及体积。
本研究认为,脓毒症小鼠肠麻痹可能与肠神经系统线粒体损伤有关。线粒体在生理过程中不断进行着生物发生、自噬、分裂和融合等变化,线粒体的动态变化在肠道的多种损伤与修复阶段起到重要作用,线粒体在多种伤害性因素的刺激下,为维持原来的能量供应,会增加线粒体数量和质量,将需氧调定点增加到原来的水平,也就是线粒体生物发生。Nrf-1有诱导线粒体基因转录的作用,与编码呼吸亚基的基因启动子、线粒体转录因子TFAM和TFBs结合,共同调节线粒体转录,是线粒体电子传递链功能正常发挥的关键因子所在[17]。TFAM是线粒体基因开始转录的关键调控因子,决定着线粒体基因是否开始转录,对线粒体生物发生和胚胎发育至关重要,并对线粒体 DNA 复制的数量、组装等过程起着调节作用[18]。也就是说,上调 Nrf-1和TFAM是线粒体的生物发生的标志。本研究发现,脓毒症肠麻痹小鼠生物发生相关蛋白Nrf-1、TFAM、COX-Ⅳ的表达明显降低,给于CB1受体抑制剂可增加Nrf-1、TFAM、COX-Ⅳ的表达。因此,笔者认为保持肠神经元线粒体的结构完整和功能完善,促进其生物发生,是外源性CB1受体抑制剂保护肠麻痹小鼠肠道运动功能的重要机制,也是改善脓毒症预后的有效途径。

