下调lncRNA CTC-425F1.4靶向调控miR-146a-3p表达对膀胱癌细胞的增殖和侵袭的影响
杨金辉 郝彤彤 杨凌博 康延杰 李小辉 魏澎涛 孙建涛
膀胱癌是最常见的泌尿系统恶性肿瘤,具有易转移和易复发的特点,患者预后往往较差[1]。研究表明,恶性增殖和侵袭是膀胱癌发展的主要原因[2]。研究膀胱癌恶性进展的具体机制是寻找有效治疗靶点的基础。长链非编码RNA(long-chain non-coding RNA,lncRNA)在不同类型细胞中发挥的功能不同,参与调节细胞的运动、脂代谢、糖代谢、免疫等生理和病理进程[3~5]。近年来研究显示,lncRNA与膀胱癌的恶性进展显著相关,参与调节膀胱癌细胞的恶性增殖和侵袭,研究lncRNA在膀胱癌中的功能对膀胱癌的靶向治疗具有重要意义[6~8]。CTC-425F1.4长度为270个核苷酸,是一个全新的lncRNA,目前对于CTC-425F1.4在肿瘤细胞中的作用尚不明确。本研究旨在探讨膀胱癌组织和细胞株中CTC-425F1.4的表达,观察下调CTC-425F1.4对膀胱癌细胞增殖和侵袭的影响及探讨其靶向调控机制,为CTC-425F1.4靶向治疗膀胱癌提供参考。
材料与方法
1.材料:选取郑州大学附属洛阳中心医院泌尿外科2018年1月~2021年5月手术切除的膀胱癌组织及对应的癌旁组织(距离肿瘤边缘5cm),患者术前均未接受过免疫治疗、放疗、内分泌治疗、化疗等抗肿瘤治疗。所有纳入研究的组织标本均经病理检查确诊。本研究经笔者医院医学伦理学委员会批准(伦理审批号:LWLL-2021-07-15),患者均已签署知情同意书。Transwell小室购自美国康宁公司。LipofectamineTM3000购自美国Invitrogen公司。膀胱癌细胞UM-UC-3、T24、RT4、5637和正常膀胱上皮细胞SV-HUC-1购自中国科学院上海细胞库。CTC-425F1.4抑制剂、阴性对照序列(control)、miR-146a-3p模拟物、阴性模拟物(NC)、野生型WT和突变型MUT荧光素酶报告载体购自上海吉玛制药技术有限公司。荧光定量PCR试剂盒购自南京凯基生物科技发展有限公司。CCK-8试剂盒购自北京百奥莱博科技有限公司。一抗微管蛋白(α-tubulin)、细胞周期蛋白依赖性激酶抑制因子21(p21)、E盒结合锌指蛋白1(Zeb1)、波形蛋白(Vimentin)、锌指蛋白(Snail)购自美国Cell Signaling Technology公司。
2.细胞培养和转染:于37℃、体积分数为5%的CO2的培养箱中,T24、RT4、5637细胞用含10%胎牛血清的RPMI-1640完全培养基培养,UM-UC-3、SV-HUC-1细胞用含10%胎牛血清的DMEM高糖培养基。膀胱癌RT4细胞分成inhibitor组和control组,根据LipofectamineTM3000说明书分别转染CTC-425F1.4抑制剂和阴性对照序列。转染后32h后,检测CTC-425F1.4下调效果。
3.荧光实时定量PCR检测CTC-425F1.4、miR-146a-3p表达差异:在液氮中将膀胱癌组织和癌旁组织研磨成粉末,以TRIzol试剂提取组织和处于对数生长期细胞的总RNA,分光光度计检测RNA浓度和纯度,合成cDNA,建立荧光定量PCR体系。分别以β-actin和U6为内参,采用2-ΔΔCt方法分析CTC-425F1.4和miR-146a-3p表达水平。荧光实时定量PCR引物序列详见表1。

表1 荧光实时定量PCR引物序列
4.生物信息学方法:生物信息学软件GEPIA分析CTC-425F1.4在膀胱癌组织和癌旁组织中的表达差异。生物信息学软件LncBase Predicted v.2的CTC-425F1.4的靶基因。
5.CCK-8法检测下调CTC-425F1.4对RT4细胞增殖能力的影响:将inhibitor组和control组以2000个/孔细胞接种在96孔板,分别在培养24、48、72、96、120h后终止培养。每孔加入70μl CCK-8反应液,培养箱内反应2.5h,通过酶联免疫检测仪分析每孔在预设波长(490nm)的吸光度(A)值。以A值为纵坐标,时间(h)为横坐标,绘制RT4细胞生长曲线。
6.Transwell小室法检测下调CTC-425F1.4对RT4细胞侵袭能力的影响:在Transwell小室加入稀释后的基质胶溶液,培养箱静置5h凝固。将inhibitor组和control组以30000个/室细胞接种在上室,下室加入含10%胎牛血清的培养基。培养32h,棉签擦去未穿小室膜的RT4细胞,将小室在多聚甲醛溶液中固定40min,在0.7%结晶紫溶液中染色40min。通过光学显微镜计数(放大倍数100倍),随机选取6个视野计算平均数。
7.荧光素酶报告系统鉴定CTC-425F1.4的靶基因:将NC、miR-146a-3p分别同荧光素酶报告载体(WT和MUT)共转染膀胱癌RT4细胞,WT含有CTC-425F1.4的结合位点,MUT含有突变后的CTC-425F1.4的结合位点。培养箱孵育48h,通过荧光素酶活性测定试剂盒分析各组RT4细胞中的相对荧光素酶活性。
8.Western blot法检测p21、Zeb1、Vimentin、Snail蛋白的表达:磷酸缓冲液洗涤inhibitor组和control组细胞,添加裂解溶液冰上裂解。上样至10%的SDS-PAGE凝胶,上层胶电压为80V,下层胶电压为130V。转膜电流为290mA,转膜后的硝酸纤维素膜在封闭液中封闭3h,在一抗反应液中过夜孵育,在辣根过氧化物酶标记的二抗中孵育1.5h。均匀孵育电化学发光试剂,曝光显影,α-tubulin为内参。

结 果
1.CTC-425F1.4在膀胱癌组织和癌旁组织中的表达:生物信息学软件GEPIA分析显示(图1),膀胱癌组织中CTC-425F1.4表达水平明显高于癌旁组织(P<0.01)。本研究通过荧光实时定量PCR显示,详见图2,膀胱癌组织和癌旁组织中CTC-425F1.4的表达分别为3.21±0.26和1.05±0.15,膀胱癌组织中CTC-425F1.4表达水平明显明显高于癌旁组织(P<0.01)。

图1 GEPIA分析膀胱癌组织和癌旁组织中CTC-425F1.4表达水平
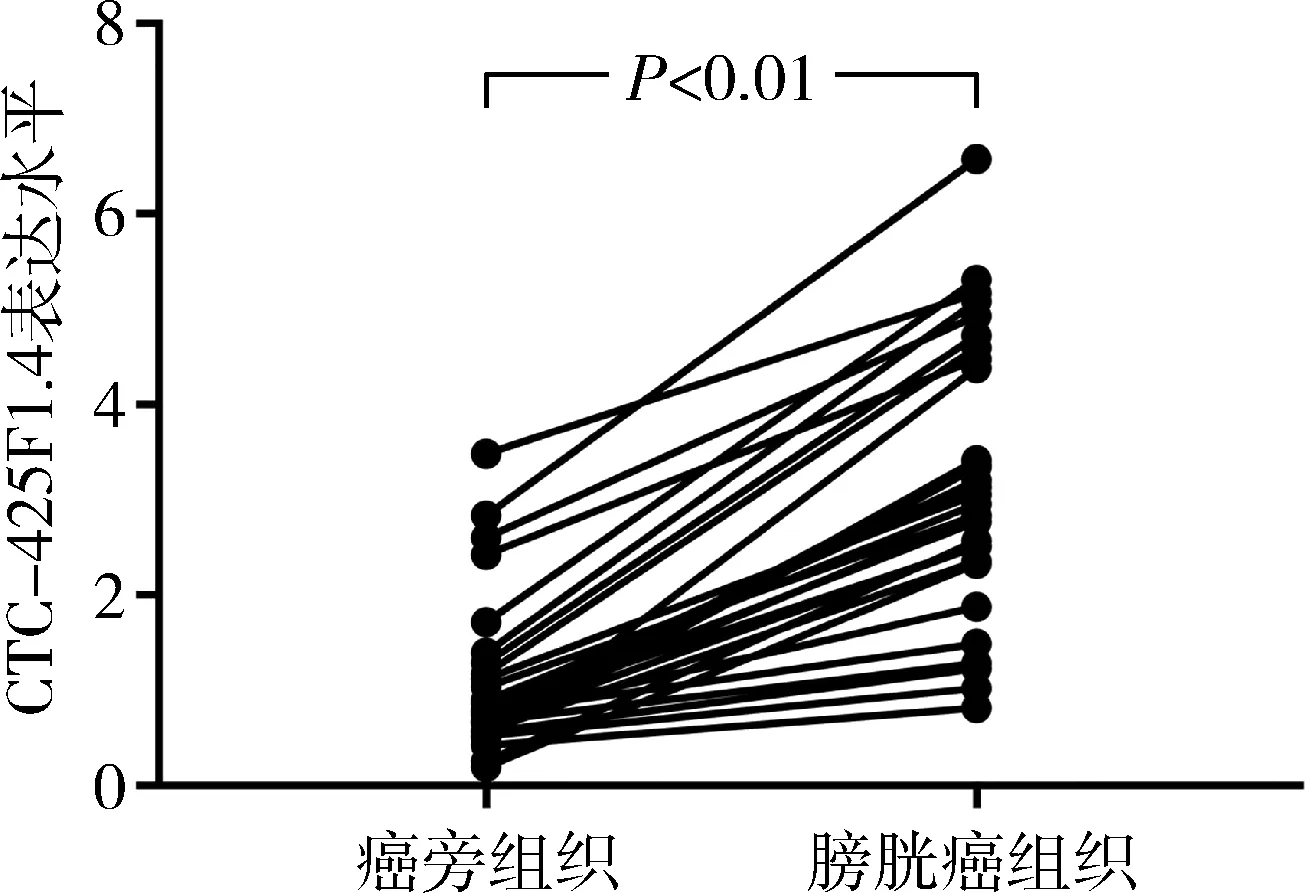
图2 荧光实时定量PCR检测膀胱癌组织和癌旁组织中CTC-425F1.4表达水平
2.CTC-425F1.4在膀胱癌细胞和正常膀胱上皮细胞中的表达:膀胱癌细胞UM-UC-3、T24、RT4、5637和正常膀胱上皮细胞SV-HUC-1中CTC-425F1.4的表达分别为3.63±0.44、5.19±0.67、9.33±1.13、2.51±0.43和1.16±0.16,CTC-425F1.4在膀胱癌细胞株中表达水平显著高于正常膀胱上皮细胞(P<0.05,图3)。选用CTC-425F1.4表达最高的RT4细胞做后续实验。
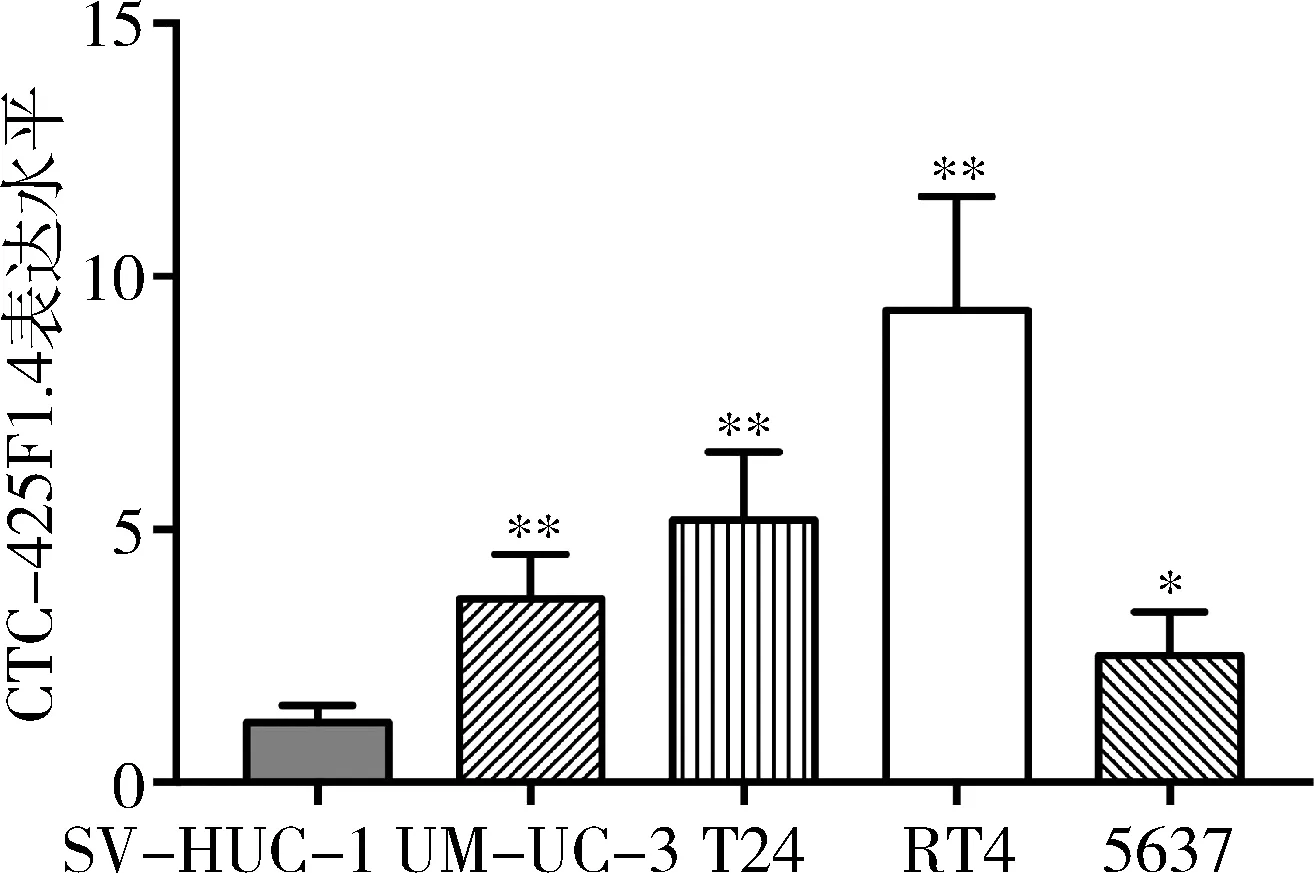
图3 CTC-425F1.4在正常膀胱上皮细胞和膀胱癌细胞中的表达水平与SV-HUC-1细胞比较,*P<0.05,**P<0.01
3.各组RT4细胞中CTC-425F1.4的表达:control组和inhibitor组RT4细胞中CTC-425F1.4表达分别为9.52±2.01和1.09±0.36,与control组比较,转染CTC-425F1.4抑制剂后,inhibitor组CTC-425F1.4表达水平明显降低(P<0.01)。
4.下调CTC-425F1.4对RT4细胞增殖能力的影响:应用CCK-8法连续120h检测各组RT4细胞的增殖,与control组比较,从24h起,inhibitor组细胞增殖能力显著被抑制(P<0.05,图4)。

图4 CCK-8检测各组膀胱癌RT4细胞增殖能力与control组比较,*P<0.05,**P<0.01
5.下调CTC-425F1.4对RT4细胞侵袭能力的影响:inhibitor组和control组RT4细胞穿膜细胞数分别为36.51±5.13个和88.87±11.39个,表明CTC-425F1.4能够抑制RT4细胞的侵袭能力(P<0.01,图5)。
6.CTC-425F1.4靶向结合miR-146a-3p:生物信息学软件发现CTC-425F1.4与miR-146a-3p存在结合位点,详见图6。荧光素酶报告系统鉴定显示,WT+miR-146a-3p组和WT+NC组相对荧光素酶活性分别为6.11±1.46和1.02±0.25,说明CTC-425F1.4靶向结合miR-146a-3p(P<0.01)。
7.下调CTC-425F1.4对RT4细胞中miR-146a-3p表达的影响:inhibitor组和control组RT4细胞miR-146a-3p的表达分别为6.26±1.08和1.03±0.32, 说明下调CTC-425F1.4可促进miR-146a-3p的表达(P<0.01)。
8.下调CTC-425F1.4对p21、Zeb1、Vimentin、Snail蛋白表达的影响:与control组比较,转染CTC-425F1.4抑制剂后,RT4细胞p21蛋白水平明显升高,侵袭相关蛋白Zeb1、Vimentin、Snail水平显著降低(图7)。

图7 Western blot法检测p21、Zeb1、Vimentin、Snail蛋白表达水平
讨 论
长链非编码RNA(long-chain non-coding RNA,lncRNA)是近年来被广泛研究的非编码RNA,数千种lncRNA被发现和鉴定[9, 10]。lncRNA是一种新型的基因调节分子,通过识别微小RNA(miRNA)进而调控miRNA表达,影响细胞的各种生物学行为[11,12]。研究显示,lncRNA与膀胱癌的发生和发展相关,表现类似抑癌基因或癌基因作用[13, 14]。Chen等[15]研究显示,膀胱癌细胞分泌的外泌体含有lncRNA LNMAT2,其不仅在体外刺激人淋巴管内皮细胞管形成和迁移,也可在体内增强肿瘤淋巴管生成和淋巴结转移。Xu等[16]研究显示,lncRNA TINCR在膀胱癌组织和细胞中的表达显著增加,其高表达与膀胱癌患者的肿瘤转移和晚期肿瘤、淋巴结、转移分期以及低生存率有关,lncRNA TINCR表达沉默显著减少膀胱癌细胞的增殖、迁移和侵袭。Shan等[17]研究显示,lncRNA MEG3在膀胱癌细胞中表达降低,恢复其表达通过负调节miR-494,抑制UM-UC-3和SW780的增殖并触发细胞凋亡。目前有关CTC-425F1.4在膀胱癌组织中表达和调节作用机制尚不明确。
本研究显示,CTC-425F1.4在膀胱癌组织和细胞中的表达显著增加,这与GEPIA数据库的研究结果一致,均提示CTC-425F1.4在膀胱癌中表达上调,CTC-425F1.4在膀胱癌中表现类似癌基因的功能。本实验进一步显示,下调CTC-425F1.4后的膀胱癌细胞增殖和侵袭能力降低,同时膀胱癌细胞的侵袭相关蛋白表达降低,提示CTC-425F1.4可能通过参与膀胱癌细胞增殖和侵袭介导膀胱癌的进展。
lncRNA通过靶向结合miRNA,影响靶miRNA表达,调控细胞的生物学功能[18]。本研究通过生物信息学软件LncBase Predicted v.2发现CTC-425F1.4与miR-146a-3p存在结合位点,荧光素酶报告系统鉴定miR-146a-3p受到CTC-425F1.4的靶向结合作用,miR-146a-3p可能是CTC-425F1.4影响膀胱癌进展的重要机制。miR-146a-3p属于miRNA家族成员之一,其在肿瘤发生和发展中表现类似抑癌基因的功能[19]。miR-146a-3p在去势抵抗性前列腺癌组织中低表达,能够显著抑制去势抵抗性前列腺癌的进展[20]。研究显示,miR-146a-3p在膀胱癌组织和细胞株中表达降低,上调miR-146a-3p显著促进抑癌基因p21的表达,miR-146a-3p具有抗细胞生长和转移的作用[19]。本研究显示,下调CTC-425F1.4可以明显上调miR-146a-3p的表达,同时显著上调p21蛋白的表达,提示下调CTC-425F1.4通过靶向调控miR-146a-3p参与膀胱癌的进展过程。
综上所述,CTC-425F1.4在膀胱癌组织中高表达,其在膀胱癌进展中可能发挥癌基因作用,下调CTC-425F1.4明显抑制膀胱癌细胞的增殖和侵袭,其作用机制与靶向调控miR-146a-3p表达相关。CTC-425F1.4可能作为一种癌基因成为膀胱癌治疗的靶点。

