姜黄素对阿尔茨海默病模型大鼠海马区GSK3β蛋白表达的影响
俞柏翎 叶茂盛 潘 锋 周 勇 郦旦明
近年来随着社会的不断发展进步及生活质量的不断提高,老年人口与日俱增,对老年疾病的诊疗成为社会关注的热点话题之一。阿尔茨海默病(Alzheimer′s disease, AD)是以慢性、进行性记忆功能受损、认知功能紊乱及行为改变为特点,占所有痴呆的2/3以上,其发生率逐年上升,严重程度随着年龄增长而加剧,已是老年人最常见的中枢神经系统退行性疾病之一[1]。至今,尚无有效手段能逆转或阻止AD疾病进展,因此寻求能减缓甚至阻断病情发展的药物具有重要意义。
姜黄素是一种多酚类色素,因其具有多种生物活性,能发挥多靶点治疗作用,已被广泛应用于实验研究。近年来研究发现,姜黄素能改善AD模型动物的认知功能,发挥抑制Aβ肽的生成和沉积、清除自由基、减轻神经炎性反应等作用[2]。糖原合成酶激酶3β(glycogen synthase kinase3β,GSK3β)是一种丝氨酸/苏氨酸激酶,通过多种信号转导途径调控Aβ生成、tau蛋白磷酸化及细胞凋亡等参与了AD的病理生理过程。本实验拟比较不同剂量的姜黄素对AD模型大鼠学习记忆及海马区神经细胞的影响,探讨姜黄素对AD模型大鼠海马区GSK3β蛋白表达的影响。
材料与方法
1.实验材料:姜黄素(CAS号:458-37-7,批号:15051512,纯度>98%)购自上海远慕生物工程公司;Aβ1-42Antibody Blocking Peptide(Aβ1-42)(批号:05186048,编号bs-0107p)购自北京博奥森生物技术有限公司,兔抗GSK-3β(货号:12456S)购自美国CST公司,β-actin(货号:4970S)购自美国CST公司,注射用青霉素钠购自哈药集团制药总厂;DAB显色试剂盒、免疫组化试剂盒购自武汉博士德生物工程有限公司;实验所需相关仪器包括图像分析系统、鼠脑立体定位、Morris水迷宫系统等由浙江中医药大学实验室提供。
2.动物选择及分组:清洁级SD雄性大鼠60只,体质量为180~220g,由浙江中医药大学动物实验室提供,动物实验条件合格证:SYXK(浙)2013-0184。本实验由浙江中医药大学医学伦理学委员会审批后进行。经过1周的适应性喂养后,按照数字表法随机分为4组,即假手术组、Aβ模型组、低剂量姜黄素干预组(L-CU组)和高剂量姜黄素干预组(H-CU组)。
3.模型建立及给药:Aβ1-42(浓度为10g/L)溶于无菌PBS(pH=7.4),37℃下储存孵育1周。大鼠经10%水合氯醛(350mg/kg)腹腔注射麻醉后,将大鼠头固定于脑立体定位仪,常规备皮消毒,颅顶部正中切开皮肤,暴露前囟,选择大鼠右侧海马CA1区作为注射靶区,定位点参照《大鼠脑立体定位图谱》,选择前囟后3.0mm,右侧旁开2.2mm[3]。微量注射器对准靶点,缓慢进针,深度为2.5~3.0mm,假手术组注射灭菌生理盐水1μl,模型组和干预组注射Aβ1-42溶液1μl,为使注射液能充分弥散,留针5min后退针,常规消毒缝合切口,术后3天予青霉素肌内注射防止感染。术后正常饲养30天,假手术组、模型组给予0.9%NaCl溶液灌胃,L-CU组给予150mg/kg剂量姜黄素灌胃,H-CU组给予300mg/kg剂量灌胃。
4.Morris水迷宫测试:将大鼠从任意象限放入水迷宫系统,大鼠将在水中寻找水面下的平台,记录大鼠找到平台所需的时间,即逃避潜伏时间,每只大鼠将进行连续6天训练,3次/天,2分/次,如果2min内大鼠未找到平台,则记录其逃避潜伏时间为2min。第7天将平台撤除,将大鼠从任意水点放入水中,观察3min内的游泳轨迹,记录大鼠穿越原平台的次数,考察大鼠的学习记忆力。
5.标本制作及观察指标:Morris水迷宫实验完成后,采取10%水合氯醛腹腔麻醉并处死大鼠,以37℃ 0.9%NaCl溶液快速冲洗,立即投入4%多聚甲醛PBS溶液中灌注30min,剥离出海马组织,经4℃的4%多聚甲醛溶液固定48h,常规脱水处理,石蜡包埋,选取矢状切面切片(厚度4μm)。通过HE染色法观察比较各组大鼠海马CA1区细胞形态学变化;采用两步法进行免疫组化染色,脱蜡脱水,PBS冲洗,一抗为GSK3β(1∶150),DAB显色,苏木精复染。在400倍显微镜下,用图像分析系统采集图像,对海马CA1区GSK3β蛋白表达阳性神经细胞单位面积和平均吸光度值进行分析。
6.采用Western blot法检测GSK3β蛋白表达:提取5只大鼠海马组织,加入裂解液中提取总蛋白,用BCA法测定蛋白浓度。取50μg样本进行SDS-PAGE凝胶电泳分离蛋白,并转移到PVDF膜,用5%脱脂奶粉进行封闭2h,按1∶1000稀释兔抗GSK3β和β-actin,4℃孵育过夜,二抗HRP标记山羊抗兔(1∶2000)孵育2h,上述过程用TBST洗涤3次,DAB显色,以目的条带与β-actin灰度值的比值作为蛋白的相对表达量。
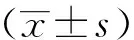
结 果
1.大鼠Morris水迷宫实验结果比较:与假手术组比较,Aβ模型组逃避潜伏时间增加,穿越平台次数减少,差异均有统计学意义(P<0.01)。与Aβ模型组比较,L-CU组和H-CU组逃避潜伏时间均增加,穿越平台次数均减少(P<0.05)。与L-CU组比较,H-CU组穿越平台次数增加,逃避潜伏时间减少(P均<0.05,表1)。

表1 4组大鼠Morris水迷宫实验结果比较
2.大鼠海马HE染色结果比较:假手术组海马区神经细胞层次排列紧密,分布均匀,边界整齐,细胞核圆形,核仁清晰,胞质清亮。Aβ模型组海马神经细胞皱缩,分布散乱,间隙增大,数目明显减少,细胞核固缩并且浓染,核仁消失,胞质中出现明显空泡征。姜黄素干预组神经细胞数目减少,分布散乱,胞质量少而浓染,部分细胞核体积变小,呈椭圆形,核仁消失,详见图1。

图1 4组大鼠海马HE染色结果比较(HE,×200)
3.大鼠海马GSK3β蛋白表达阳性细胞结果比较:Aβ模型组海马区GSK3β蛋白表达阳性细胞量较假手术组明显增加。L-CU组、H-CU组与Aβ模型组比较,GSK3β蛋白阳性细胞表达均减少,且H-CU组更明显,详见图2。

图2 4组大鼠海马GSK3β蛋白表达阳性细胞结果比较(IHC,×400)
4.大鼠GSK3β蛋白表达阳性细胞的阳性单位面积、平均吸光度值结果比较:与假手术组比较,Aβ模型组GSK3β蛋白表达阳性细胞的阳性单位面积、平均吸光度值增加(P<0.01);L-CU组、H-CU组与Aβ模型组比较,GSK3β蛋白表达阳性细胞的阳性单位面积、平均吸光度值减少(P<0.01);与L-CU组比较,H-CU组GSK3β蛋白表达阳性细胞的阳性单位面积、平均吸光度值减少(P<0.01,表2)。

表2 4组大鼠GSK3β蛋白表达阳性细胞的阳性单位面积、平均吸光度值结果比较
5.大鼠Western blot法检测GSK3β蛋白表达结果比较:Aβ模型组与假手术组比较,GSK3β蛋白表达增强;L-CU组、H-CU组与Aβ模型组比较,GSK3β蛋白表达均有减弱,详见图3。
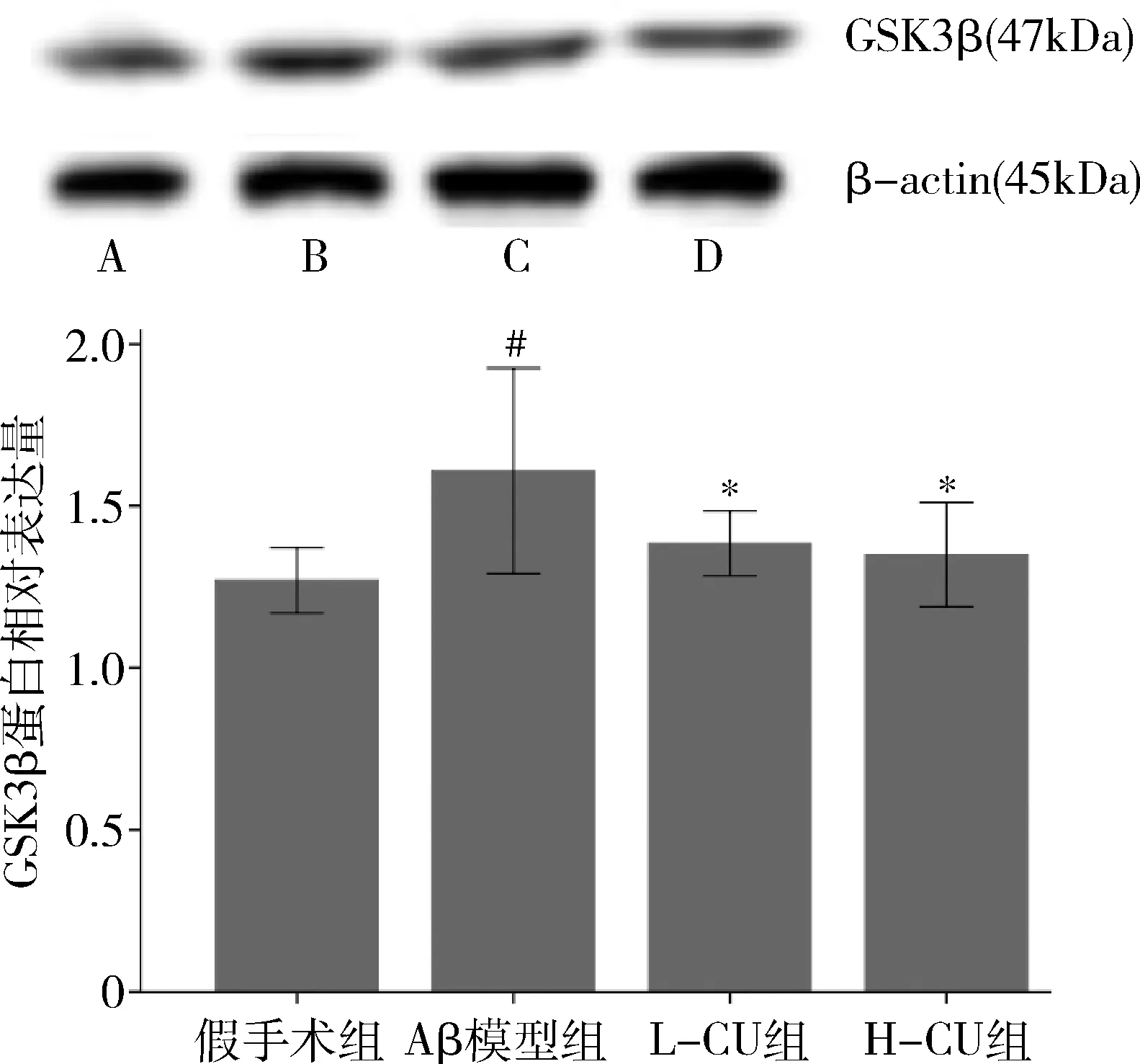
图3 4组大鼠Western blot法检测GSK3β蛋白表达结果比较
讨 论
至今对AD的发病原因及机制均尚未完全阐明,脑大体病理呈现出弥漫性脑萎缩,镜下病理改变包括tau蛋白异常磷酸化形成神经元纤维缠结(NFTs),广泛神经元损伤缺失、Aβ沉积形成老年斑(SPs)、轴突及突触功能障碍。中药单体姜黄素具有抑制炎性细胞因子、抗氧化、抗细胞凋亡等复合特性,因为其药理作用广泛、分子靶点众多、毒性不良反应小、安全性良好,已用于多种疾病的预防与治疗[4]。近期研究发现,姜黄素能改善认知功能,减少细胞凋亡,起到神经保护作用,有望为AD等神经退行性疾病的治疗提供新思路[5~7]。
正常情况下,淀粉样前驱蛋白(amyloid precursor protein,APP)经过β-分泌酶作用,产生C-末端片段(CTF-99),γ-分泌酶裂解该片段,产生β-淀粉样蛋白(amyloid β-protein,Aβ),Aβ可以通过自噬降解、血-脑脊液屏障转运等途径清除,当大量Aβ生成,超过自身清除能力或降解功能受损时,就会导致Aβ聚集,产生细胞毒性作用。研究显示,过量沉积的Aβ会导致线粒体功能障碍,引起突触丢失、神经元紊乱,推动了AD病程发展[8,9]。另一方面,Aβ可以通过多种途径介导神经细胞氧化应激,从而导致细胞损伤、凋亡或坏死[10]。本实验也证明了上述观点,大鼠在注射Aβ溶液后出现空间记忆和学习能力减退。姜黄素干预组与模型组比较,逃避潜伏时间均减少、跨越平台次数均增多,H-CU组要优于L-CU组,且姜黄素的剂量与改善认知、缓解AD发展的作用呈正相关。
海马是大脑中与认知、记忆等功能密切相关的重要区域之一,正常情况下,神经元不断产生替换凋亡或坏死的神经元,而AD患者海马萎缩及海马区神经元细胞生成能力下降,细胞信号传递紊乱,导致认知功能障碍、学习记忆能力下降[11]。本研究中HE染色结果证实,过量Aβ可致神经细胞元数目减少,细胞损伤,而注射不同浓度姜黄素后神经细胞形态较模型组明显改善,提示姜黄素可呈浓度依赖性减轻海马区神经细胞损伤,猜测可能是与姜黄素具有增强SOD活性、抑制炎性细胞因子的作用相关。
研究证实,磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)信号通路能调控信号转导及细胞分化、生长、凋亡等过程[12,13]。糖原合成酶激酶3β(glycogen synthase kinase3β,GSK3β)在海马区高度表达,是PI3K/Akt信号通路的核心部分。Gandy等[14]研究发现,在AD模型小鼠脑组织的NFTs中可以检测出较高表达的GSK3β蛋白。Ly等[15]研究表明,抑制GSK3β蛋白的活性可以降低APP水解途径,减少Aβ的形成,清除异常积聚的Aβ。有研究证实姜黄素同时参与Aβ沉积过程及tau蛋白过度磷酸化,通过抑制GSK3β蛋白活性,可以阻断PI3K/Akt/GSK3信号通路,起到缓解神经细胞损伤,减缓AD发展的作用[16]。因而寻求能有效抑制GSK3β过度表达的药物成为研发AD治疗的新思路,本实验结果显示,模型组大鼠海马区GSK3β高表达,而姜黄素干预后,GSK3β蛋白表达阳性细胞的阳性单位面积减少、平均吸光度值降低,说明姜黄素可能是通过抑制了GSK3β蛋白的表达,从而调节Aβ诱导的细胞损伤的作用,而GSK3β是PI3K/Akt信号转导通路下游的关键蛋白,姜黄素改善认知的作用可能与该信号通路相关。
综上所述,姜黄素可能通过PI3K/Akt/GSK3介导信号转导,减少GSK3β蛋白表达,从而修复AD模型大鼠海马区损伤的神经细胞,具有改善认知功能的作用,并且这种作用与姜黄素浓度相关。

