衰弱及血常规指标对肿瘤病人发生免疫相关不良反应的预测价值研究
岳 岚,李 珍,李锡清,杨长永,许 妍,李蕾蕾,王 梦,李 爽,古钰君
据2019年世界卫生组织(World Health Organization,WHO)统计,癌症是全球第一或第二大死因,给病人带来了巨大的疾病负担[1-2]。目前,随着医疗技术的发展,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)包括程序性细胞死亡蛋白-1和程序性细胞死亡配体1等通过阻断作用诱导T细胞活化,解除T细胞免疫抑制作用,重建机体对肿瘤细胞的监测与攻击,开启了癌症治疗的新纪元[3-4],但同时也引起对自身免疫细胞的攻击,导致免疫相关不良反应(immune-related adverse reactions)的发生,如免疫相关性肺炎、心脏毒性、消化道毒性等严重影响了病人的预后与生存期[5-7]。癌细胞及抗癌治疗增加了肿瘤病人衰弱的发生与发展[8]。衰弱是指由于个体脆性增加,其保持自我内在平衡能力下降,从而引起一系列对不良健康结局易感性的增加[9]。李欢欢等[7]的研究中表明衰弱是老年肿瘤手术、化疗病人的独立死亡因素,可有效预测放化疗毒性,也可增加放化疗不良反应。但目前尚未有研究证明衰弱及血常规指标对肿瘤病人发生免疫相关不良反应的预测价值。本研究通过收集临床使用免疫抑制剂治疗的肺癌病人衰弱和血常规等一般实验室检查结果来预测病人发生免疫相关不良反应的危险,为避免病人发生免疫相关不良反应提供评估参考依据。
1 资料与方法
1.1 研究资料 选取河南省人民医院肿瘤中心接受免疫治疗肺癌病人的病例资料为研究对象。纳入标准:接受免疫治疗;未出现严重的放化疗相关不良反应;体力状况ECOG评分0~1分。排除标准:实验室检查指标不详细;疾病资料不全的病人。
1.2 诊断标准 根据《ESMO免疫治疗的毒性管理指南解读》[10]诊断标准,将病人分为发生免疫相关不良反应组与未发生免疫相关不良反应组。根据FRAIL评估量表,若病人量表得分>3分为发生衰弱组,得分<3分为未发生衰弱组。
1.3 调查内容 人口学变量及临床变量,主要包括性别、年龄、衰弱评分、白细胞计数、血红蛋白、血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)、白细胞与淋巴细胞比值(ALC)等一般实验室检查结果。
2 结果
2.1 两组病人临床资料比较 本研究共纳入152例接受免疫治疗的肿瘤病人,其中男90例,女62例;发生免疫相关不良反应为71例,未发生81例。单因素分析结果显示,衰弱、中性粒细胞计数、嗜碱性粒细胞计数、C反应蛋白、NLR、PLR是影响肿瘤病人免疫相关不良反应发生的相关因素(P<0.05)。见表1。

表1 两组病人临床资料比较
2.2 肿瘤病人发生免疫相关不良反应影响因素的Logistic回归分析 以肿瘤病人是否发生免疫相关不良反应为因变量,以单因素分析中有统计学意义的项目为自变量进行二元Logistic回归分析。结果显示,衰弱、PLR、NLR为肿瘤病人发生免疫相关不良反应的独立危险因素(P<0.05)。见表2。
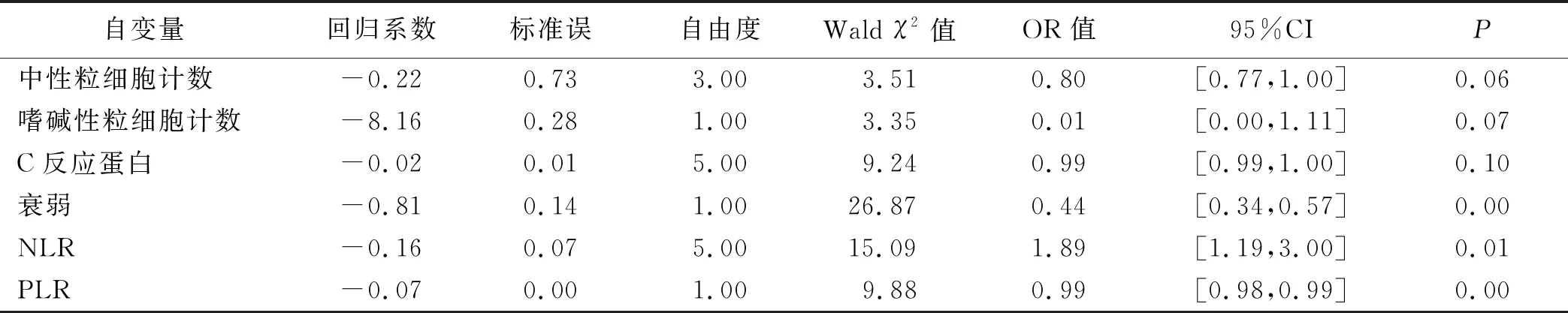
表2 肿瘤病人发生免疫相关不良反应影响因素的Logistic回归分析
2.3 ROC曲线分析 肿瘤病人衰弱评分、PLR、NLR可有效预测肿瘤病人免疫相关不良反应的发生。其最佳临界值、特异性及敏感性见表3,AUC曲线下面积可见图1。
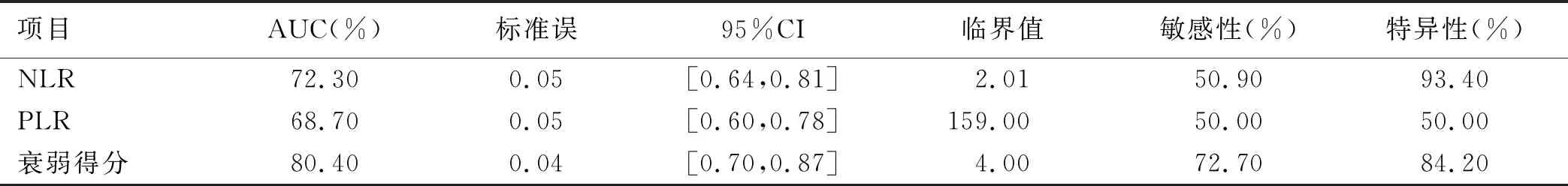
表3 ROC曲线分析表
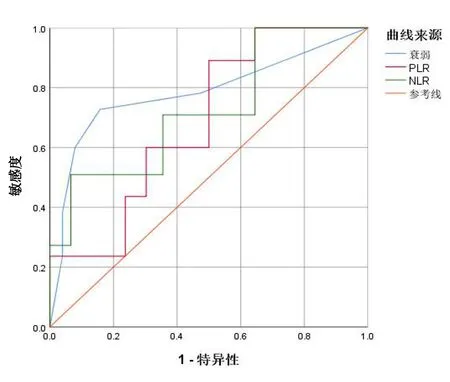
图1 NLR、PLR及衰弱预测免疫相关不良反应的ROC曲线
3 讨论
衰弱是反映肿瘤病人免疫相关不良反应发生的重要预测指标。衰弱是由于病人免疫能力下降而导致机体抗应激能力减退,可引起神经肌肉、代谢、免疫等多系统的病理生理改变[11]。既往有研究表明,肿瘤病人在化疗及放疗过程中由于疾病本身的消耗,可致使机体免疫力下降,从而引起衰弱的发生,严重增加了治疗的不良反应,导致负性事件的发生[12-13]。本研究表明,衰弱涉及多个生理系统的机能调节及稳态储备的衰减,可导致疾病的易感性与负性事件的发生,是肿瘤病人发生免疫相关不良反应的重要指标[14]。肿瘤免疫疗法是利用病人自身免疫系统来识别杀伤肿瘤细胞的治疗方法,免疫检查点抑制剂可解除T细胞免疫抑制作用,重建机体对肿瘤的敏感性与攻击性。其不良反应最常见于皮肤、胃肠道、肺部及骨骼肌系统,通常发生于治疗过程中或停药之后。免疫相关不良反应不同于常规的细胞毒药或分子靶向治疗引起的不良反应[15-16]。它是由于正常细胞中细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)的表达和自身抗体类风湿因子、抗核抗体和抗甲状腺激素失衡引起调节性T细胞的失衡或自身反应性T细胞的激活引起的。刘长虎等[11]的研究表明,免疫活性数目的减少与衰弱的发生有着密切的关系,但其具体作用机制仍需进一步研究[6,15]。本研究通过回顾性分析发现,衰弱是肿瘤病人发生免疫相关不良反应事件预测的重要指标,其最佳临界值为4分,预测免疫相关不良反应的敏感性为72.70%,特异性为84.20%。这与Vetrano等[17]的研究结果相一致,该研究表明衰弱在免疫应答中有着负性作用,衰弱可引起严重的免疫功能减退,增加药物不良事件发生的概率。但目前缺乏相应的生物分子机制来评估两者之间的关系。
此外,本研究还发现NLR、PLR同样是肿瘤病人发生免疫相关不良反应的重要预测指标。Egami等[18]的研究表明,免疫相关不良反应的发生与预处理后的外周血生物标志物有密切关系,但其关系尚不明确。Nakaya等[19]的研究表明,因为免疫检查点抑制剂通过阻断T细胞功能的负调控因子来增强抗肿瘤免疫,且循环淋巴细胞相对比例的改变可能会影响免疫检查点抑制剂的疗效。中性粒细胞可以产生各种趋化因子和细胞因子,抑制淋巴细胞和自然杀伤细胞的免疫活性,促进恶性进展。因此,中性粒细胞与淋巴细胞比值NLR可作为nivolumab治疗的晚期非小细胞肺癌病人预后的早期标志。同样Bagley等[20]的研究表明,炎症指标可作为非小细胞肺癌病人接受免疫治疗后病人生存及应答的预测指标,癌症相关的炎症不仅是肿瘤进展的关键因素而且是免疫治疗效果的关键决定因素。本研究结果表明,PLR预测病人发生免疫相关不良反应的临界值为159,其敏感性和特异性分别为50.00%和50.00%;NLR预测病人发生免疫相关不良反应的临界值为2.01,其敏感性和特异性分别为50.90%和93.40%。NLR作为反映肿瘤免疫反应的指标,在各种癌症中起着关键作用。然而,解释高NLR癌症病人存活率低的确切机制仍不清楚[21],未来可进一步进行探讨研究。
本研究的不足之处在于本研究为单中心回顾性研究,因此样本量较少,且资料的准确性与可靠性取决于既往病历资料是否规范、准确书写。此外,本研究仅研究了肿瘤病人发生免疫相关不良反应的预测因素,未比较病人发生免疫相关不良反应与预测因素之间的时间效应联系,在接下来的研究中将进一步探讨两者之间的关系,为临床免疫用药风险评估提供可靠依据。

