5种多酚类化合物提高紫甘蓝花色苷热稳定性及辅色机理初探
孙晨晨,高庆超,李亚辉,张志勇,王树林,梁颖*
(1.青海大学农牧学院,青海西宁 810016)
(2.江苏省食品质量安全重点实验室,江苏省农业科学院农产品质量安全与营养研究所,江苏南京 210014)
紫甘蓝(Brassica oleraceaL.)在我国种植范围广、产量大,深受消费者欢迎。紫甘蓝中含有大量花色苷(Anthocyanin)[1],花色苷是以花青素通过糖苷键与糖基结合形成的一种多酚类化合物[2]。花色苷含有多个酚羟基结构,具有良好的抗氧化活性[3],如清除体内自由基、抑制脂质过氧化[4],同时具有预防肿瘤[5]、抗炎杀菌[6,7]、调节血糖[8]、保护心脑血管[9,10]等生理活性功能,被用于食品、制药、化妆品等多个领域[11,12]。由于花色苷结构中的酚羟基十分活泼,导致其稳定性差,在加工、贮藏过程中容易受温度、pH、氧气、酶、金属离子、抗坏血酸、二氧化硫、糖及其降解产物等的影响[13,14],降解并形成无色或棕色化合物,进而限制了其在各个领域的广泛应用。因此,如何提升花色苷稳定性受到广泛关注。
提高花色苷稳定性的研究主要集中在化学结构修饰[2,15]、微胶囊技术[16]和分子辅色[17]方面。其中,添加多酚类化合物作为辅色剂来提高花色苷稳定性的同时,还可以发挥多酚类化合物天然抗氧化剂作用,对人体健康具有多种益处。已有较多研究报道了多酚类化合物在各种果汁和果酒花色苷辅色中的应用[18,19],但围绕蔬菜尤其是紫甘蓝花色苷辅色作用的研究极少。
紫甘蓝花色苷含量丰富、来源广、成本低,本文以紫甘蓝花色苷为原料,选取已有报道可能在花色苷辅色中有较好效果的多酚化合物,包括儿茶素、没食子酸、香兰素、山奈酚、槲皮素为辅色剂,研究其对紫甘蓝花色苷的辅色作用及热稳定性的影响,并通过热力学参数对其辅色机理进行初步研究,以期为实际应用中紫甘蓝花色苷稳定性提升提供参考依据。
1 材料与方法
1.1 材料与试剂
紫甘蓝,购于江苏南京苏果超市,新鲜、清洁、无损伤。AB-8大孔树脂,北京康林科技有限责任公司;儿茶素、没食子酸、香兰素、山奈酚、槲皮素,成都曼斯特生物科技有限公司;柠檬酸、NaH2PO4、乙醇(AR)、盐酸,上海凌峰化学试剂有限公司。
1.2 仪器与设备
GO酶标仪,赛默飞世尔科技公司;UV-2450紫外分光光度计,日本岛津公司;RV10旋转蒸发器,广州仪科实验室技术有限公司;HHSY21-Ni4恒温水浴锅,北京市精科华瑞仪器有限公司;LABCONCO真空冷冻干燥机,美国Labconco公司;JYL-C051粉碎机,九阳股份有限公司;超声波清洗仪,北京中晟铭科技有限公司。
1.3 实验方法
1.3.1 紫甘蓝花色苷提取及纯化
紫甘蓝花色苷的提取方法参考潘颖等[20]并优化。紫甘蓝切块后放入破碎机,加干冰后匀浆,按照料液比1:20加60%的酸化乙醇(0.1% HCl,pH 2.0),在功率500 W、40 ℃下超声提取40 min,抽滤得到紫甘蓝花色苷粗提液。花色苷粗提液在 40 ℃下旋转蒸发除去乙醇,使用大孔树脂进行纯化[21],纯化后的紫甘蓝花色苷提取液经 40 ℃旋转蒸发除去乙醇,-80 ℃冰箱中预冻24 h后,使用冷冻干燥机冷冻干燥,得到紫甘蓝花色苷粉末。
1.3.2 紫甘蓝花色苷总含量测定
采用pH示差法[22]测定紫甘蓝花色苷的总含量,取一定量的待测样,分别用pH 1.0和pH 4.5的缓冲液将样品配置成0.1 mg/mL的溶液,平衡10 min后,以纯水为空白,分别测定样液在最大吸收波长 530 nm处和无吸收波长700 nm下的吸光值,按照(1)方程计算花色苷总含量。
式中:
M——紫甘蓝花色苷的含量,%;
MW——矢车菊素-3-O-葡萄糖苷的分子量,449.2 g/mol;
L——光程长,1 cm;
ε——矢车菊素-3-O-葡萄糖苷的摩尔消光系数,26900 L/(mol·cm);
c——紫甘蓝花色苷的浓度,mg/mL。
1.3.3 多酚化合物对紫甘蓝花色苷辅色作用
1.3.3.1 辅色剂浓度对紫甘蓝花色苷辅色效果的影响
根据方程(1),纯化后的紫甘蓝花色苷中花色苷的含量为 11.77%。使用 0.1 mol/L柠檬酸缓冲液(pH=3.0)分别配制1 mg/mL的紫甘蓝花色苷溶液和0.025 mol/L的辅色剂溶液(香兰素、没食子酸、儿茶素)。由于槲皮素和山奈酚不溶于水,溶于酒精,故使用无水乙醇配制成0.025 mol/L的溶液。取1.0 mL紫甘蓝花色苷溶液于试管中,分别添加一定量的辅色剂溶液,添加不同pH的柠檬酸缓冲溶液调节溶液的pH为3.0并定容至10 mL,使紫甘蓝花色苷的浓度为0.1 mg/mL,辅色剂浓度分别为0.001、0.002、0.004、0.008、0.01 mol/L,以添加等体积柠檬酸缓冲液为对照,并将溶液pH调整至一致。混匀后的溶液放置在室温下避光平衡2.5 h,随后使用酶标仪测定其在400~800 nm范围内的可见光吸收光谱,分析添加不同浓度的辅色剂后样品的最大吸收波长变化和在最大吸收波长处的吸光值,并计算增色效应和红移效应值。
1.3.3.2 辅色剂种类对紫甘蓝花色苷辅色效果的影响
取 1.0 mL的紫甘蓝花色苷溶液于试管中,按照1.3.3.1的结果分别添加不同浓度的儿茶素、没食子酸、香兰素溶液、山奈酚、槲皮素溶液,添加不同pH的柠檬酸缓冲溶液调节溶液的 pH为 3.0并定容至 10 mL,以添加等体积柠檬酸缓冲液为对照,并将溶液pH调整至一致。溶液混匀后放置在室温下避光平衡2.5 h,使用酶标仪测定其在400~800 nm范围内可见光吸收光谱,分析添加不同辅色剂对紫甘蓝花色苷的辅色效果。
1.3.3.3 不同辅色剂对紫甘蓝花色苷热稳定性的影响
选取 70 ℃、80 ℃、90 ℃不同温度研究花色苷的热稳定性[23,24]。取1.0 mL的紫甘蓝花色苷溶液,按照1.3.3.1的结果分别添加不同浓度的儿茶素、没食子酸、香兰素溶液、山奈酚、槲皮素溶液,添加不同pH的柠檬酸缓冲溶液调节溶液的pH为3.0并定容至10 mL,以添加等体积柠檬酸缓冲液为对照,并将溶液pH调整至一致。溶液混匀后室温避光平衡2.5 h后,分别放置在不同温度的水浴锅中,每隔1 h取出,紫外分光光度计测定其在最大吸收波长处的吸光值,测5 h,分析不同温度下不同辅色剂对紫甘蓝花色苷热稳定性的影响。
1.3.4 多酚化合物对紫甘蓝花色苷辅色作用机理
辅色作用热力学数据参考 Malaj等[25]的方法计算,并稍作修改。
平衡常数(K)、吉布斯自由能(ΔG)、焓变(Δ H)、和熵变(ΔS)通过以下公式计算:
式中:
A0——辅色前溶液在530 nm处的吸光值;
A——辅色后溶液在530 nm处的吸光值;
K——辅色反应的平衡常数;
n——辅色剂与花色苷的化学计量比;
cp——溶液中辅色剂的浓度;
R——气体常数(8.314 J/mol K);
T——开尔文温度。
1.3.5 统计分析
每个样品设置三个平行,采用Excel和SPSS软件进行比较分析,测定结果以平均值±标准偏差表示,实验数据采用ANOVA进行邓肯式(Duncan’s)差异分析,以p<0.05为差异显著。
2 结果与分析
2.1 辅色剂浓度对紫甘蓝花色苷辅色效果的影响
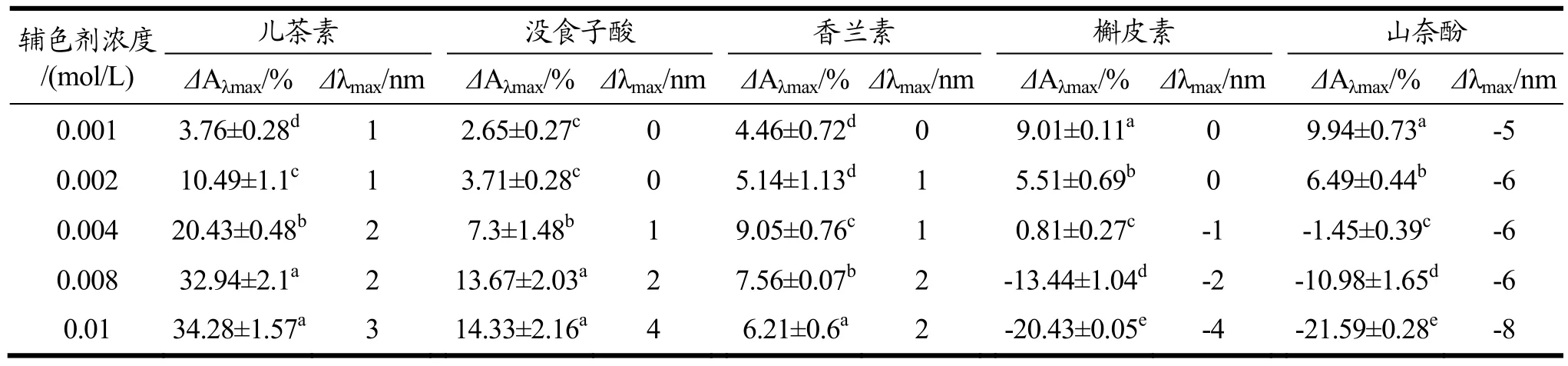
表1 不同辅色剂对紫甘蓝花色苷溶液的增色效应和红移效果Table 1 The hyperchromic effect and bathochromic shift of different copigments on purple cabbage anthocyanin
辅色剂对花色苷的辅色作用体现在增色效果和红移效果两个方面,增色效应即花色苷溶液紫外最大吸收波长下的吸光值变化百分比(%),红移效应即花色苷溶液紫外最大吸收波长增加量(nm)。当花色苷溶液发生红移现象时,其紫外最大吸收波长变大,花色苷溶液红色加深;与之相对的,当发生蓝移现象时,其紫外最大吸收波长减小,花色苷溶液红色变浅或有变蓝的趋势。增色效应和红移效应的值越大,说明辅色剂对紫甘蓝花色苷的辅色效果越好[26]。选用五种辅色剂对紫甘蓝花色苷进行辅色,当辅色剂浓度分别为0.001、0.002、0.004、0.008、0.01 mol/L时,紫甘蓝花色苷溶液的增色效应和红移效果如表1所示。
由表1可知,在一定浓度范围内,五种辅色剂均对紫甘蓝花色苷溶液有增色效应,推断多酚化合物与紫甘蓝花色苷之间发生了分子间辅色,两者以非共价键结合,形成水平或垂直重叠的复合物,使紫甘蓝花色苷的呈色作用加强[27]。其中儿茶素和没食子酸随浓度从0.001 mol/L升高至0.01 mol/L,辅色作用不断加强,当辅色剂浓度达到0.008 mol/L时,增色效应提升变慢;香兰素的浓度在0.004 mol/L时,增色效果最好,当浓度再次提高时,增色效应反而减弱;槲皮素和山奈酚在0.001 mol/L时,增色效应较强,随浓度提升,增色效应不断减弱,且其自身溶液呈黄色,导致花色苷降解失去其本身的颜色和特征。儿茶素、没食子酸和香兰素均对紫甘蓝花色苷产生了红移效果,且随辅色剂浓度的提高,红移效果不断加强,推断“花色苷-辅色剂”分子间形成了上下叠加的π-π共轭现象,产生了氢键作用使花色苷极性或电子分布下降,使其在可见光范围内的最大吸收波长红移。而槲皮素和山奈酚却呈现出了蓝移效果,表明槲皮素和山奈酚对紫甘蓝花色苷的辅色作用较差,且会促进紫甘蓝花色苷的降解,使其失去原有的特征。Xu等[28]研究发现槲皮素和山奈酚是葡萄皮花色苷的有效辅色剂,但本实验中发现槲皮素对紫甘蓝花色苷的辅色效果较差,这可能是由于葡萄皮中花色苷主要成分为锦葵素-3-O-葡萄糖苷(45.4%)和飞燕草素-3-O-葡萄糖苷(16.1%)[29],而紫甘蓝花色苷主要成分为矢车菊素-3-O-葡萄糖苷[30,31],主要花色苷种类不同、结构不同导致其辅色效果产生差别。
因此,结合不同浓度辅色剂对紫甘蓝花色苷辅色效果的影响和实际生产中的添加量,在后续的实验操作中,儿茶素和没食子酸的添加浓度选择 0.008 mol/L,香兰素的添加浓度选择0.004 mol/L,而槲皮素和山奈酚则选择0.001 mol/L。
2.2 辅色剂种类对紫甘蓝花色苷辅色效果的影响
根据2.1的结果,在花色苷溶液中添加相应浓度的辅色剂,添加不同辅色剂后的紫甘蓝花色苷溶液的吸收光谱如图1所示。
由图1可知,五种多酚化合物均提高了紫甘蓝花色苷的最大吸光度(Aλmax),其中,儿茶素对紫甘蓝花色苷的最大吸光度值影响最大,由对照组的0.38升高到了0.50,提高了31.58%,其次是没食子酸,升高至0.44,提高了15.79%,对吸光度值影响最小的是槲皮素,仅升高至0.40,仅提高了5.26%。因此,本实验选取的五种多酚类化合物中,对紫甘蓝花色苷辅色效果最好的辅色剂为儿茶素,其次是没食子酸。
2.3 不同辅色剂对紫甘蓝花色苷热稳定性的影响
根据2.1的结果,在花色苷溶液中添加相应浓度的辅色剂,混匀室温避光平衡2.5 h后,在70 ℃、80 ℃、90 ℃三个温度下加热5 h,加热过程中最大吸光值的变化如图2所示。
从图2中可以看出,在不同温度下加热均会使溶液的吸光值下降,其中,90 ℃时紫甘蓝花色苷溶液的吸光值下降速度最快,70 ℃时下降缓慢,说明紫甘蓝花色苷随温度升高稳定性变差。与对照组相比,三个温度下添加五种辅色剂的溶液在加热5 h过程中,吸光值均高于未添加辅色剂的溶液,说明添加辅色剂对花色苷溶液的增色效果明显。所有溶液在加热的第一小时内,花色苷溶液的吸光值下降速度较快,随后下降速度变缓。对比不同加热温度发现,在加热5 h内,儿茶素辅色后的花色苷溶液的吸光值一直最高,其次是没食子酸,最低的是山奈酚;90 ℃加热5 h发现,儿茶素、没食子酸和香兰素辅色的花色苷的吸光值变化率分别为 22.88%、29.22%、23.36%,均显著低于对照组花色苷溶液的吸光值下降率(34.02%)(p<0.05),而槲皮素和山奈酚辅色的花色苷溶液下降率分别为31.14%和32.81%,对花色苷的热稳定性的影响并不显著(p>0.05),说明儿茶素、没食子酸和香兰素作为辅色剂可以提高紫甘蓝花色苷的热稳定性,延缓花色苷在加热时的降解,而槲皮素和山奈酚虽然对花色苷起到了一定的增色效应,但对其热稳定性的影响并不显著(p>0.05)。Chung等[32]研究香兰素、没食子酸表没食子儿茶素、原儿茶醛和儿茶素抑制模型饮料花色苷褪色的潜力时发现,添加以上多酚类化合物对紫胡萝卜花色苷均有辅色效果,且显著延缓了加热时和储藏过程中花色苷溶液的褪色。因此,根据辅色效果和热稳定性结果,后续选择儿茶素、没食子酸和香兰素进行后续辅色机理的研究。
2.4 热力学数据分析
热力学研究的目的是判定辅色反应发生的可能性或反应是否能够自发进行。通过计算平衡常数K、吉布斯自由能ΔG、焓变值ΔH、熵变值ΔS来预测花色苷与辅色剂之间反应、结合等能量交换过程,进而了解辅色反应的机制。根据ln[(A-A0)/A0]与ln[cp]进行直线拟合的截距求出K值ln[(A-A0)/A0]与温度的倒数(1/T)进行拟合的斜率求出焓变值ΔH,再通过公式进一步计算得出吉布斯自由能ΔG、熵变值ΔS。结果如表2所示。
辅色作用中花色苷与辅色剂间关联的强度由平衡常数K值反映[33],如表所示,不同的辅色反应体系K值不同,儿茶素辅色组的K值最大,香兰素辅色组的K值最小,表明儿茶素与紫甘蓝花色苷之间的关联最强,更容易与紫甘蓝花色苷结合发生辅色反应,香兰素最弱,这与辅色效果的结论一致。不同辅色剂产生了不同的辅色效果的原因可能是辅色剂结构的不同。吉布斯自由能ΔG被看作影响反应过程的热力学势能,ΔG小于0,表明辅色反应的过程是自发进行的[34]。焓变值ΔH取决于反应环境的温度,三种辅色剂与紫甘蓝花色苷的辅色反应体系ΔH均小于0,说明辅色剂与花色苷的相互作用的过程均是放热的,这一结果进一步解释了为什么在较低温度下有利于辅色反应的进行。熵变值ΔS小于0,表示反应体系的均匀度降低[35],生成了更加稳定和有序的结构[34],体系稳定性得到加强,这与2.3中热稳定性的结果一致。如表2所示,ΔS与ΔH变化一致,说明辅色剂与紫甘蓝花色苷的结合越紧密,自由度的损失就越多[36],体系稳定性越高。在类似的研究中,阿魏酸对红莓果实中花色苷的辅色、单宁酸和绿原酸对杨梅花色苷的辅色作用中也得到了相似的结论[37,38]。

表2 反应平衡常数及热力学参数Table 2 The equilibrium constant and thermodynamic parameters of reaction
3 结论
本研究选用五种多酚化合物包括儿茶素、没食子酸、香兰素、槲皮素、山奈酚,通过辅色效果及热稳定性影响评价其对紫甘蓝花色苷稳定性的作用。结果表明,五种多酚化合物对紫甘蓝花色苷均具有辅色作用,儿茶素和没食子酸在0.001 mol/L~ 0.01 mol/L范围内,随辅色剂浓度的提高,辅色效果不断加强,香兰素浓度为0.004 mol/L时辅色效果最佳,随浓度提升,辅色效果降低;五种多酚类辅色剂中儿茶素辅色效果最好,增色效果达到了31.58%,其次是没食子酸,为 15.79%,槲皮素和山奈酚对紫甘蓝的辅色效果较差;随槲皮素和山奈酚的添加浓度上升会使紫甘蓝花色苷产生蓝移效果,促进紫甘蓝花色苷溶液的降解,使其失去原有的特征。在70 ℃、80 ℃、90 ℃下加热紫甘蓝花色苷溶液发现随温度升高,花色苷的降解速率不断加快,加入辅色剂后提升了花色苷溶液的稳定性,其中,没食子酸对于紫甘蓝花色苷的热稳定性效果最好,将花色苷的降解率从34.02%降低至22.88%。热力学研究结果表明,三种辅色剂作用的吉布斯自由能ΔG值均小于0,表明辅色作用为自发进行的反应;而焓变值ΔH为负值,表明辅色作用是放热的过程;熵变值ΔS小于0,表示反应体系的均匀度降低,增强了体系的稳定性。其中,儿茶素与紫甘蓝花色苷辅色反应的平衡常数K值最大,说明儿茶素与紫甘蓝花色苷的辅色反应更容易进行。关于多酚类化合物对花色苷分子结构与辅色效果的关系及辅色机理还有待进一步深入探究。通过本研究发现儿茶素、没食子酸和香兰素均可以作为紫甘蓝花色苷的辅色剂,在实际生产中提高紫甘蓝花色苷的稳定性,其中儿茶素辅色效果最佳。儿茶素作为茶多酚中重要的多酚类化合物,在茶类饮料中含量丰富,且安全性高于化学合成的辅色剂,且具有多种生物活性,作为紫甘蓝花色苷的辅色剂具有十分广阔的发展前景。

