超声影像组学在三阴性乳腺癌与纤维腺瘤鉴别诊断中的研究应用*
(皖南医学院第一附属医院,安徽 芜湖 241000)
三阴性乳腺癌 (triple negative breast cancer,TNBC) 是一种独特的乳腺癌亚型,不表达雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子-2 (HER-2)。TNBC占整个乳腺癌的10%~27%,复发率最高,肿瘤迅速增殖,疗效最差[1]。因此,早期准确诊断尤为重要。众所周知,乳腺癌的恶性超声(US)特征包括形状不规则、边界不清、方向不平行、后声衰减、微钙化等。然而,TNBC往往呈椭圆形或圆形、边缘有界等良性包块外观表现,因此很难与纤维腺瘤相鉴别,从而降低超声的诊断性能,并延误正确的治疗[2]。超声组学是指计算机辅助诊断(CAD)系统对二维超声图像进行高通量特征行提取,然后进行特征筛选,建立模型,旨在探究该模型鉴别TNBC和纤维腺瘤的诊断效能[3]。
1 对象与方法
1.1研究对象 回顾性收集2019年1月—2021年8月于我院接受乳腺肿瘤切除术并获得病理结果的患者。纳入标准:①术后经病理证实为TNBC或纤维腺瘤;②术前于我院进行常规超声检查;③既往无穿刺活检及手术治疗史 。排除标准:①曾于术前放化疗的患者;②直径>5 cm的肿瘤,因为这些肿瘤可能没有包括在一个平面上,这使得很难定义感兴趣区(ROI)。 最终纳入78例患者,其中27例TNBC患者和51例纤维腺瘤患者[年龄26~78岁,平均(49.25±11.73)岁]。
1.2仪器与图像采集 选用Philips EPIQ5 超声仪,线阵探头频率为7~14 MHz。患者仰卧位,探头多角度扫查病灶,术前采集肿瘤最大直径图像并存储为DICOM格式。
1.3超声组学特征提取及模型构建 将DICOM图片导入至3D Slicer软件进行ROI的勾画,见图1。然后使用3D Slicer软件拓展的pyradiomics平台从超声图像中提取ROI的影像特征。特征提取出来后,随机抽取10例,由两名医师对同一图像进行2次ROI勾画来评估观察者之间的一致性。将TNBC与乳腺纤维腺瘤例数按7∶3的比例随机分配为训练集及验证集。选取55例作为训练数据集(19/36=阳性/阴性),另外23例作为独立验证数据集(8/15=阳性/阴性)。采用Lasso回归进行特征降维。然后通过Logistic回归构建模型,采用受试者工作特性曲线(ROC)来评估超声组学模型的鉴别效能。

图1 TNBC患者肿块ROI示意图
2 结果
2.1临床参数 本次研究对象训练集和验证集的基本临床信息,见表1。TNBC和乳腺纤维腺瘤患者在训练集和验证集的年龄、肿块最大直径比较,差异无统计学意义(P>0.05)。

表1 训练集和验证集临床资料比较
2.2观察者一致性评估 利用3D Slicer软件拓展的pyradiomics平台从超声图像感兴趣区提取的超声组学特征,进行观察者一致性评估。结果显示观察者间提取影像组学特征一致性检验的ICC>0.75,表明观察者间一致性良好。两名经验丰富的超声医生对随机选取的10个病灶进行特征提取的观察者间重复性较高。因此,所有的结果都是基于第一个超声科医生的测量结果。
2.3超声组学模型构建及验证 通过Lasso回归进行特征降维,以选择信息最丰富的特征。首先,采用10次交叉验证,得到λ最优参数。其次,利用基于最优参数λ的Lasso方法计算各特征的系数,选取系数非零的特征。最终从685个特征中筛选出5个非零系数超声组学特征,然后进行Logistic回归构建模型,即最终得到一个基于超声组学特征的超声组学评分公式用于鉴别TNBC和乳腺纤维腺瘤,见表2。超声组学评分是由每个系数加权的选定特征的线性组合计算出来。

表2 超声组学评分中特征及其系数
采用ROC曲线分析评价模型的性能。下面的区域计算ROC曲线(AUC)进行量化。利用ROC曲线分析该模型在鉴别TNBC和乳腺纤维腺瘤的诊断效能,训练集的AUC为0.958,灵敏度为100%,特异度为83.30%;验证集的AUC为0.958,灵敏度为100%,特异度为80.00%,见图2。
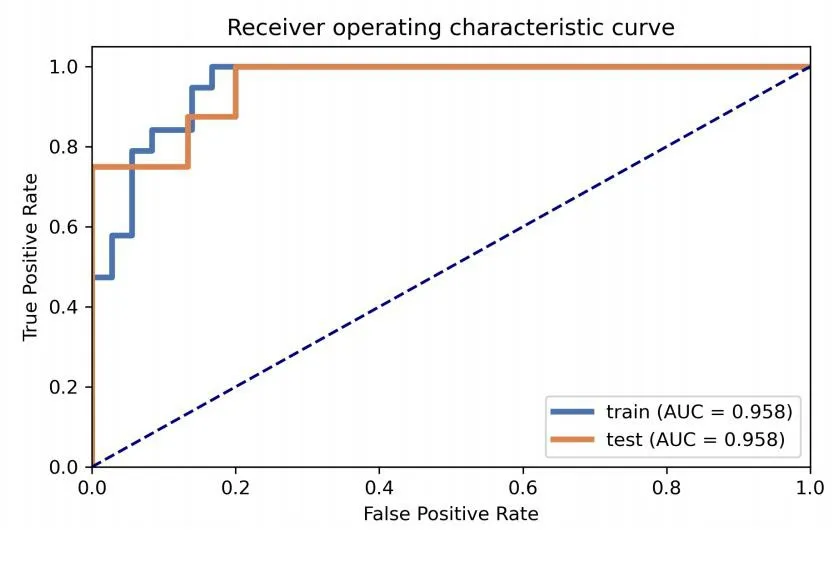
图2 Logistic回归模型中鉴别TNBC与乳腺纤维腺瘤的ROC曲线
3 讨论
复杂和异质性的TNBC可以根据基因表达分为不同的亚型,这些亚型与不同的治疗相关。TNBC早期具有较高的远处转移风险,易侵袭肺、肝和脑等重要器官,预后极差,需要早期诊断[4-5]。但TNBC具有明显良性征象[6],且检查结果易受医生的主观性影响,在临床工作中难与良性肿瘤纤维腺瘤相鉴别。因此,快速准确的诊断十分重要。本课题组试图通过一种更简单的方法在大量病变中准确鉴别TNBC与纤维腺瘤,影像组学是利用人工智能技术从放射影像中挖掘高通量特征,可以提高影像辅助临床诊断的效果。本研究利用影像组学方法对二维超声图像进行特征提取,建立模型,研究该模型对TNBC与纤维腺瘤的鉴别诊断效能。研究结果表明,基于超声图像的组学特征能够有效区分TNBC与纤维腺瘤,关键步骤包括特征提取、特征选择和模型构建。在特征提取过程中,采用影像组学方法从原始二维图像中提取了685个特征。在特征筛选过程中,本研究采用Lasso回归进行特征降维,采用10次交叉验证,最终筛选出5个非零系数超声组学特征,分别为original.9、original.66、original.68、original.69、wavelet-LHL.65。最后建立了鉴别TNBC和乳腺纤维腺瘤的模型,并对其进行验证。结果显示训练集与验证集AUC值均为0.958。
以前研究大多采用CT、钼靶、磁共振等利用影像组学对乳腺进行研究。周晶等[7]利用多参数MRI影像组学特征术前预测TNBC与非TNBC,AUC值在训练集和验证集中分别为0.91、0.84;Xie TW等[8]研究多模态MRI的直方图特征可用于鉴别诊断TNBC与其他分子分型乳腺癌,具有良好的诊断价值,AUC值为0.76。Feng QL等[9]研究基于术前增强胸部计算机断层扫描提取的放射组学特征诊断TNBC,验证集的AUC为0.881。这些研究表明影像组学模型在诊断TNBC表现出具有较好的诊断效能。虽然已有多项研究报道了影像组学对TNBC的鉴别诊断,但这些检查往往价格昂贵且有创,诊断效能较低,且临床应用较少。超声检查广泛应用于乳腺疾病的筛查,在影像学检查中检出率较高。近年来超声影像组学研究取得了迅速发展,主要集中于乳腺、甲状腺和肝脏等器官领域[10-12]。但关于超声组学对乳腺疾病的研究较影像少,且还没有强有力的证据表明基于超声图像的影像组学可以有效地鉴别TNBC。本研究旨在利用超声影像组学筛选出有效特征,更好地鉴别TNBC与乳腺纤维腺瘤。 研究结果表明超声组学对于TNBC和乳腺纤维腺瘤的鉴别效能较高,且优于CT、钼靶、磁共振等建立的模型。这可能由于TNBC在超声图像的异质性较高所致[13-14]。
我们此次研究的局限性:①病变数量少,可能导致结果不稳定,未来仍需要更大样本量的超声组学研究;②不同机器检查患者,所得到的超声图像可能影响结果的分析;③本次研究为单中心回顾性研究;④研究提取的特征是基于每个病例二维图像,其值不能准确代表整个三维病变。
总而言之,本研究建立的超声组学模型具有基于术前超声图像无创鉴别TNBC与纤维腺瘤的潜力[15]。提高早期超声诊断TNBC的准确率,并减少侵入性活检的数量,对临床医生给乳腺癌患者制定治疗方案中具有一定的指导意义。

