米槁种子发育过程的形态和生理特性1)
刘欢 黄小龙 刘济明 梁格林
(贵州大学,贵阳,550025) (贵州省林业科学研究院) (贵州大学)
米槁(CinnamomummigaoH. W. Li)为樟科(Lauraceae)樟属常绿乔木,主要分布于我国西南地区,成年树高可达25 m,树皮表面粗糙呈茶褐色,具有纵向裂纹[1],叶片互生,硬纸质,果实近球形,果托似高脚杯状,花期为4—5月份,果实发育期较长(6—11月份)[2]。米槁干燥成熟的果实又名大果木姜子,是贵州著名的药材,因具有极高的药用价值,被誉为“民族苗药”。以大果木姜子为原材料开发的理气活血滴丸、心胃止痛胶囊等为贵州民族药用产业的重要产品[3]。
种子的发育过程是植物有机个体发育的最初阶段,也是形成幼苗的重要阶段,不仅影响种子本身的特性,同时也直接关系到下一代的正常生长发育[4-5]。目前针对米槁种子的研究主要集中在种子萌发率[6]、繁殖栽培[7]、营养成分[8]、脂肪酸质量分数[9]等方面,但是关于米槁种子发育特性的研究较少。米槁种子在自然及人工条件下存在萌发障碍,且种子产量具有大小年之分,小年的种子空壳率高、萌发率低,无法实现幼苗及时的补充,使米槁种群呈现出衰退趋势[10]。已有研究表明,植物种子发育过程需要通过可溶性糖、淀粉、蛋白质等内含物质的变化以保证种子与胚胎的正常发育[11],且激素和酶能有效调控植物种子的发育进程[12-13]。本试验以米槁种子为材料,监测种胚形态发育过程,分析其发育过程中的储藏物质质量分数、酶活性及激素水平的动态变化,揭示种子发育过程中的生理特性指标的变化规律,为获得优质、高产的米槁种子提供参考。
1 材料与方法
1.1 试验材料
试验所用种子样品于2019年6—10月份采集于贵州省望谟县。选择自然状态下生长健康且无病虫害的成年植株,进行挂牌标记。于结果之日起,在植株的中上部采集米槁果实,每个月取样一次,每次取600颗果实,直至10月份果实成熟脱落,共取样5次。
1.2 测定项目及方法
1.2.1 种子发育形态及细胞结构测定
用游标卡尺(精确到0.01 mm)测量种子横径和纵径,每个取样期随机测量50粒,求取平均值,并通过烘干法和称质量法测量种子的含水率和质量。
为观察种子发育过程细胞结构变化,采用石蜡切片方法进行。本次试验选取6月、7月、8月、9月及10月份发育的种子作为研究对象,新鲜种子采样后立即去壳并取出种仁,浸泡在甲醛冰醋酸酒精混合固定液(V(甲醛)∶V(冰醋酸)∶V(酒精)=5∶5∶90,其中酒精体积比为50%),样品经不同浓度乙醇梯度脱水后浸蜡并包埋,制作切片后依次进行脱蜡和蕃红-固绿染色,封片完成后置于奥林巴斯显微镜(CX41RF,Japan)下对种子细胞结构进行测量与拍照。
1.2.2 种子发育贮藏物质质量分数测定
种子内部可溶性糖质量分数、淀粉质量分数采用蒽酮比色法测定[14],可溶性蛋白质量分数采用考马斯亮蓝-G250染色法测定[15],脂肪测定仪(SZF-06C)测定脂肪质量分数。
1.2.3 种子发育酶活性测定
丙二醛(MDA)质量摩尔浓度采用硫代巴比妥酸法(TBA)测定[16],超氧化物歧化酶(SOD)采用氮蓝四唑法(NBT)测定[17],过氧化物酶(POD)采用愈创木酚法测定[18],过氧化氢酶(CAT)采用紫外分光光度法测定[19]。
1.2.4 种子发育激素质量分数测定
采用酶联免疫试剂盒(ELISA kit)方法测定。称取0.1 g米槁种子样品,液氮中充分研磨,加入1 mL浓度为80%的甲醇提取液,于-20 ℃放置12 h;将冷藏放置后的样品离心(4 ℃,8 000 r/min,20 min)取上清液;将上清液过C-18固相萃取柱,萃取后真空干燥保存备用;上样前的样液加入1 mL的pH值7.4磷酸盐缓冲液(PBS)定容,混匀后于室温放置30 min后,在温度4 ℃的情况下,通过离心(8 000 r/min,15 min)分离,然后取上清液并于4 ℃暂时保存待用。试剂准备与具体操作步骤参照试剂盒使用说明进行,使用酶标仪在450 nm波长下测定吸光度(OD值),并根据吸光值计算样品中脱落酸(ABA)、赤霉素(GA3)、生长素(IAA)、细胞分裂素(CTK)、乙烯(ETH)、油菜素甾醇(BR)、茉莉酸(JA)、水杨酸(SA)等内源激素的质量分数并及脱落酸与赤霉素的比值(ABA/GA3)和脱落酸与生长素的比例(ABA/IAA)。不同时期激素质量分数由生物公司协作完成。
1.3 数据处理
使用SPSS 21.0统计软件包进行数据处理,不同处理间的比较采用单因素方差分析及Duncan多重比较分析,所有数据均以平均值±标准偏差(SD)表示,数据处理前先经过反正弦转换。图片制作使用Origin 9.0和AI 17.0软件进行绘制及处理。
2 结果与分析
2.1 米槁种子发育期胚形态及细胞结构变化
由图1可知,种子发育至6月份时的种胚尚未形成,半透明的果胶状组织被一层较薄的内果皮包裹,而内果皮木质化最先由种子尖端开始(图1A);7月份时,两片白色子叶由种子尖端位置开始形成,果胶状组织变得紧密,内果皮木质化程度增加,厚度也明显增加(图1B);发育到8月份时,白色子叶占据了整个种子的约3/4,果胶状组织结构明显减少且更加致密,内果皮木质化程度和厚度进一步增加(图1C);9月份时,果胶状组织完全消失,发育完整的子叶充满了整个内果皮内部(图1D);至10月份果实成熟时(图1F),种子与9月相比,外部形态结构差异主要表现为内果皮木质化后硬度的增加和颜色的加深(由于含果实直接纵切效果不佳,种子10月份成熟结构用剥皮后的种胚代替);此外,野外调查与种子解剖结构发现,发育过程中米槁种子确实存在种胚发育畸形或空壳等现象,如图1E,虽然果实和种子内果皮能够正常发育,但由于未受精,所以并未发现种胚的存在。
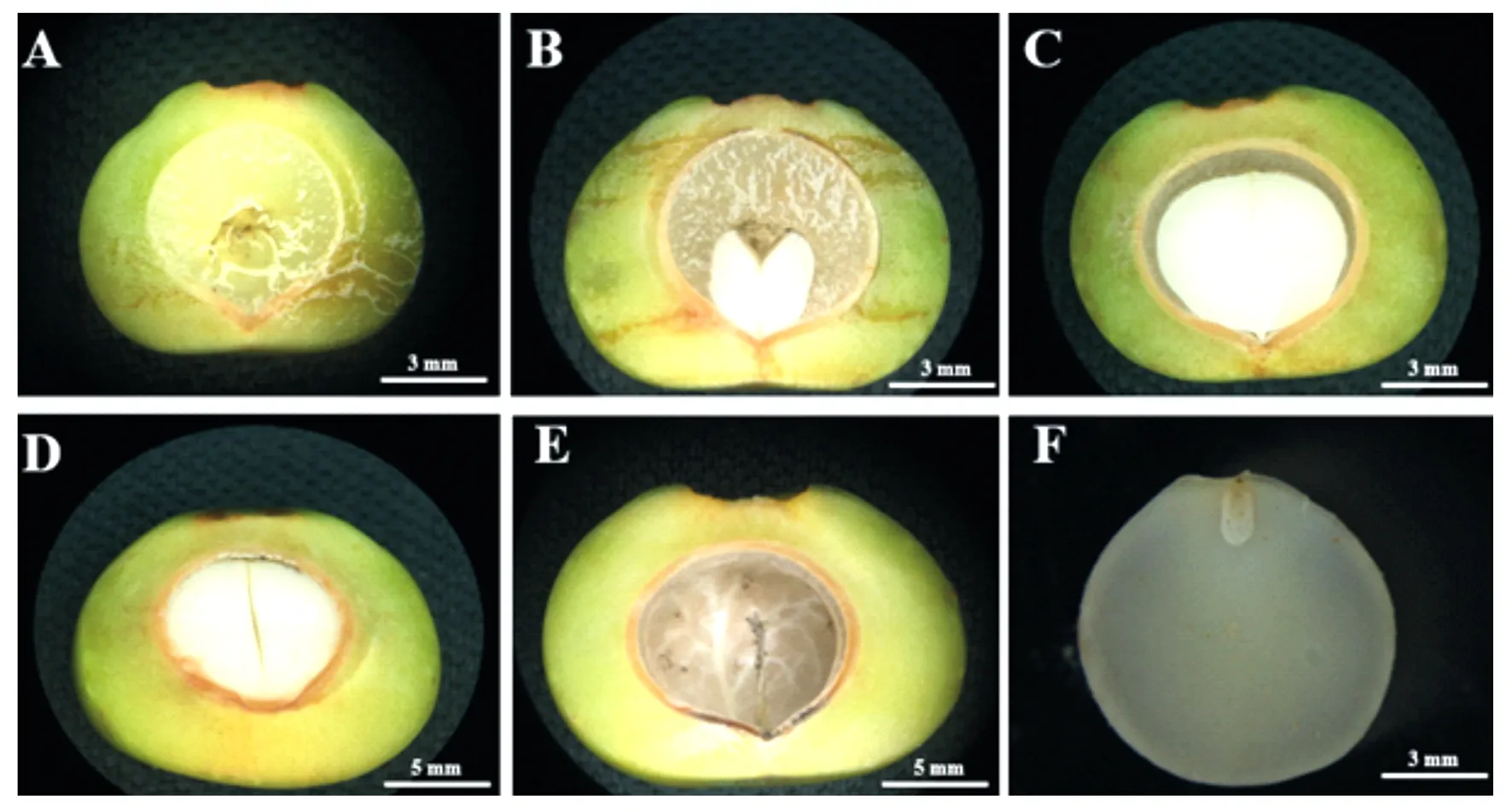
A为内果皮木质化;B、C为子叶由形成到膨大;D、E为成熟内果皮;F为种胚。
结合种子不同发育阶段,对种胚形态变化进行细胞结构观察,由图2可以看出,6月份时胚尚未形成,细胞形态轮廓并不规则,主要由一些水分和溶解态养分组成(图2A);发育至7月份时细胞经历了快速分化过程,细胞开始变的紧密,种胚初步形成(图2B);8月份时种子经过了快速的脱水过程,溶解态养分逐渐向非溶解态转化,细胞内油体开始出现(图2C);随着种胚的发育,细胞形态发育逐渐规则,且油体的数量迅速增加,可以明显看到细胞充满了密集的小油体(图2D);发育至10月份成熟时,种胚细胞排列变得更加紧密,随着贮藏物质的进一步积累,细胞内较大颗粒的油体出现,并分布在一些小油体间(图2E)。
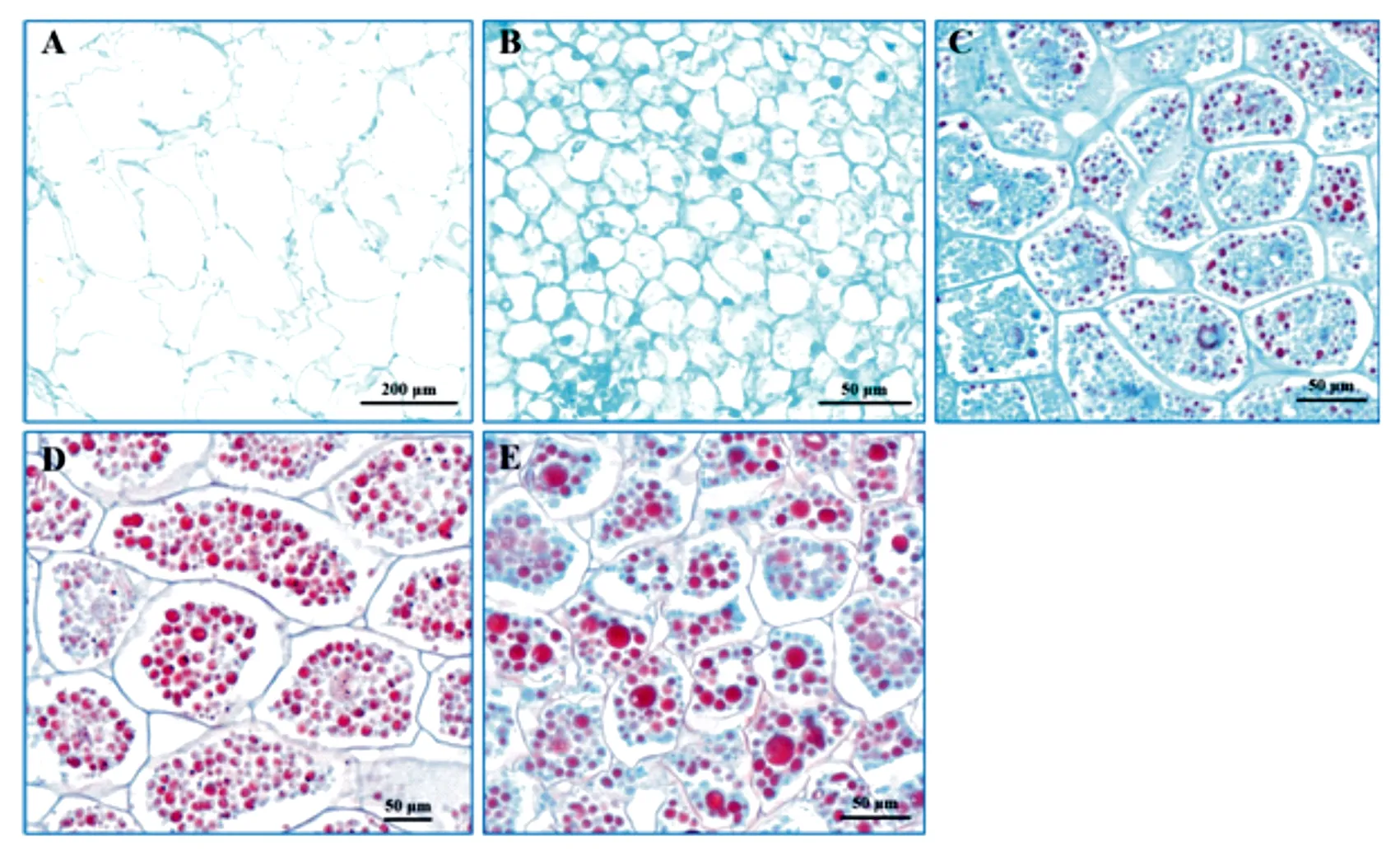
A为不规则细胞;B为种胚形成;C、D、E为细胞内油体富集过程。
由表1可知,从6月份至10月份成熟阶段,种子生长主要经历了大小变化、胚结构的形成与发育、质量的增加与脱水过程。其中,种子横径由最初的7.59 mm显著增加到10.73 mm,种子纵径由最初的7.16 mm显著增加到9.73 mm,胚横径和胚纵径分别显著增加到10.41和9.46 mm;种子质量由197.94 mg·粒-1显著增加到453.48 mg·粒-1。与其他指标相反,种子含水率在胚结构未形成时最高,含水率为92.35%,成熟时含水率为31.53%,而胚形成过程中也发现,发育至8月份时,种子含水率由7月份的86.39%迅速降至43.36%,随后又呈现缓慢降低趋势,说明8月份是种子发育过程的快速脱水阶段。
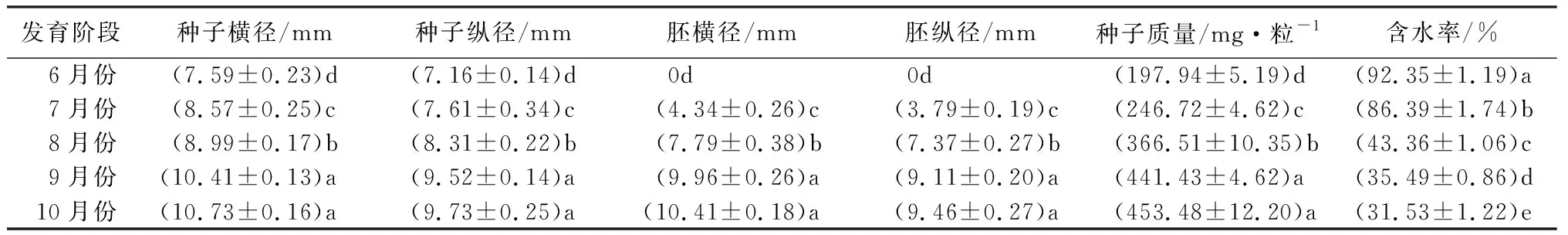
表1 米槁种子发育指标动态变化
2.2 米槁种子发育过程贮藏物质的变化
由表2可知,在种子的发育过程中,贮藏物质呈现出一个累积状态。6月份发育的种胚处于未成形阶段,果胶状组织含水量高,可溶性糖和淀粉质量分数较低;7月份种胚初步形成,可溶性糖与淀粉开始缓慢积累;随着种胚逐渐发育完整,8—9月份是两种贮藏物质的迅速积累期,发育到10月份种子成熟时,贮藏物质累积速度减缓;可溶性蛋白质量分数在6—8月发育阶段迅速增加,9—10月种子发育成熟后增加幅度减小,完全成熟时,可溶性蛋白质质量分数达到4.84 mg/g;脂肪质量分数变化趋势与可溶性糖和淀粉相似,表现为种胚发育初期缓慢增加,9月份发育完整时迅速积累,之后趋于平缓增加,种子成熟时脂肪质量分数由最初的0.57 mg/g增加到462.56 mg/g。
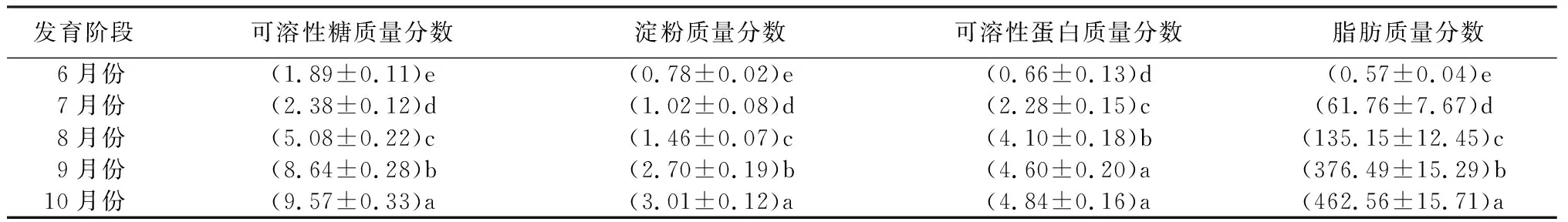
表2 米槁种子发育过程贮藏物质质量分数变化 mg·g-1
2.3 米槁种子发育过程酶活性的变化
由表3可知,在米槁种子发育过程中,MDA质量分数呈现出“上升-下降”的趋势,种胚发育到8月份时,MDA质量摩尔浓度达到最高值(0.003 2 μmol/g),在10月份种子发育成熟时MDA质量摩尔浓度降至最低(0.002 μmol/g);当细胞脂膜结构受到伤害时,抗氧化系统迅速做出反应,其中SOD、CAT活性变化趋势相同,种胚形成初期两种酶活性迅速增加,至8月份时达到最大值,SOD、CAT活性分别为6 964.25 U/g和230.04 μ·g-1·min-1,种胚发育后期阶段SOD和CAT活性持续下降;POD活性呈现出持续上升趋势,在种胚形成初期(6—7月份)上升缓慢,7—8月份的上升幅度最大,在种子发育后期至成熟时POD活性均保持在较高的水平。

表3 米槁种子发育过程酶活性变化
2.4 米槁种子发育过程内源激素水平的变化
由表4可知,米槁种子发育受到了多种激素的共同调节。BR和SA质量分数呈“上升-下降-上升”的趋势,在种子发育初期上升,种胚发育形成时其质量分数又开始下降,在8—10月份随种子的快速发育而迅速增加,其中BR质量分数在种子成熟阶段显著高于发育初期,而SA虽然在发育后期有所增加,但成熟时SA质量分数仍低于种子发育初期;ABA、GA3、IAA、CTK、JA和ETH等6种激素质量分数随种子发育整体呈现显著增加趋势,其中CTK质量分数在8月份时与7月份差异不显著,ETH质量分数在种胚形成初期表现为缓慢增长,种子成熟时6种激素质量分数达到最大值;ABA/GA3比值随种子发育呈现显著增加趋势,ABA/IAA比值在种子发育初期有所下降,随后迅速增加,且ABA与GA3和IAA的比值均在种子发育成熟时达到最大值,分别是最初的1.36和1.23倍。
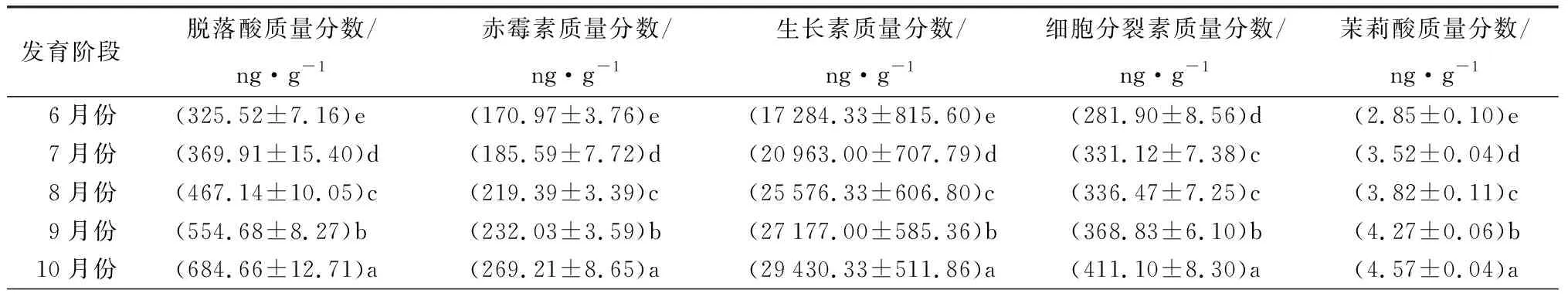
表4 米槁种子发育过程内源激素质量分数变化
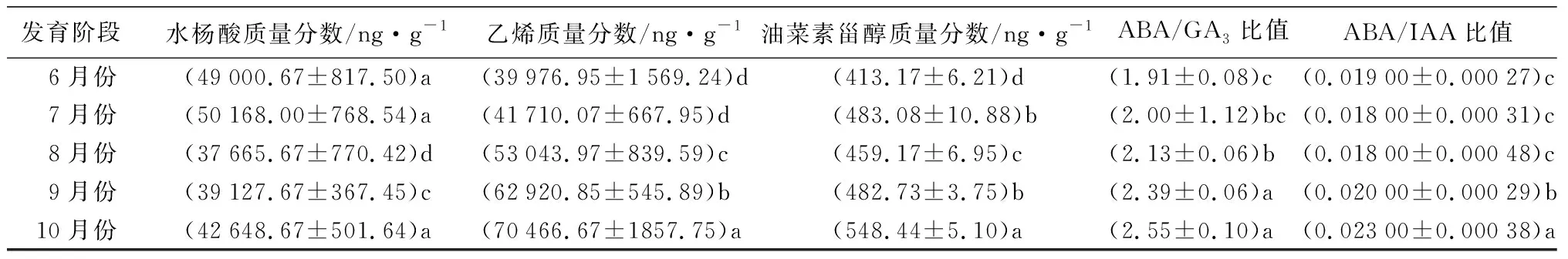
发育阶段水杨酸质量分数/ng·g-1乙烯质量分数/ng·g-1油菜素甾醇质量分数/ng·g-1ABA/GA3比值ABA/IAA比值6月份(49000.67±817.50)a(39976.95±1569.24)d(413.17±6.21)d(1.91±0.08)c (0.01900±0.00027)c7月份(50168.00±768.54)a(41710.07±667.95)d(483.08±10.88)b(2.00±1.12)bc(0.01800±0.00031)c8月份(37665.67±770.42)d(53043.97±839.59)c(459.17±6.95)c(2.13±0.06)b(0.01800±0.00048)c9月份(39127.67±367.45)c(62920.85±545.89)b(482.73±3.75)b(2.39±0.06)a(0.02000±0.00029)b10月份(42648.67±501.64)a(70466.67±1857.75)a(548.44±5.10)a(2.55±0.10)a(0.02300±0.00038)a
2.5 米槁种子发育相关性分析
由图3可知,米槁种子及种胚发育大小、种子质量与可溶性糖、淀粉、可溶性蛋白、脂肪质量分数呈极显著正相关(P<0.01),与含水量的变化呈现极显著负相关(P<0.01);种胚发育与抗氧化酶SOD、POD及CAT活性呈极显著正相关(P<0.01);种胚横径、纵径、贮藏物质积累与ABA、GA3、IAA、CTK、ETH、BR、JA质量分数变化及ABA/GA3、ABA/IAA的比值呈极显著正相关(P<0.01),与SA呈极显著负相关(P<0.01)。
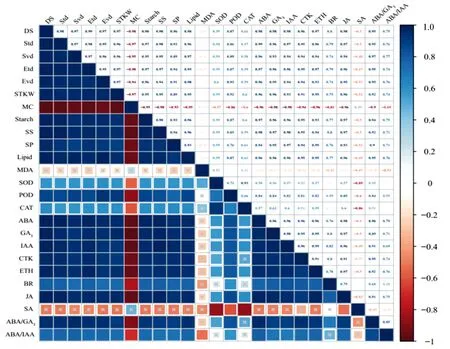
DS为发育阶段,Std为种子横径,Svd为种子纵径,Etd为胚横径,Evd为胚纵径,STKW为种子质量,MC为含水率,Starch为可溶性淀粉,SS为可溶性糖,SP为可溶性蛋白,Lipid为脂肪,MDA为丙二醛,SOD为超氧化物歧化酶,POD为过氧化物酶,CAT为过氧化氢酶,ABA为脱落酸,GA3为赤霉素,IAA为生长素,CTK为细胞分裂素,ETH为乙烯,BR为油菜素甾醇,JA为茉莉酸,SA为水杨酸,ABA/GA3为脱落酸与赤霉素的比值,ABA/IAA为脱落酸与生长素的比值。
3 讨论与结论
种子在发育进程中,常伴随着外形增大、质量增加、含水量下降等形态变化,研究证明米槁种子也遵循这一规律。在米槁种子发育过程中,含水量的变化明显,在发育初期下降幅度较小,种胚形成阶段快速下降。同时,种子发育需要经历一系列特定的生理过程,包括贮藏化合物的积累、酶类及激素的调节与代谢等[20-21]。米槁种子在整个发育过程中,贮藏化合物的质量分数整体上呈现出显著增加趋势,在种胚初步形成时期(6—7月份),可溶性糖、淀粉和脂肪积累较慢,8—9月份种子形态逐渐形成,此时胚细胞处于快速地分裂与分化阶段,可溶性糖、淀粉和脂肪的质量分数迅速增加,可溶性糖和淀粉的迅速积累为维持胚胎的正常发育提供必要的能量需求[13],种子发育成熟阶段,可溶性糖与淀粉质量分数的增加幅度变缓;可溶性蛋白质量分数在6—8月份急剧上升,这是由于种胚形成发育时内部代谢活动旺盛导致[22],随后一直保持在一个相对较高的水平,相关性分析也表明了贮藏物质积累与米槁种子发育呈极显著正相关。另外,有文献指出在种子发育过程中贮藏物质在积累的同时会被消耗,并参与种胚的生长及分化过程(例如银杏种子(Ginkgobiloba)、扁穗雀麦种子(Bromuscartharticus)等[23-24]),而本次研究发现,米槁种子整个发育阶段,贮藏物质均处于一个积累的过程,这可能是取样时间点存在差异所导致,因此关于米槁种子发育过程贮藏物质在积累的同时是否也参与到种子代谢活动中,需要进行更深入的研究。
种子发育到成熟经历的自然脱水过程会导致细胞膜功能丧失和代谢紊乱,从而引起各种活性氧(ROS)的积累,ROS可以触发有害的氧化过程,从而导致膜脂结构破裂和变性改变[25],超氧化物歧化酶、过氧化物酶和过氧化氢酶是参与去除ROS的主要酶类,能够维持细胞结构的完整,并有助于种子获得脱水耐性[26]。本研究发现,种子发育过程中膜脂过氧化产物在种胚形成初期开始上升,在8月份达到最大值,这一时期种子主要由含水量较高的果胶状组织向胚结构发育转变,受氧化作用的影响,SOD、POD和CAT等3种酶活性均表现为随MDA质量摩尔浓度的上升而迅速增加,说明抗氧化系统能够迅速做出氧化应激反应来及时清除体内的ROS,随着种胚的不断成熟,膜脂过氧化作用下降,MDA质量摩尔浓度逐渐减少,此时,SOD和CAT活性也有所降低,但POD一直稳定维持在较高水平,这与桔梗(Platycodongrandiflorum)种子[4]和沙葱(Alliummongolicum)种子[27]发育及脱水过程变化相似。另外,相关研究发现扇脉杓兰(Cypripediumjaponicum)种子完全成熟时保护酶活性较低,由于细胞膜脂过氧化,直接导致种子败育的主要原因[28]。米槁种子发育到成熟时期抗氧化酶均能够保持相对较高的水平,且种子发育与SOD、POD和CAT活性呈极显著正相关,这对胚胎顺利完成生长发育具有重要意义,也是防止米槁种子败育的重要保证。
内源激素作为重要的调控因子,参与调节种子整个生长发育过程。ABA能促进胚胎发育和调节种子膨大,同时参与成熟期种子脱水及贮藏蛋白合成等[29-30]。本研究结果显示,米槁种胚发育初期,ABA质量分数开始增加并持续增加到种子发育完成,这与甘草(Glycyrrhizauralensis)种子和莴苣种子发育过程ABA变化趋势相同,说明ABA在米槁种子胚形态的建成与胚成熟发育过程中发挥了关键作用[31-32];GA3、IAA、CTK、ETH和BR质量分数整体上表现为上升趋势,且各激素质量分数与种子、胚发育均呈极显著正相关,说明种胚发育需要经过大量的细胞分裂与增殖,而这些激素间存在协同作用,共同参与了米槁种胚形成与发育进程。早期的研究证实JA与SA主要参与植物发育和非生物胁迫下的防御响应[33],但本研究发现,JA的质量分数较低,但发育过程呈现出持续增加趋势,这是由两个原因所导致:一是JA可能参与了种胚发育;二是可溶性糖、淀粉、可溶性蛋白与脂肪质量分数均与JA呈极显著正相关,说明JA质量分数的增加对于调控米槁种子内部碳水化合物的积累具有重要作用[34];而SA质量分数在种胚发育的7月份和9—10月份增加,这是由于SA仅参与了米槁种胚初期形成与后期发育。然而,种子发育需要多种内源激素共同调节,种子早期ABA/GA3值低有利于种胚膨大生长,后期高有助于碳源积累,米槁种子ABA/GA3值的逐渐升高与激素调节种胚生长和贮藏物质的积累有关。另外,种子成熟时高浓度的ABA可能会引起种子休眠并抑制种子的萌发[35]。ABA/GA3和ABA/IAA的值随着种子发育逐渐升高,并在成熟时达到最高值,这与扇脉杓兰种子发育的变化相似[36],说明成熟期较高浓度的内源ABA是引起米槁种胚初生休眠的原因之一。
综合米槁种子发育过程中的形态和生理变化特性,种子发育与种子质量、贮藏物质(可溶性糖、淀粉、可溶性蛋白、脂肪)质量分数、抗氧化酶(SOD、POD、CAT)活性、内源激素(ABA、GA3、IAA、CTK、ETH、BR、JA质量分数及ABA/GA3、ABA/IAA的比值)呈极显著正相关,与含水量、SA质量分数呈极显著负相关。

