运动疗法对肝硬化伴肌少症的作用及其机制
廖粤生,白莉莉
天津师范大学 体育科学学院,天津 300387
肌肉减少症(以下简称肌少症)的致病因素复杂,是一种以进行性、广泛性骨骼肌质量减少、生理功能减退为主要特征的临床综合征,也是肝硬化常见的并发症,严重影响患者的生存和预后[1-2]。基础研究和临床研究已证实,运动疗法对改善肝硬化伴肌少症具有积极的干预效果[3-4],但具体机制尚未有明确定论。本文旨在总结运动疗法对肝硬化伴肌少症的干预效果及相关机制的研究进展。
1 肝硬化伴肌少症流行病学概述
肌少症(sarcopenia)最早起源于希腊语,“sarcopenia”中的“sarx”意指肌肉,“penia”意指减少或丢失,最早于1989年由Rosenberg教授[5]命名。2010年和2011年欧洲肌少症工作组(The European Working Group on Sarcopenia in Older People,EWGSOP)[6]和国际肌少症工作组(International Working Group on Sarcopenia,IWGS)[7]分别发布了关于肌少症的相关共识,将肌少症定义为“与增龄相关的以骨骼肌质量下降、力量减退、生理功能降低为主要特点的退行性综合征”。30%~70%的肝硬化患者患有肌少症,其中酒精性肝硬化患者的患病率高达80%,常见于男性。肌少症也可能在任何BMI异常患者中发生,是一种常见的隐匿性疾病[8]。肌少症是肝硬化患者病死率的独立预测因素,尤其在终末期肝病模型(MELD)评分<15分的患者中更为凸出[9]。肌少症也是肝硬化患者轻微肝性脑病及显性肝性脑病的独立危险因素,同时增加经颈静脉肝内门体分流术后发生肝性脑病及术后细菌感染的风险[10]。在104例肝硬化患者中,32%的代偿期患者和54%的失代偿期患者患有肌少症[11]。在终末期肝病患者中,50%的男性患者和33%的女性患者出现肌少症[12]。一项针对142例等待肝移植患者的回顾性研究[13]发现,肌少症的发生率为51%,男性占比高于女性,且肌少症的发生率随着肝病的进展而升高。
2 关于运动改善肝硬化伴肌少症的指导意见
肌少症的发病因素复杂,主要与营养物质缺乏、代谢异常、激素水平异常、血氨水平升高、肠道菌群、泛素-蛋白酶体系统和自噬的激活等因素有关[14]。随着疾病的进展和变化,以及合成抵抗的增加,肝硬化伴肌少症患者的营养不良和骨骼肌质量丢失等症状将加速病理进程,仅仅以营养补充或药物作为治疗手段效果欠佳。研究[15]发现,运动疗法对于解决此类疾病具有副作用少、效益高、操作性强等诸多优势,联合适宜的运动可能是改善此类疾病的有效手段。美国运动医学院出台的关于慢性病和残疾人管理的指导方针[16]中指出,慢性病患者适当开展针对性的锻炼计划有助于改善疾病症状。美国肝病学会[17]推出的在线教育资源指出,肝硬化患者开展个性化的运动干预有助于减缓病理进程。欧洲肝病学会[18]于2018年也将“加强患者肢体活动及锻炼”纳入了治疗肝硬化患者的策略当中。拉丁美洲肝病学会[19]出台的临床实践指南中提出,经常参与体育锻炼有助于防治乙型肝炎肝硬化。亚太肝病学会临床诊疗指南[20]中提出,普通成人每天进行30 min(3~5次/周)的中等强度有氧运动或抗阻运动有利于减少肝脏类疾病的发病风险。此外,流行病学研究[21]表明,适量的锻炼可以保持肌肉相关的功能,包括步态、速度、平衡和日常活动,还可以降低肌少症的患病风险。综上所述,运动是改善肝硬化伴肌少症的有效手段,应根据患者的年龄、性别、疾病严重程度及体能等情况科学制订个性化的运动干预方案。
3 不同类型运动对肝硬化伴肌少症的影响
运动可以增加肌肉质量,减少体脂,提高肌肉力量、耐力,改善免疫功能。因此,研究不同类型运动对肌少症的影响至关重要。目前治疗肌少症的主要运动类型包括有氧运动与抗阻运动(表1),以下主要总结有氧运动与抗阻运动对肝硬化伴肌少症的影响。

表1 有氧运动与抗阻运动对肝硬化伴肌少症患者的影响
3.1 有氧运动 有氧运动是指人体在氧气充分供应的情况下进行的体育锻炼,目前常见的有氧运动项目包括慢跑、骑自行车、游泳等。有氧运动干预肝硬化伴肌少症的主要机制在于通过增强胰岛素信号通路敏感性,促进健康线粒体和骨骼肌细胞蛋白合成[22]。Faustini-Pereira等[23]研究发现,持续2~3个月(2次/周)的有氧运动可显著改善肝硬化患者的最大摄氧量。Zenith等[24]对9例肝硬化患者进行了为期8周(3次/周)的有氧运动干预,患者的最大摄氧量和肌肉质量明显提升,疲劳明显减少。Kerling等[25]对30例肝硬化伴肌少症患者进行了为期6周(3次/周,45 min/次)的有氧运动干预,患者的肌肉质量明显提升,提示有氧运动对肌少症患者具有积极的治疗效果。此外,向谦等[26]对19例肝硬化患者进行了为期3个月(3次/周,30 min/次)的低强度有氧运动(慢走、体操)干预研究,锻炼前后监测心率、血压变化,运动强度控制在患者年龄相关最大心率的60%以下,研究发现,患者在接受治疗后的肌肉质量明显提升,提示低强度有氧运动对肝硬化伴肌少症的综合诊治具有积极的作用与较高的安全性。
3.2 抗阻运动 抗阻运动是指肌肉在克服外来阻力时进行的主动运动,能够恢复和发展肌力,是常见的治疗方案之一,其内容主要包括仰卧起坐、仰卧推举、拉伸器训练等。Aamann等[27]对39例肝硬化患者进行了为期12周的抗阻训练(3次/周)干预后,患者的膝盖伸展峰值扭矩平均增加13%,肌肉力量增加11%,且生活质量评分也得到了显著提高。Debette-Gratien等[28]对13例肝硬化患者进行了持续12周的抗阻力量训练(20 min/次),患者的最大摄氧量明显提升,肌肉质量也有显著提升。抗阻运动(2~3次/周,45~60 min/次)在提升肝硬化患者的肌肉质量和肌肉力量的同时,增加了患者骨骼肌蛋白质的合成和肌肉纤维的大小[29]。此外,有研究[30]对比了有氧运动与抗阻运动对肝硬化伴肌少症大鼠肌肉质量和细胞横截面积的影响,发现抗阻运动对大鼠的肌肉质量和细胞横截面积增加更为显著,提示抗阻运动改善肌少症的效果优于有氧运动。
笔者建议肝硬化伴肌少症患者康复期每周进行3~5次,且每次持续30~60 min的中等强度有氧运动或抗阻运动。需要注意的是,患者应在护士或康复科医师等专业人员的指导下进行运动,并且运动处方的制订应充分考虑肝硬化伴肌少症患者的年龄、性别、疾病严重程度及体能等的情况,以提高运动干预的安全性与有效性。
4 运动改善肝硬化伴肌少症的可能机制
4.1 纠正线粒体功能障碍 研究[30]证实,线粒体功能障碍将导致组织退化、骨骼肌萎缩、肌肉功能障碍和纤维组织增加,是诱导肌少症的主要原因。过氧化物酶体增殖物活化受体γ辅激活蛋白-1α(peroxisome proliferator-activated receptor gamma coactivator-1 alpha,PGC-1α)是调控线粒体生物发生最关键的转录因子,PGC-1α表达上调可促进骨骼肌细胞钙循环进行调节,提高骨骼肌的摄氧量并重塑神经肌肉接点,促进线粒体和脂肪合成,提高骨骼肌对葡萄糖的利用效率,改善骨骼肌代谢[8]。Summermatter等[31]研究发现,运动可通过上调PGC-1α重构钙离子(Ca2+)转运,促使骨骼肌PGC-1α降低肌钙蛋白表达进而诱导肌质网减少Ca2+释放,以此增强骨骼肌线粒体有氧氧化能力,从而纠正线粒体功能障碍。动物实验[32]发现35周中等强度跑台训练后大鼠骨骼肌PGC-1α表达上调,氧化磷酸化增强,骨骼肌ATP合成速率增加。此外,Pin等[33]研究发现运动干预后小鼠骨骼肌PGC-1α水平显著上升,自噬相关蛋白表达显著下降,受损线粒体被清除,线粒体结构和功能恢复,有效控制了小鼠肌肉质量的减少。上述研究结果表明,运动可通过上调PGC-1α水平,纠正线粒体功能障碍,进而改善肝硬化伴肌少症。
4.2 调控骨骼肌细胞因子表达 肌肉生长抑制素(myostatin,MSTN)属于TGFβ中的一部分,是一种限制组织肌肉生长的蛋白质,主要由骨骼肌释放。MSTN仅在骨骼肌中表达,通过抑制胰岛素样生长因子1或卵泡抑素的表达来控制成肌细胞的分化和增殖,MSTN水平过高会对骨骼肌质量和生长产生负面影响[34]。Yarasheski等[35]研究发现,肌少症患者骨骼肌中的MSTN水平显著高于健康人群,提示调节机体循环MSTN水平是治疗肌少症的关键。Lenk等[36]研究发现,慢性心力衰竭患者进行为期12周的有氧运动干预后,患者骨骼肌中的MSTN浓度显著降低。Kabak等[37]对18~24岁成年男性进行高强度间歇运动干预后即刻以及恢复后的第3、6个小时对血样进行检测,发现血清中MSTN水平均有显著升高。另有研究[38]发现,单次中等强度耐力运动可致患者MSTN基因表达降低20%;长期有氧运动可下调肥胖中老年个体肌肉MSTN mRNA表达,还可诱导MSTN及其下游蛋白CDK2(Tyr15)磷酸化降低。以上研究提示,运动可调控肌少症患者骨骼肌中MSTN水平,进而改善肝硬化伴肌少症。
4.3 调节炎症通路 炎症标志物TNFα是肌少症的最佳预测因子,在肌少症的病变过程中发挥重要作用,高水平的TNFα通过抑制AKT/MTOR途径而增加肌肉分解代谢,患者体内高水平的炎性细胞因子是造成肌肉质量下降的重要原因[39]。运动的良好抗炎作用已得到广泛证实。Gielen等[40]研究发现,运动干预可显著降低患者骨骼肌促炎因子TNFα和IL-6等的表达,降低骨骼肌炎症反应,改善骨骼肌萎缩,减少肌肉流失。Effting等[41]对肥胖小鼠进行8周抗阻运动干预后发现,运动可显著降低小鼠体内TNFα、活性氧和丙二醛水平,提示运动对改善炎症和氧化应激水平具有积极效果。另一项动物实验[42]对大鼠进行为期8周有氧运动干预后,发现运动能显著降低大鼠血清TNFα水平,降低骨骼肌NADPH氧化酶和活性氧产生,抑制NF-κB和泛素蛋白酶系统的过度活化,抑制蛋白质降解。以上研究结果提示,运动可通过抑制TNFα等炎性因子表达,减轻肌少症患者炎性症状,从而改善肝硬化伴肌少症。
4.4 激活骨骼肌自噬 自噬是一种细胞内降解过程,可以去除错误折叠的蛋白质和受损的细胞器,自噬活性不足和自噬功能异常是肌少症的重要致病因素之一[43]。临床研究[44]证实,适度运动可以上调细胞自噬水平,从而保持细胞内环境稳态。动物实验[45]发现,8周有氧运动干预后老龄小鼠骨骼肌的自噬相关基因LC3-Ⅱ及Beclin-1表达升高,提示运动可提高老龄小鼠的基础自噬水平,并改善衰老引起的自噬活性下降。White等[46]对小鼠进行为期34周的自主抗阻运动干预后,发现其自噬流量LC3Ⅱ/Ⅰ比值显著升高,并增加了肌细胞内的线粒体密度,改善了氧化供能能力,从而改善了小鼠的肌少症。此外,Mackenzie等[47]研究发现抗阻运动干预后小鼠骨骼肌质量和力量均明显增加,提示其机制可能与Vps34介导骨骼肌自噬信号激活有关。以上研究提示,运动可通过激活骨骼肌自噬实现对肝硬化伴肌少症的预防与治疗。
5 小结与展望
综上所述,运动疗法对肝硬化伴肌少症具有积极的治疗效果,有氧运动与抗阻运动是目前治疗肝硬化伴肌少症的主要运动类型,且抗阻运动的疗效优于有氧运动。运动疗法治疗肝硬化伴肌少症的主要机制在于通过纠正线粒体功能障碍、调控骨骼肌细胞因子表达、调节炎症通路以及激活骨骼肌自噬(图1)。因此,运动疗法可以作为治疗肝硬化伴肌少症的重要手段。值得注意的是,目前肝硬化伴肌少症尚未形成系统的运动治疗体系,建议未来相关研究根据肝硬化伴肌少症患者的年龄、性别、疾病严重程度及体能等情况细化研究内容,建立安全及有效的运动处方库,并制订科学的实施路径,对预防与治疗肝硬化伴肌少症具有十分重要的意义。
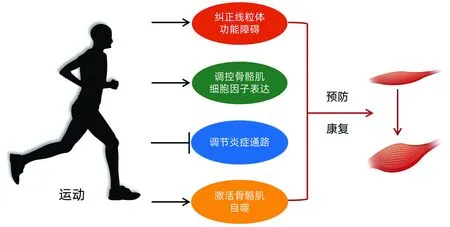
图1 运动改善肝硬化伴肌少症的可能机制
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:廖粤生负责拟定写作思路,分析资料,撰写及修改论文;白莉莉负责指导撰写文章并最后定稿。

