舒肝宁注射液对于氯丙嗪引起的新型组织工程肝构建的胆汁淤积型药物性肝损伤模型的影响
黄 龙,陈 煜,吴 桥,2,段钟平
1 首都医科大学附属北京佑安医院 a.肝病中心四科;b.肝衰竭与人工肝治疗研究北京市重点实验室, 北京 100069;2 首都医科大学附属北京天坛医院 感染中心,北京 100070
药物性肝损伤(drug-induced liver injury,DILI)是临床常见的药物不良反应,是药物研发失败和撤市的重要因素,胆汁淤积型和混合肝细胞/胆汁淤积型损伤构成DILI的两种主要亚型,可能占所有DILI病例的50%[1],药物引起的胆汁淤积临床可表现为瘙痒、乏力、尿色加深和黄疸等[2]。目前,胆汁淤积的临床治疗缺乏有效的药物,仅有熊去氧胆酸和奥贝胆酸是可用于临床且公认有一定疗效的药物,但其治疗效果有限、个体差异大,且对于药物引起的胆汁淤积的治疗效果不理想。因此,开发新的胆汁淤积型肝损伤治疗药物十分必要,同时中药在改善药物引起的胆汁淤积(drug induced cholestatic,DIC)的作用方面受到越来越多的关注。舒肝宁注射液(Shuganning injection,SGN)是以茵陈提取物、栀子提取物、黄芩苷、板蓝根提取物、灵芝提取物为原料,经现代提取、精制而成的中药注射剂,具有清热解毒、利湿退黄、益气扶正、保肝护肝的功效,是临床上常用的退黄保肝药物[3]。目前有大量临床文献报道其具有保肝和改善肝内胆汁淤积的作用,但是其具体的退黄机制尚不明确。
药物诱发胆汁淤积的机制是多种多样的,且存在未知的因素。事实上,除了肝胆转运蛋白[胆汁酸盐输出泵(bile salt export pump,BSEP)/多药耐药蛋白2(MRP2)]的变化,其他机制例如损坏细胞骨架、氧化应激等因素均可参与胆汁淤积的病理过程[4]。氯丙嗪(CPZ)属于吩噻嗪类抗精神分裂症药物,有研究[5]表明CPZ引起胆汁淤积性肝损伤约占用药者0.5%~1%,一般在用药3周内出现黄疸,停药后3个月内3/4患者可恢复。目前有研究[6]证明了CPZ可以抑制法尼醇X受体(FXR)表达,引起胆汁酸盐过度生成,同时CPZ是胆盐输出泵BSEP的直接抑制剂,可以抑制胆汁酸盐外排,进一步加剧胆汁酸盐在肝细胞内蓄积。除此之外CPZ引起的氧化应激早期可加重胆汁淤积[7],CPZ所致肝细胞胆汁淤积的临床表现、发病特征,与其他特异质肝毒性(ILT)的表现形式一样,具有不可预测性、发生率低等特点[8]。本研究首先建立CPZ致胆汁淤积模型,由于新鲜的人肝细胞的来源有限,作者使用了表达1期和2期药物代谢酶和转运蛋白的分化人 HepG2细胞系,并在体外通过对天然获取的大鼠脱细胞支架进行再细胞化在体外建立新型3D组织工程(tissue engineering,TE)肝脏,在此基础之上加入CPZ及胆汁酸盐混合物(使用时需稀释1000倍)构建DIC模型,分析CPZ治疗引起的肝内胆汁淤积的特征,探索舒肝宁对CPZ诱导的DIC保护作用。
1 资料与方法
1.1 试剂 DMEM购自赛默飞世尔生物化学制品(北京)有限公司;胎牛血清、胰酶、青链霉素购自美国Gibco公司;PCR提取试剂盒TaKaRa RNA PCR Kit(AWV)。SGN由贵州瑞和制药有限公司提供。蠕动泵购自Master-Flex、0.22 μm滤器(millex-GV)、SDC购自VETEC、一次性静脉留置针(泰尔茂Hybria Ⅱ B型三通)、CCK8试剂盒购自DOJINDO公司、ROS检测试剂盒(上海碧云天)、超氧化物歧化酶(SOD)试剂盒以及谷胱甘肽(GSH)试剂盒均购自南京建成生物工程研究所。谷草转氨酶(AST/GOT)测试盒、谷丙转氨酶(ALT/GPT)测试盒、乳酸脱氢酶(LDH)测试盒以及AKP测试盒均购自南京建成生物工程研究所。CPZ和波生坦(BOS)购自MCE(MedChemExpress)公司。胆汁酸混合物的组成和相应的浓度见表1。
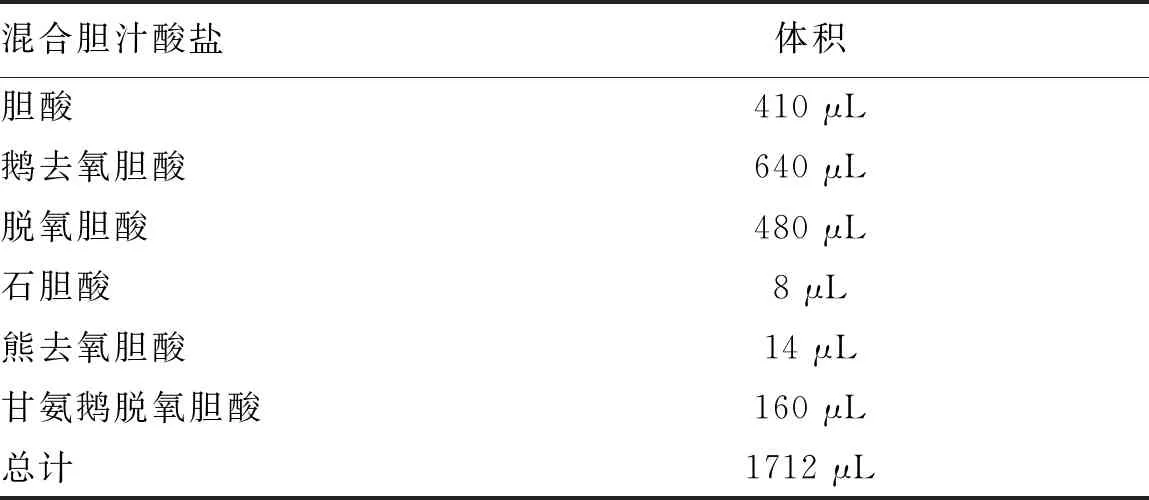
表1 1000×的混合胆汁酸盐配方表
1.2 实验动物 雄性Sprague-Dawley大鼠12只(体质量180~220 g)来自斯贝福实验动物中心,实验前动物正常饲养。实验动物生产许可证号:SCXK(京)2019-0010。
1.3 方法
1.3.1 DILI肝脏脱细胞支架的制备 大鼠提前24 h禁食,提前4 h禁水。大鼠用10%水合氯醛麻醉,消毒后打开腹腔,暴露肝脏及门静脉,将静脉留置针从门静脉进针,固定后,开启蠕动泵,流速20 mL/min~15 mL/min,冲洗约20 min。随后序贯性泵入2% PLA2酶10 min,预冷的生理盐水20 min,紧接着将整个肝脏摘取下来,尽量保证摘取肝脏的完整。随后将大鼠肝脏支架结扎、修剪并保留肝中叶,放置于事先装好DMEM的无菌异形瓶内,连接蠕动泵装置,在37 ℃、5% CO2的培养箱中循环灌流过夜。
1.3.2 细胞培养及模型构建 将高分化的HepG2细胞于DMEM培养基(加入10%牛胎血清和5%双抗)中培养。每个支架以7 mL/min分3次接种,每次1×107个细胞,共3000万个HepG2细胞,所选择的灌注速率是基于成年大鼠静止期间肝脏血流速度(85 mL·min-1·kg-1);再细胞化完成后开始连续3 d每天在异形瓶中加入100 mL DMEM以及100 μL配置好的1000×胆汁酸盐配方对培养基进行换液;再细胞化后的肝脏培养3 d后可进行造模,损伤组于第5天加入10 mmol/L CPZ蠕动泵循环培养24 h后构建胆汁淤积性体外模型。损伤保护组于再细胞化后第4天提前加入SGN进行保护,24 h后于再细胞化后第5天加入CPZ再培养24 h,损伤组和损伤保护组均在加入CPZ药物24 h后把肝脏取出,换药前上清和换药后上清送检(图1)。
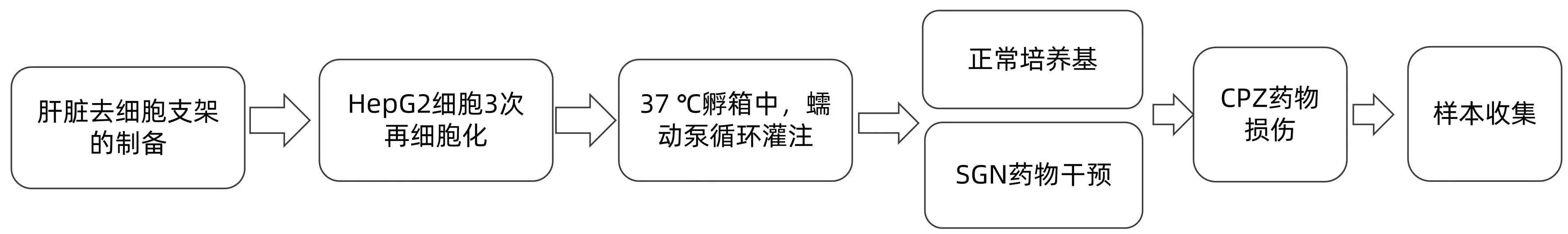
图1 制备CPZ所致胆汁淤积型肝损伤及药物干预流程
1.3.3 细胞毒性检测 CCK8将HepG2细胞制成40~60个/μL的细胞悬液,在96孔板中每孔加入100 μL的细胞悬液。培养24 h,向平面培养板加入不同浓度(103、104、105、106、107、108稀释液)的SGN,作用24 h后根据试剂说明书要求,向每孔加入10 μL CCK8溶液,将96孔板放在细胞孵养箱培养20 min,用酶标仪测定450 nm处的吸光度(OD),并计算细胞增殖-毒性。
1.3.4 活性氧(ROS)检测 将下机后的肝脏在圆皿中充分研磨,加入10 mL PBS溶液收集研磨下来的细胞,放入15 mL离心管中,2000 r/min离心10 min,离心两次后弃掉上清收集细胞,加入500 μL PBS和0.5 μL荧光探针DCFH-DA,放入水浴锅中37 ℃孵育40 min,用PBS溶液洗涤两次,加入200 μL PBS混匀,用荧光酶标仪480 nm激发波长,525 nm发射波长测定结果。计算细胞中的ROS数据。
1.3.5 GSH测定 将肝脏研磨后,收集研磨后的细胞,加入10 mL PBS,离心后使用PBS清洗1~2次后再次离心收集沉淀细胞,再加入0.3~0.5 mL 0.1 mol/L pH值7.4的等渗PBS缓冲液悬浮细胞,手动研磨破碎细胞,细胞充分破碎后取破碎后的细胞悬液0.1 mL加0.1 mL的试剂盒中的试剂一混匀,3500 r/min,离心10 min,取上清液待测。根据试剂盒说明书,在96孔板加样,混匀静置5 min后用酶标仪405 nm处测定各孔吸亮度值,计算细胞中GSH的含量。
1.3.6 SOD测定 将肝脏研磨后,收集研磨后的细胞加入10 mL OBS,离心1000 r/min,10 min,弃上清留沉淀细胞,在细胞沉淀中加入一定量的缓冲液PBS,用手动玻璃匀浆器冰水浴研磨3~5 min,准备好样品后根据试剂盒说明书,在96孔板中加样,混匀后,37 ℃孵育20 min,在波长450 nm,酶标仪测定吸亮度,计算细胞中SOD的含量。
1.3.7 AST、ALT、LDH、ALP试剂盒检测上清 将肝脏下机后异型瓶中的上清液收集,根据南京建成上清试剂盒的检测说明书于96孔板中加样,再根据说明书中要求的波长条件于酶标仪中测定各样本的OD值,通过计算换算测定出样品中的数值。
1.3.8 RT-qPCR及Western Blot检测 RT-PCR:用Trizol提取总RNA,稀释后紫外分光光度计,计算RNA浓度,然后用DNase处理。使用TakaRa试剂盒反转录后在ABI SteOnePlus机器上运行qPCR,所用引物见表2。
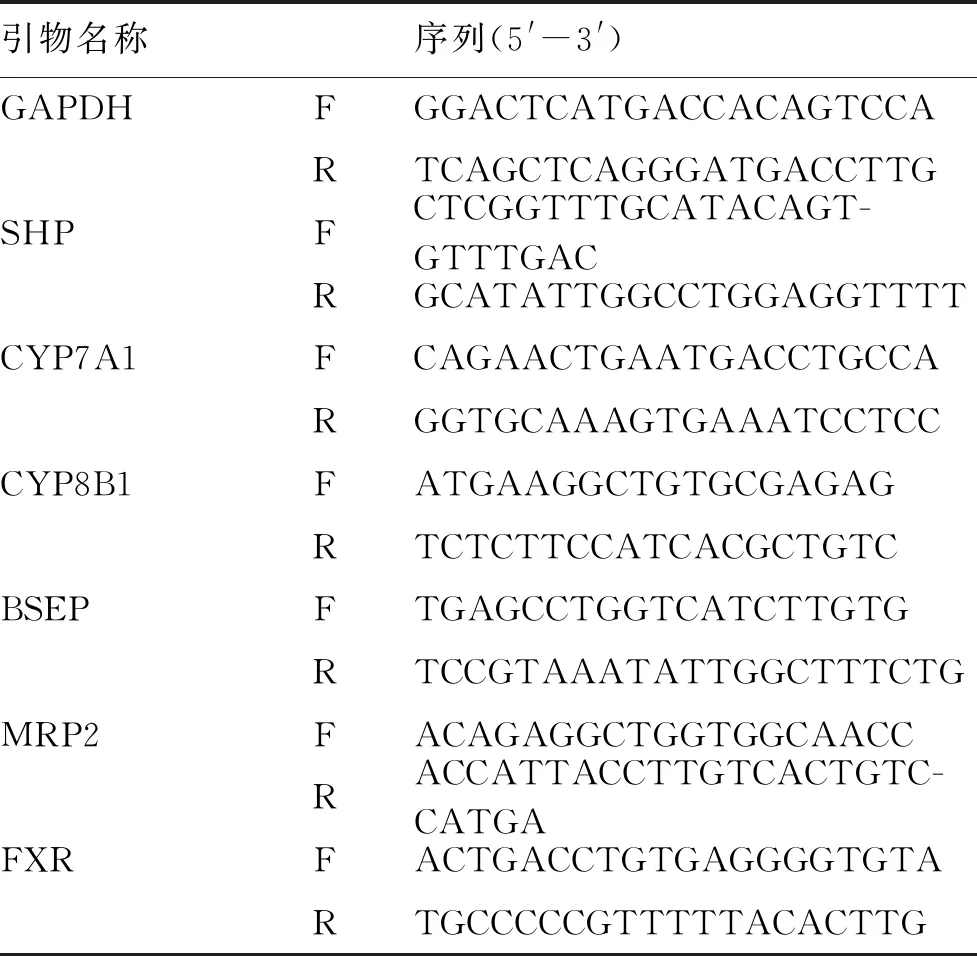
表2 PCR引物序列
Western Blot 检测:收集上述各组细胞,提取细胞总蛋白,以 BCA 法测定蛋白质浓度。通过配胶、上样、转膜这些过程后,用TBST和奶粉以5%的比例配置10 mL封闭液,摇床40 r/min,常温在摇床封闭1 h或者在摇床4 ℃进行封闭过夜。之后将抗体按照实验所需浓度配置好,将已经封闭好的PVDF膜放入一抗中,将摇床调到40 r/min,4 ℃摇床孵育过夜。第二天加入10 mL TBST洗膜液,90 r/min,5 min。重复3次,紧接着将PVDF膜洗完后,将其放入配置好的二抗中,摇床转速40 r/min,在室温进行1 h孵育。再加入10 mL TBST洗膜液,90 r/min,5 min。再次重复3次。最后按照1∶1的比例将显影液配好,PVDF膜放在塑封膜上,吸干表面残存的液体。在PVDF膜上涂上显影液,然后放入显影仪中成像。
2 结果
2.1 DILI模型的建立 再细胞化后的组织工程肝脏在孵箱中用蠕动泵持续灌注。正常培养的组织工程肝脏用完全培养基培养,7 d后观察CPZ损伤组和正常对照组(图2)。
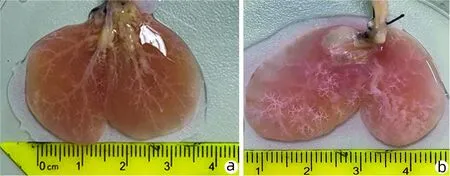
注:a,CPZ损伤组;b,正常对照组。
2.2 SGN的细胞毒性和保护作用 用平面96孔板的方法检测了SGN的细胞毒性,使用不同浓度的SGN,SGN均无明显的细胞毒性(图3a),进一步在加入CPZ损伤的情况下观察不同浓度SGN的保护作用,发现从105倍的稀释浓度开始其保护作用呈剂量依赖性。说明SGN对细胞具有良好的保护性,选取保护作用最明显的103倍稀释浓度作为实验用药物浓度(图3b)。
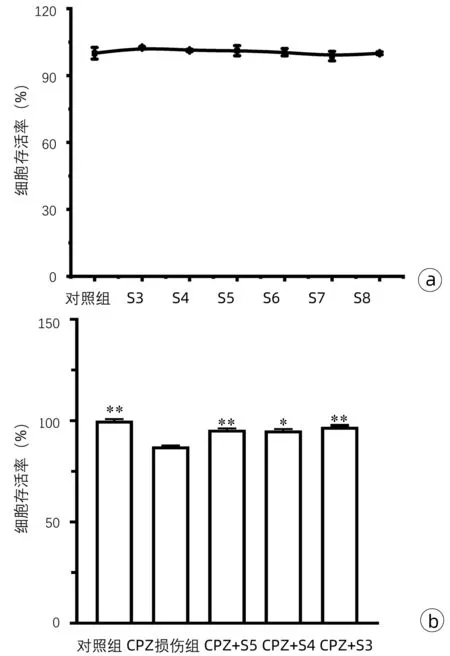
注:a,不同SGN浓度对细胞的毒性;b,不同浓度SGN对细胞的保护作用。S3,SNG稀释103倍;S4,SGN稀释104倍;S5,SGN稀释105倍;S6,SGN稀释106倍;S7,SGN稀释107倍,S8,SGN稀释108倍。与CPZ损伤组比较,*P<0.001,**P<0.000 1。
2.3 SGN对CPZ引起的氧化应激反应的作用 ROS结果显示,当受到药物损伤时,SGN可以有效的减少细胞ROS的产生,从而对细胞产生保护作用。还原性GSH的检测结果显示,当细胞受到药物损伤时,SGN可以有效的增加细胞内GSH的含量,从而增加细胞的抗氧化作用。SOD的检测结果显示,当细胞受到药物损伤时,SGN可有效的增加细胞内SOD的含量,使得细胞抗氧化能力增加。丙二醛(MDA)结果显示,当受到药物损伤时,SGN可以有效减少细胞内过氧化脂质的产生(图4)。以上结果反映了SGN在氧化应激反应中的保护作用。
2.4 SGN对CPZ引起的组织工程肝损伤的保护作用 通过HE染色结果发现,在SGN的保护作用下,细胞的损伤明显减少,细胞的数量相对于损伤组有明显的提高(图5)。在上清液的各种指标的检测中,发现AST、ALT、LDH和ALP等反应肝损伤程度的指标中在加入SGN的保护组中均较损伤组有明显的下降(图6),以上这些数据证明了SGN对于DIC型肝损伤模型具有较好的保护作用。
2.5 SGN对CYP7A1和CYP8B1表达的影响 RT-qPCR 的结果发现在加入CPZ后,会引起CYP7A1和CYP8B1这两种酶类的基因水平升高,而在加入SGN保护后则可以抑制这两种酶的表达。Westeren Blot 的结果也说明了在SGN的保护作用下,CYP7A1/8B1的蛋白表达水平已发生降低(图7)。
2.6 SGN对BSEP和MRP2表达及FXR和SHP核受体的影响 SGN可以增加BSEP和MRP2两种转运蛋白的表达,并激活FXR和SHP核受体。由图8可见,CPZ损伤后,BSEP及MRP2的基因水平表达明显降低,而加入了SGN进行保护后,BSEP及MRP2的mRNA表达水平显著升高。在SGN的保护作用下,FXR和SHP两种核受体的基因及蛋白表达水平较CPZ损伤组均显著增加。
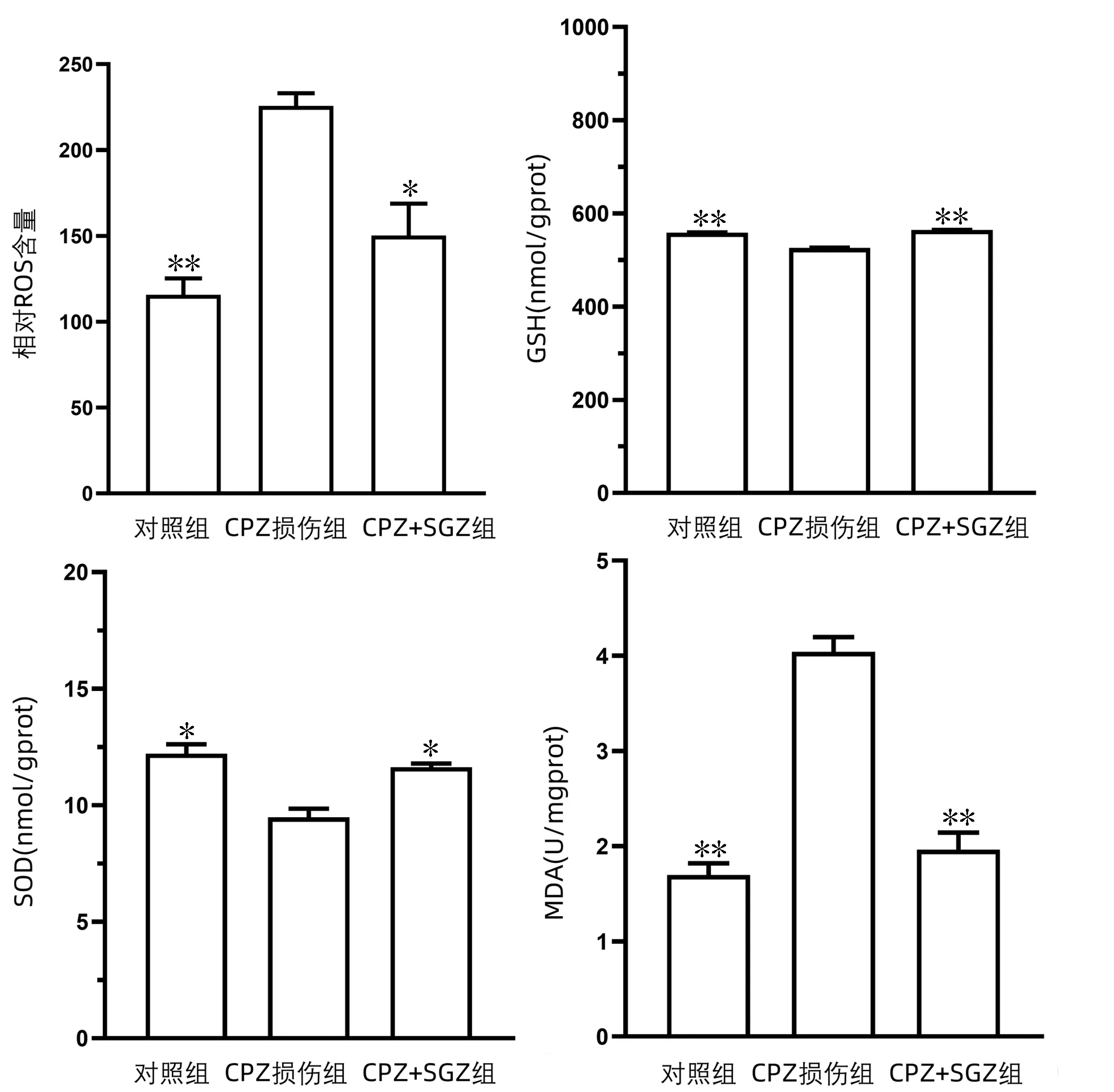
注:与CPZ损伤组比较,*P<0.001,**P<0.000 1。
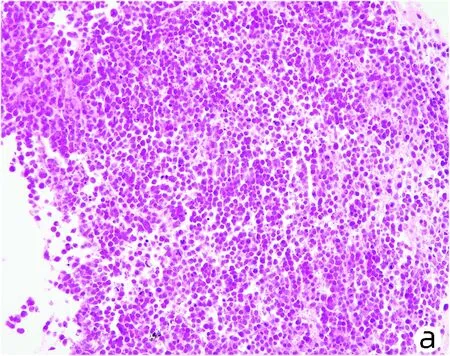
注:a,正常组;b,CPZ损伤组;c,SGN+CPZ保护组。
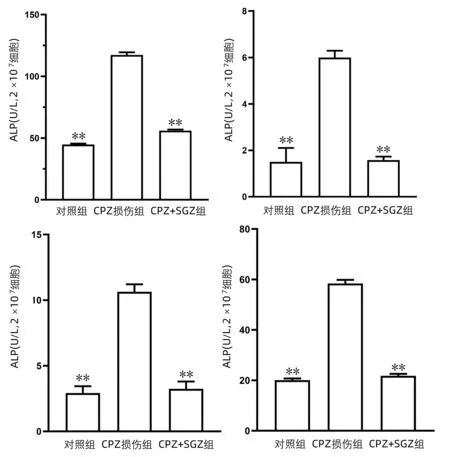
注:与CPZ损伤组比较,**P<0.000 1。
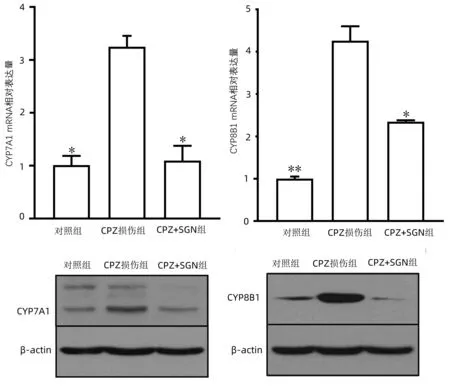
注:与CPZ损伤组比较,*P<0.001,**P<0.000 1。
3 讨论
DIC是一个重要的临床问题,会导致药物撤市及停产,造成重大的经济损失[6]。DIC的临床前预测目前主要限于测量该化合物抑制BSEP的潜力。然而,DIC的表现通常是复杂的,多因素的。因此,需要新的体外测定法,其可在生理学相关的肝模型中全面评估化合物的胆汁淤积风险,笔者团队构建了3D 组织工程肝胆汁淤积型DILI模型,该模型被证实与药物性胆汁淤积患者早期的许多临床表现相似,包括血清生化指标ALT、AST、TBil、TBA及胆汁酸盐谱的变化、白蛋白和尿素氮合成增加。由于模型采用人的肝细胞,因此种属差异性小,是一种良好的DIC细胞模型。
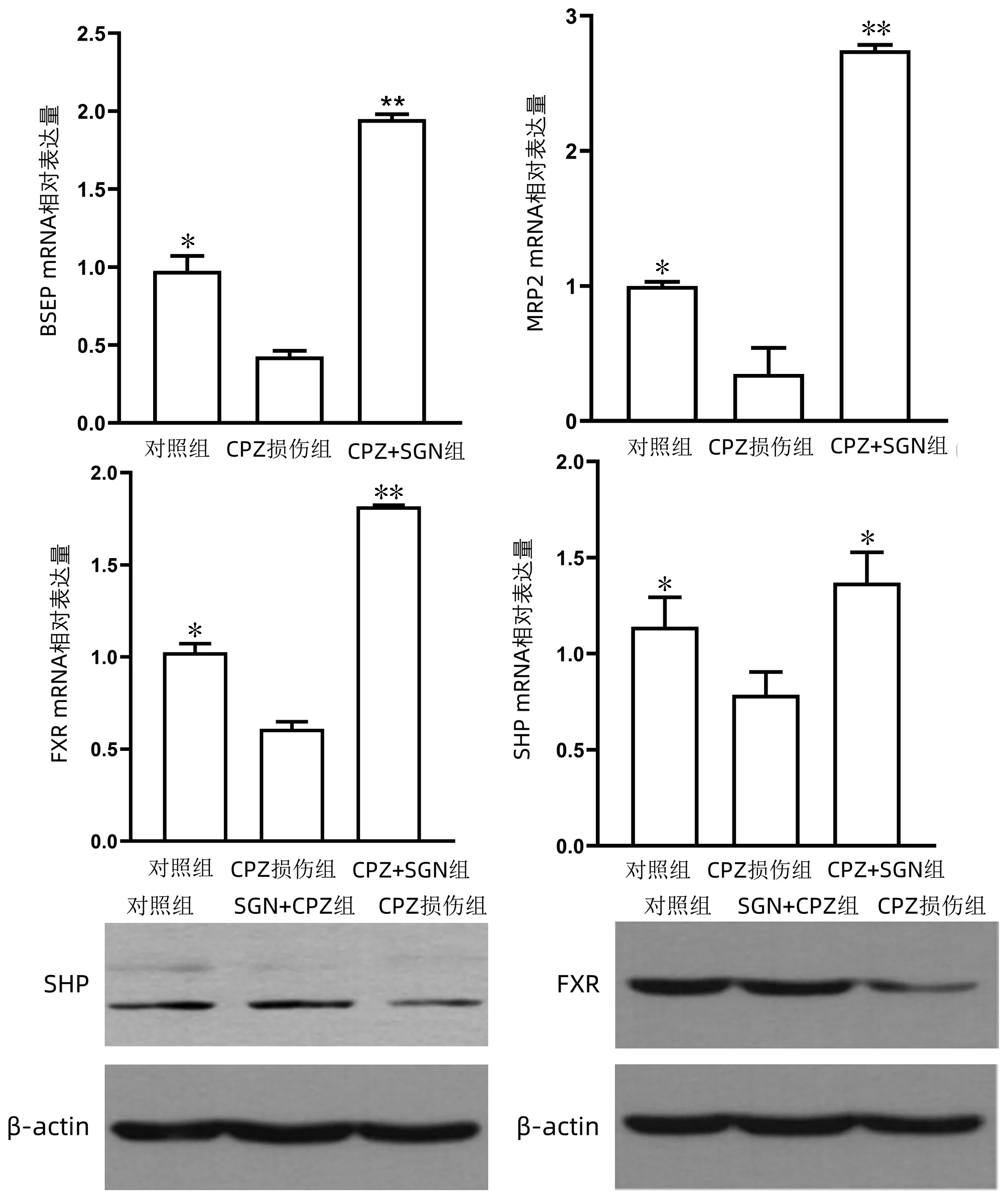
注:与CPZ损伤组比较,*P<0.01,**P<0.000 1。
有越来越多的证据表明,在胆汁淤积性肝病中,核受体FXR在啮齿动物和人类的肝脏损伤机制中发挥了重要作用[9]。FXR在生理性胆汁酸的合成、分泌和运输中起着重要作用[10]。这些过程的FXR调节缺陷可能导致胆汁淤积和随后的病理变化[11]。FXR通过酶调节胆汁酸合成的减少和其摄取。FXR作为胆汁酸代谢的重要调节剂,能够激活另一种核转录受体SHP,激活后的SHP使CYP7A1和CYP8B1的表达受到抑制,从而限制胆汁酸合成[12-13]。大量研究聚焦在FXR的激活对肝细胞中胆酸盐外排的影响:研究表明[14]肝脏FXR的激活能够增加胆酸盐外排型转运体小管膜转运蛋白BSEP和MRP2的表达,从而使得胆酸盐外排量增加,达到降低细胞内胆酸盐浓度、缓解胆汁淤积的目的。
在目前的研究中,笔者使用了分化的人HepG2和大鼠脱细胞支架构建组织工程肝,分析SGN对肝内胆汁淤积的影响,并对其引发机制进行了探讨,具体机制见图9。胆汁酸的稳态取决于肝细胞和肠细胞中的转运蛋白。肝细胞中的BSEP和MRP2将胆汁酸排入胆管,这步是决定胆汁流量的主要因素[15]。许多研究表明[16-18],BSEP是FXR的直接靶标,但一些发现表明,共激活子对于BSEP和MRP2基因的激活是必不可少的。其他转运蛋白基因,尤其是有机溶质转运体(OSTα/β),MRP2和多药耐药蛋白3(MDR3)也可以通过FXR直接激活。FXR主要通过SHP参与机体胆汁酸代谢调节。正常生理状态下,肝细胞胆汁酸的代谢主要通过BSEP、MRP2两种胆汁酸盐输出泵代谢,帮助肝细胞进行胆汁酸的代谢。在此次研究中,当用CPZ进行药物损伤时,CPZ组诱导了药物性胆汁淤积使得BSEP和MRP2这两种胆盐输出泵的内化内吞,更加加剧了胆汁酸盐细胞内蓄积。SGN可以通过激活FXR/SHP核受体,增加BSEP和MRP2的表达,减少了有毒胆汁酸盐在细胞内堆积,从而保护了细胞。也可能是SGN在胆汁淤积性DILI模型中发挥抗胆汁淤积作用的分子机制。
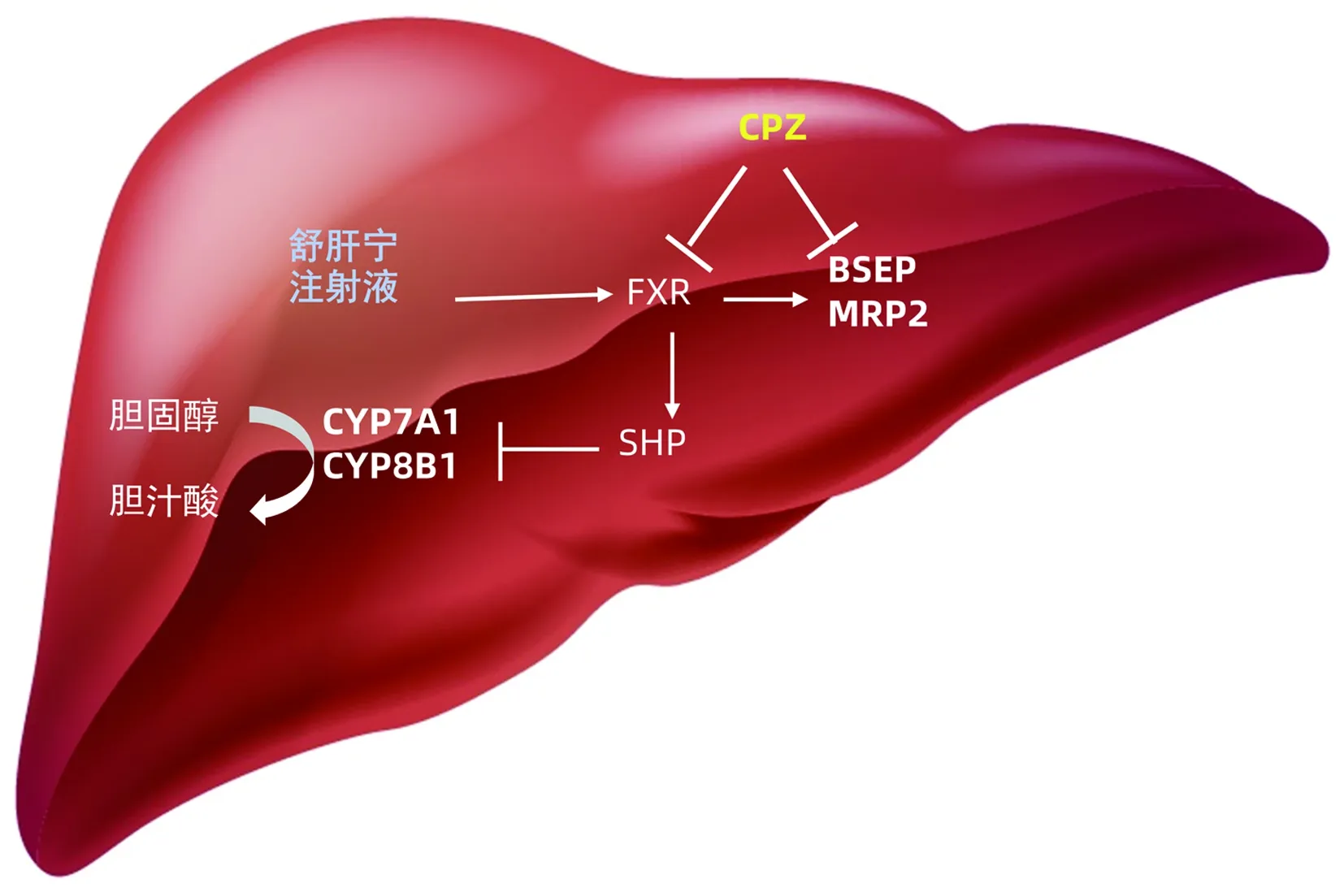
图9 舒肝宁保护机制的示意图
综上所述,本研究表明SGN有明显的抗胆汁淤积作用,其机制可能为SGN通过激活FXR/SHP核受体,促进了外排转运蛋白BSEP和MRP 2的表达上调同时抑制了CYP7A1和CYP8B1两种酶的分泌,最终降低肝内胆汁酸的淤积情况,改善了胆汁淤积的严重程度,有望为临床SGN的治疗提供新的思路。
伦理学声明:本研究方案于2020年6月5日经由北京佑安医院实验动物伦理委员会审批通过,批号:AEEI -2020 -076,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:黄龙负责撰写论文;吴桥负责课题设计,修改论文;陈煜、段钟平负责提供写作思路,指导撰写文章并最后定稿。

