富马酸丙酚替诺福韦对恩替卡韦经治后低病毒载量的慢性乙型肝炎患者的临床疗效
程海林,胡旭东,夏 冰,柏 涛,卢斯霞
武汉市金银潭医院 消化内科,武汉 430023
HBV感染是慢性乙型肝炎(CHB)、肝纤维化及肝细胞癌的重要病因。近年来,在长期接受规范的核苷(酸)类似物(NUC)治疗患者中,即使应用恩替卡韦(ETV)或富马酸替诺福韦酯等一线药物,部分患者血清中HBV DNA仍持续或间歇性低水平检测阳性(10~2000 IU/mL),却并未发现与明确耐NUC相关的HBV pol/RT突变,而长期低病毒血症状态对肝脏慢性纤维化及癌变均有潜在风险[1],本研究旨在探讨富马酸丙酚替诺福韦(TAF)对ETV治疗48周后仍处于低病毒血症状态的CHB患者的临床疗效及安全性。
1 资料与方法
1.1 研究对象 选取 2019 年3月—2020年10月在本院治疗的CHB患者160例。纳入标准:(1)符合CHB临床诊断标准;(2)ETV抗病毒治疗>48周;(3)HBV DNA定量10~2000 IU/mL;(4)耐药芯片检测未提示耐药位点;(5)自愿参加研究。排除标准:(1)TAF治疗禁忌证患者;(2)其他急、慢性病毒性肝炎(甲型、丙型、戊型、丁型肝炎及巨细胞、EB病毒性肝炎)、酒精性及非酒精性肝病、自身免疫性肝炎、肾病及HIV患者;(3)治疗依从性差患者。
1.2 分组及方法 根据患者意愿换药为TAF或继续ETV治疗,为减少选择偏差的影响,经倾向评分匹配(PSM)分组将本院治疗的160例CHB患者分成试验组(80例)及对照组(80例)。对照组继续口服ETV(批号:H20100129),0.5 mg/次,1次/d;试验组停用ETV,换用TAF(批号:H20180060)口服,25 mg/次,1 次/d。2组患者均治疗24周。
1.3 检测指标及使用仪器 治疗前后分别检测血常规,肝、肾功能,HBsAg,HBV DNA定量及肝瞬时弹性成像,记录PLT、ALT、AST、肾小球滤过率(eGFR)、HBeAg定量、HBV DNA定量及肝硬度值,并记录FIB-4值。FIB-4值计算公式:年龄(岁)× AST(U/L)/PLT(109/L)× ALT(U/L)1/2。采用Sysmex XS-800i全自动血液分析仪检测血常规,东芝TBA120全自动生化仪检测血生化,Fibroscan肝瞬时弹性检测仪检测肝硬度值,HBV DNA用实时荧光定量聚合酶链式反应系统检测(雅培试剂),检测下限为10 IU/mL。HBV血清学标记物采用HBsAg quantitative Elecsys (罗氏诊断,德国)检测,HBeAg>1.0 COI为阳性。
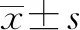
2 结果
2.1 一般资料 对照组男48例,女32例;体质量56.8~73.2 kg,平均63.5 kg;年龄25~48岁,平均35.82岁。试验组男47例,女33例;体质量53.9~75.8 kg,平均64.7 kg;年龄24~51岁,平均35.57岁。两组患者治疗前一般资料比较差异均无统计学意义 (P值均>0.05),具有可比性(表1)。
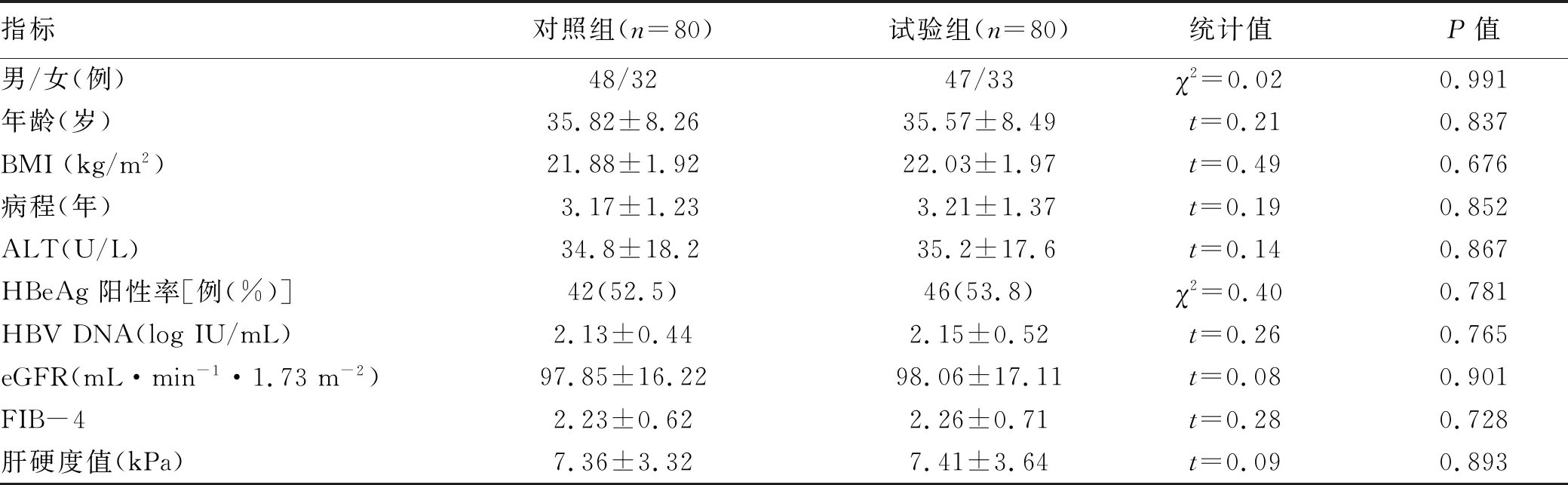
表1 2组患者治疗前一般资料比较
2.2 HBV DNA及 HBeAg转阴率比较 试验组HBV DNA转阴率及HBeAg转阴率与对照组相比较均明显升高,差异均有统计学意义(P值均<0.05)(表2)。

表2 2组患者治疗后HBeAg和HBV DNA转阴率比较
2.3 治疗前后 ALT、eGFR、FIB-4、肝硬度值水平变化情况比较 治疗后,试验组ALT、eGFR、FIB-4、肝硬度值较对照组有明显改善,差异均有统计学意义(P值均<0.05)(表3)。

表3 2组治疗后ALT、eGFR、FIB-4 和肝硬度值比较
2.4 安全性评价 试验组患者治疗后出现恶心3 例,腹胀2例,头晕1例,对照组出现腹胀3例,头晕2例,关节痛1例,失眠1例。治疗过程中不良反应发生率试验组 (7.50%)与对照组(8.75%)差异无统计学意义 (P>0.05)。
3 讨论
国内外目前对CHB的低病毒血症尚无统一的定义。2018年美国肝病学会(AASLD)指南[2]将低病毒血症定义为HBV DNA<2000 IU/mL但仍能被检测到的状态(最低检测下限为10 IU/mL)。近些年来,CHB患者虽然长期接受规范的NUC抗病毒治疗,但部分患者仍存在低病毒血症的问题,而大量研究[3-5]表明,长期的低病毒血症状态可能与肝纤维化进展甚至肝癌的发生有关。一项长期回顾性队列研究[6]表明,长期接受ETV单药治疗的CHB患者中,低病毒血症患者较持续病毒应答患者进展至肝硬化及发生肝癌的风险明显升高。因此,对于长期处于低病毒血症的CHB及时换用抗病毒效力更强,耐药屏障更高的抗病毒药物是非常必要的。但除AASLD以外的其他CHB管理指南尚未提出针对低病毒血症的管理策略,我国 2019 版指南[7]也未提及低病毒血症的管理建议。基于低病毒血症对CHB患者潜在的危害性,近年来对于ETV经治的低病毒血症采取了不同调整方案,如增加ETV的剂量、联合富马酸替诺福韦酯或聚乙二醇干扰素α(PEG-IFNα)[8-10]及换用TAF[6]治疗等。
TAF是一种新型的核苷类逆转录酶抑制剂,TAF是在替诺福韦的结构上填加酰胺键,使其不能在血液中水解,而是通过被动扩散及肝脏主动摄取进入原代肝细胞,继而被羧酸酯酶1水解为替诺福韦,发挥抗病毒作用[11]。因其半衰期长,肝脏靶向性强,血浆暴露量低,经血液循环进入肾小管的量也显著降低,因此应用TAF可大大减轻CHB患者的肾小管损害[12],一直是欧洲肝病学会和AASLD推荐的治疗CHB的一线药物[13-14]。
本研究对ETV治疗48周后低病毒血症的CHB患者更换TAF治疗发现,病毒载量转阴率(96.25%)比较理想,提示TAF可有效控制低病毒血症状态。本研究中HBeAg血清学转换率(34.78%)与对照组差异显著,且明显高于NUC治疗CHB患者HBeAg阴转率为20%的报道[9],考虑其原因可能与ETV经治后低HBeAg水平有关,真实原因有待进一步对比研究。
本研究中,试验组较对照组肝功能改善明显,FIB-4及肝硬度值也明显改善,提示病毒有效控制后,肝脏炎性反应及肝纤维化明显改善,因而能够有效阻止和延缓病情进展。试验组肾小球滤过率升高,可能与受损伤的肾小管在祛除损害因素后得到修复有关,提示TAF有更强的肾脏安全性,因此,对于ETV经治后仍伴有低病毒血症的CHB患者,尤其是合并肾功能不全的患者,更换为TAF继续抗病毒治疗可能为最佳选择。两组治疗过程中不良反应事件发生率无明显差异,安全性较好。
综上所述,TAF治疗低病毒血症的CHB患者,具有强效的抗病毒作用、较高的HBeAg阴转率以及较好的ALT复常率和良好的肾脏安全性,总体安全性良好,但和其他的NUC一样,不能有效清除cccDNA和整合的HBV DNA,HBsAg阴转率低,依然需要长期用药。TAF联合PEG-IFNα是否能够提高临床疗效尚有待进一步研究。
伦理学声明:本研究方案于2021年7月19日经由武汉市金银潭医院伦理委员会审批,批号:KY-2021-07,所纳入患者均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:程海林、胡旭东责研究设计,资料分析及论文撰写;夏冰、柏涛负责数据收集及统计分析;卢斯霞负责患者随访。

