叠氮化钠诱变燕麦M1代的主要性状分析
蔺豆豆, 赵桂琴, 柴继宽, 宫文龙, 苏玮娟, 张丽睿
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730000)
燕麦(Avenasativa)为禾本科燕麦属一年生草本植物,在世界范围内广泛栽培[1-2]。燕麦在我国种植历史悠久,但目前普遍存在品种单一、同质化严重等问题,无法满足生产发展对多样化品种的需求[3-5]。因此,通过各种手段创制新种质、加速品种选育迫在眉睫。
化学诱变是种质创新的有效途径之一[6]。相对于自然变异、人工杂交、基因工程等方法,化学诱变耗时较短、操作简单、成本较低且能产生较多突变类型,在种质创新及解决某些育种问题上具有独特作用[7-8]。常用的化学诱变剂主要有甲基磺酸乙酯(Ethyl methyl sulfonate,EMS)、叠氮化钠(Sodium azide,NaN3)和N-甲基-N-亚硝基脲(N-methyl-N-nitrosourea,MNU)等[9]。其中,NaN3是叠氮化物中最具代表性的化学诱变剂。NaN3处理能够产生大范围的点突变,且染色体畸变率较低,是一种高效、安全、价格低廉的化学诱变剂[10]。Spence于1965年首次报道了NaN3的诱变效应,此后,NaN3在动植物等多个领域中得到了广泛应用[11-12]。
NaN3处理会对植物种子胚造成不同程度的损伤,使得植物在诱变一代(M1)就发生广泛变异。半致死剂量被认为是诱导突变的最佳剂量[13],但由于化学诱变的不定向性,在半致死剂量处理下不一定能够获得目标突变体。董文科等[14]设置了6个EMS浓度和3个处理时间对多年生黑麦草进行诱变处理,并使用30%的PEG-6000溶液对M1代的所有单株进行抗旱性筛选,最终获得来自不同EMS处理的15株抗性植株,其中3个抗旱性较强的变异株也并不全部来自半致死剂量处理。同样,Colasuonno等人[15]在0.70%~0.85%范围内设置4个EMS浓度分别处理小麦种子,成功获得了2个稳定的类胡萝卜素突变体。但4个处理下M1代致死率均高于半致死剂量,其致死率高达76.4%~88.7%。Konzak[16]等发现,在其他条件相同的情况下,随着NaN3浓度由0.5 mM升至2.5 mM,大麦(Hordeumvulgare)叶绿素突变体出现的频率不断增加。NaN3处理显著抑制了小麦(Triticumaestivum) M1代的出苗率,随着其浓度由20 mg·L-1增至120 mg·L-1,M1代变异率不断增加,变异类型非常丰富[17]。由此可见,NaN3处理会使植物发生大幅度变异,不同剂量下出现的突变体类型及其频率也不尽相同,若要获得尽可能多的突变体,就不能仅仅局限于半致死剂量。
目前,国内有关NaN3诱变的研究主要集中在小麦、大麦、玉米(Zeamays)、水稻(Oryzasativa)等作物上[18-23],有关NaN3诱变燕麦的研究还未见报道,NaN3处理后燕麦M1代各农艺性状的变化情况也不得而知。鉴于此,本试验拟用NaN3处理燕麦种子,测定M1代的田间主要性状,分析各指标的变化情况,以期为构建燕麦NaN3突变体库提供理论依据和基础材料。
1 材料与方法
1.1 试验材料
供试燕麦品种为‘爱沃’(‘Everleaf’)和‘青永久709’(‘Qingyongjiu 709’),均由甘肃农业大学草业学院提供。
1.2 试验设计
1.2.1试验地概况 本试验在甘肃农业大学牧草试验站进行,该站位于兰州市西北部,地处黄土高原西端,海拔1 473.6 m,全年无霜期90 d~210 d;年均温11℃,年平均降水量为350~400 mm,主要集中在6—9月。土壤有机质含量8.80 g·kg-1、速效氮含量42.88 mg·kg-1、速效磷含量35.72 mg·kg-1、速效钾含量177.19 mg·kg-1、土壤pH值7.71。
1.2.2NaN3处理 试验设置4个NaN3浓度梯度(0,5,10,15 mM),每个浓度分别处理3个时间(1,2,3 h),共12个处理,3次重复,以0 mM下各时间处理作为相应的对照。每重复取200粒大小一致、籽粒饱满的燕麦种子放入玻璃杯中,加蒸馏水淹没种子,置于4℃冰箱,充分吸胀14 h。取出后室温放置4 h,沥干水分,加入100 mL磷酸缓冲液。之后依次加入0,1.0,1.5,2.0 mL的NaN3母液,使其浓度为0,5,10,15 mM。置于智能恒温培养振荡器中,在25℃,150 r·min-1条件分别震荡处理1,2,3 h。取下后倒出药液,流水冲洗2 h,沥干水分,置于4℃冰箱12 h后准备播种。
1.2.3M1代的种植 将各处理种子按照浓度梯度点播至大田,播前施足底肥,株距0.1 m,行距0.3 m,播深4~5 cm。分别于分蘖期、拔节期、开花期、灌浆期各灌水一次,在分蘖期后、拔节期前中耕除草一次。
1.3 测定指标及方法
各指标测定方法参考《燕麦种质资源描述规范和数据标准》[24]。
株高:灌浆期用卷尺测量植株从地面到茎尖的垂直距离。
旗叶长:灌浆期用厘米刻度尺测量旗叶叶尖至旗叶基部的距离。
旗叶宽:灌浆期用厘米刻度尺测量旗叶最宽部分的距离。
旗叶面积:0.73 (矫正系数)×旗叶长×旗叶宽[25]。
有效分蘖数:成熟期测定单株的有效分蘖数。
主穗粒数:计数单株的主穗粒数。
主穗粒重:待风干后分别对单株的主穗进行脱粒,用天平称取单株的主穗粒重。
生育期:出苗至成熟的历时天数。
1.4 数据分析
利用Microsoft Excel 2010和SPSS 25.0软件进行方差分析和显著性检验,利用Duncan氏新复极差法进行多重比较,使用Origin软件进行绘图。
2 结果与分析
2.1 NaN3处理对燕麦M1代植株生长发育的影响
2.1.1M1代生育期的变化情况 由表1可知,在不加NaN3的情况下,‘爱沃’的生育期为92 d,‘青永久709’的为80 d。经NaN3处理后,‘爱沃’和‘青永久709’的M1代分别在10 mM/2 h和10 mM/1 h处理下达到最长生育期,分别为95 d和83 d;‘爱沃’在5 mM/2 h,10 mM/1 h处理下生育期最短(89 d),‘青永久709’则在5 mM/3 h达到最短生育期(77 d)。生育期的变化主要是由出苗、抽穗和成熟期的不同引起的。NaN3处理后燕麦M1代的出苗期较对照延迟了2~5 d。与对照相比,在低浓度(5 mM)下,M1代进入分蘖期和拔节期的时间基本不变,而在中、高浓度下则会出现提前或延迟1~3 d的情况。除5 mM/3 h和10 mM/2 h处理(分别较对照提前1 d~2 d)外,‘爱沃’的M1代在大部分处理下抽穗期延迟2~3 d。‘青永久709’的M1代在10 mM/1 h和10 mM/3 h处理下抽穗期较对照延迟4 d。此外,燕麦M1代在中、高浓度NaN3处理下成熟期最长推迟了5 d。
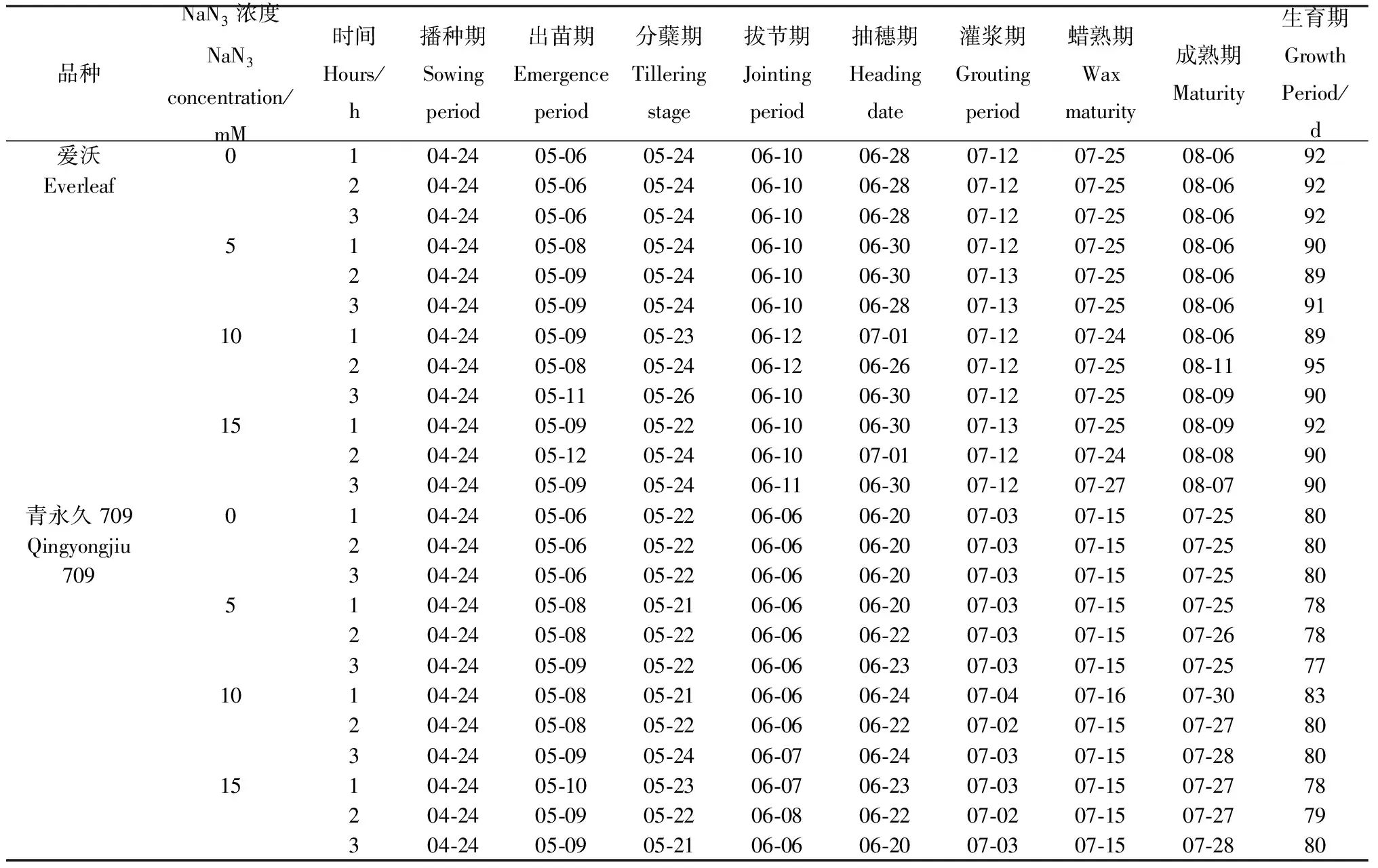
表1 NaN3诱变燕麦M1代生育期变化情况Table 1 Changes in the growth period of the M1 generation of oats induced by NaN3
2.1.2M1代植株性状的变化 对NaN3处理后燕麦M1代的各指标进行联合方差分析可知,NaN3浓度是引起各指标(主穗粒重除外)产生差异的最主要因素,其次为时间,品种的影响最小。品种×时间的交互作用对有效分蘖数无显著影响;除此之外,品种、浓度和时间及其两两交互和三者的互作均对株高、旗叶长、旗叶宽、旗叶面积、主穗粒数、主穗粒重均有极显著影响(P<0.01)。

表2 NaN3处理对燕麦M1代植株性状影响的方差分析Table 2 Variance analysis on agronomic traits of oat M1 under NaN3 treatment
经NaN3处理后,M1代的株高均低于相应对照,且随NaN3浓度的升高、处理时间的延长降幅逐渐增大。但旗叶长和旗叶宽的变化有所不同。高浓度NaN3处理下‘爱沃’和‘青永久709’的M1代旗叶长分别下降了9.84%和7.06%,旗叶宽平均增幅分别为2.23%和15.07%。M1代旗叶面积的变化有所不同,‘青永久709’ 的M1代旗叶面积总体大于对照且在15 mM/2 h处理下达到最大(42.95 cm2);‘爱沃’的M1代旗叶面积在低、中浓度下呈增加趋势,但在高浓度处理却较对照下降了7.23%。NaN3处理使得‘青永久709’的M1代有效分蘖数较对照明显增加,低浓度处理下增幅即达30.05%;而‘爱沃’的仅在10 mM/1 h和10 mM/2 h处理下有所增加(分别为8.33%和14.81%),其余处理下均低于对照。主穗粒数随处理浓度的增加和时间的延长总体呈下降趋势,但主穗粒重的变化则有所不同。‘爱沃’的M1代主穗粒重高于对照(低浓度1 h,2 h除外),在10 mM/1 h处理下增幅达119.05%,即使在15 mM/3 h处理下仍较对照增加了3.57%。‘青永久709’的M1代主穗粒重在高浓度(15 mM)下较对照平均降低了26.38%。
通过计算不同NaN3处理下M1代各指标的变异系数可知(表3),除‘爱沃’的有效分蘖数以外,其余指标的变异程度总体随NaN3浓度的升高、处理时间的延长而逐渐加大;其中主穗粒重的变幅最大,最高CV值分别为87.92%(‘爱沃’)和90.80%(‘青永久709’);而旗叶长和旗叶宽的变幅相对较小,变幅最小的是株高,‘爱沃’和‘青永久709’的M1代株高的最大CV值分别为6.39%和7.62%。另外,同一指标在两品种间的变化情况各不相同。尽管两品种的对照在各指标上的变化较小(CV<14%),但NaN3处理后两品种燕麦M1代的各指标均发生了明显变化。‘爱沃’的M1代旗叶宽(CV:7.80%~30.72%)和有效分蘖数(CV:8.33%~80.28%)的变幅大于‘青永久709’(CV:7.16%~23.34%和7.33%~58.79%)。除此之外,其余指标的变化幅度均为‘青永久709’大于‘爱沃’。
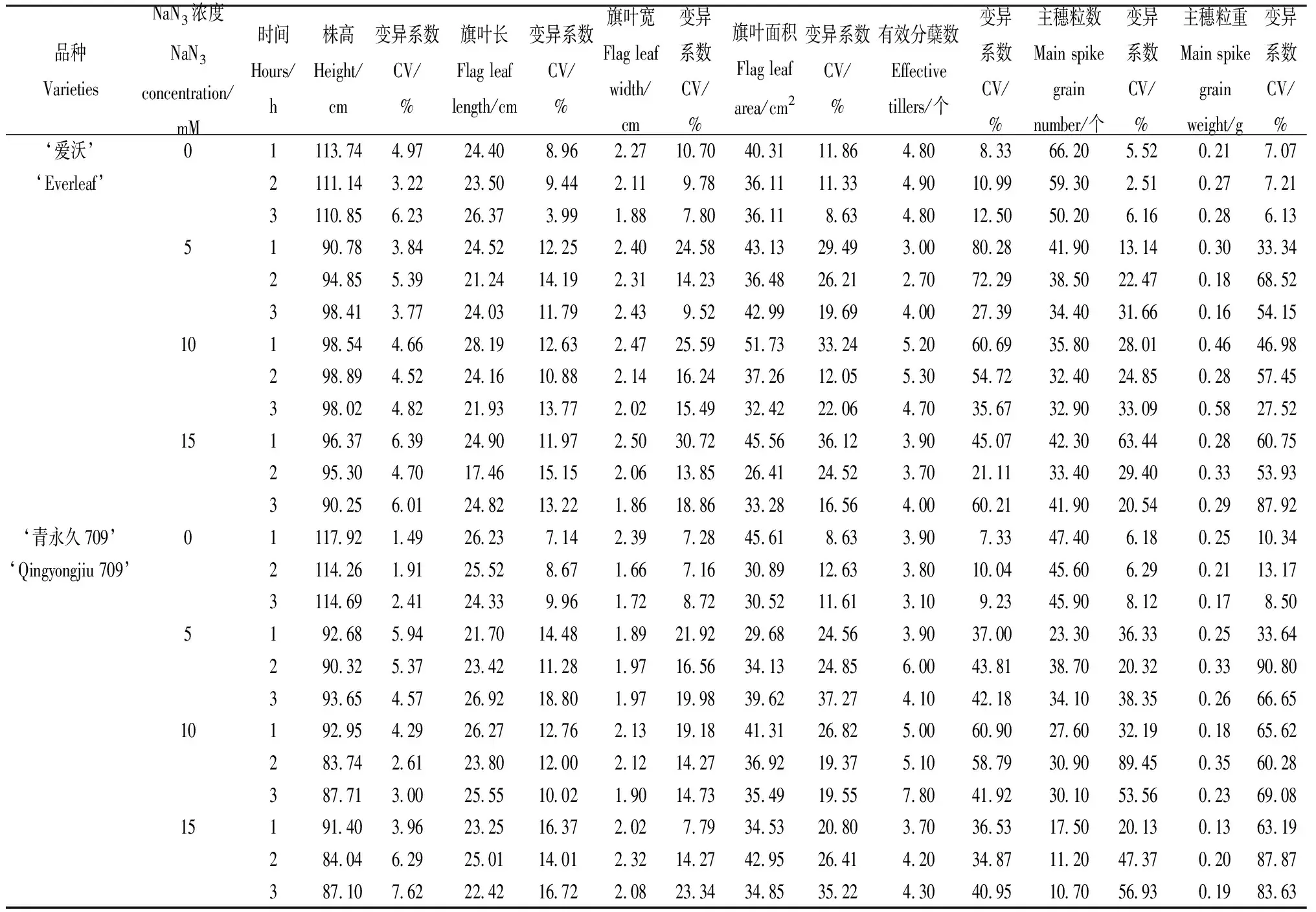
表3 不同NaN3处理下燕麦M1代各指标的平均值及变异系数Table 3 Average value and coefficient of variation of each index of oat M1 generation under different NaN3treatments
2.2 不同NaN3处理下燕麦M1代植株各指标间的主成分分析(Principal component analysis,PCA)
基于株高等7个性状指标,对9个不同NaN3处理组合下燕麦的M1代植株进行PCA分析(图1)。基于PC1可将M1代植株划分为彼此独立的两大类群,即对照所在的A类群(A-1和A-2)和经NaN3处理后M1代群体所在的B类群(B-1和B-2)。虽然PC2并未将两大类群进一步划分,但两品种及其M1群体还是分别位于4个不同的亚群中。其中,‘爱沃’对照所在的A-1亚群与‘青永久709’对照所在的A-2亚群彼此分离、互不影响;而B-1和B-2两个亚群不能完全独立。但相较于B-1亚群,B-2亚群表现出更大的离散程度。说明‘青永久709’的M1代群体在7个指标上的差异更明显,个体间的变化程度更大。

图1 燕麦M1代性状的PCA分析Fig.1 PCA analysis of oats M1 traits注:A-1表示‘爱沃’对照;A-2表示‘青永久709’对照;B-1表示‘爱沃’不同处理;B-2表示‘青永久709’不同处理Note:A-1 indicate ‘Everleaf’ control;A-2 indicate ‘Qingyongjiu 709’ control;B-1 indicate ‘Everleaf’ different treatments;B-2 indicate ‘Qingyongjiu 709’ different treatments
3 讨论
NaN3是一种具有诱变作用的无机盐,在酸性环境下,NaN3会产生HN3分子,HN3进入细胞会抑制细胞的呼吸作用以及ATP的形成[26],造成DNA分子发生碱基替换,诱发点突变[27]。经NaN3处理后,燕麦M1代植株的生长发育受到显著影响,出苗期、抽穗期以及成熟期均较对照明显延后。有研究报道,经NaN3处理后的小麦种子在大田播种后出苗较正常种子推迟4~5 d,麦苗明显细弱,生长缓慢[28]。这可是由于NaN3处理使得植物细胞供能受到抑制,从而影响了幼苗生长[29]。
叶片是植物进行光合作用的主要器官,叶片大小的变化反映了植物在光合能力最大化与逆境适应间的权衡[30]。在本研究中,NaN3处理后燕麦M1代植株的旗叶长较对照下降,旗叶宽却较对照增加,导致旗叶面积发生了变化,进而影响了光合产物的积累。这与陈灿[30]在水稻上的研究结果一致。但与之不同的是,陈灿的研究结果表明化学诱变剂对水稻的生长表现出“抑高促蘖”的效应,即抑制了株高而促进了分蘖。但本研究中,NaN3处理后‘青永久709’的M1代株高下降,有效分蘖增加,而‘爱沃’在株高下降的同时有效分蘖数也大多低于相应对照,原因可能是‘爱沃’旗叶面积下降,降低了光合产物的积累[31-32]。有研究表明,NaN3对植物的影响与逆境相似,会对植物体内赤霉素、生长素等相关激素的合成与分解产生影响[26],从而调控植物的株高及分蘖[33]。分蘖是谷类作物最重要的农艺性状之一,对单株小穗数或穗粒数起决定性作用[34]。经NaN3处理后燕麦M1代植株的主穗粒数较对照有所减少,但主穗粒重增加。而在李卫华[35]的研究中,小麦M1代的分蘖数随诱变剂浓度的升高表现出“先升后降”的变化趋势,主穗粒数和主穗粒重均明显下降。原因可能是所用化学诱变剂不同,对植物造成的效应也有所不同;另外,不同物种对诱变剂的响应也不尽相同。
变异系数可以反映植物某一指标的变异程度,在一定程度上可以说明该指标的遗传变异水平[36]。在本研究中,各处理下M1代的株高和旗叶长的变异系数较小,而有效分蘖数、旗叶面积、主穗粒数和主穗粒重的变异系数较大,其中主穗粒重的变异系数最大(‘爱沃’的为87.92%;‘青永久709’的为98.27%),这与张容[34]在小麦上的研究结果一致。M1代植株的旗叶宽以及旗叶面积也发生了不同程度的变化,除旗叶宽和有效分蘖数外,其余各指标的变幅均为‘青永久709’大于‘爱沃’。表明不同基因型对同一化学诱变剂的敏感性不同[37]。基于7个指标的PCA分析,将供试材料划分为4个亚群,其中M1代所在的B-1和B-2两个亚群并不能完全独立,体现了NaN3处理后两品种某些指标变化的一致性。而变异系数则体现了不同指标对NaN3的反应程度。另外,本研究结果显示PC1与PC2之和为31.4%,相对较小。说明在前两个主成分下,7个指标并不能充分解释M1代个体间差异。这可能是由于化学诱变剂对植物产生的诱变效应是随机的,有的变异在M1代只是暂时的生理失调;NaN3处理还可能诱发燕麦产生其他变异,而这类变异在M1代尚未表现出来[38]。总体而言,‘青永久709’的M1代个体间差异更大,可能更有利于后代突变体的筛选。
随着化学诱变剂浓度的增加以及诱变时间的延长,诱变剂的渗透程度逐渐加大,对植物的效应也随之加剧[39]。M1代各性状的变幅总体随NaN3浓度的升高及处理时间的延长而增大。NaN3浓度越高,后代性状的变化幅度越大,突变类型可能越多。有研究表明,在一定浓度范围内,植物抵御NaN3胁迫的能力会随其浓度升高而逐渐增加,但浓度过高又会打破机体的代谢平衡,毒害作用加剧,死亡率过高,导致诱变后代群体数量减小,不利于突变体的筛选[40]。另外,NaN3处理下各指标的变化幅度明显不同,如‘爱沃’的M1代有效分蘖数在低浓度、短时间(5 mM/1 h)内变异系数就高达80.28%。因此,在何种处理下能获得最大的变异群体,也因具体材料而异。
4 结论
NaN3处理显著影响了燕麦M1代植株的生长,使其生育期推迟、株高降低,有效分蘖数、旗叶面积、主穗粒数和主穗粒重均发生了显著变化,且随NaN3浓度的升高和处理时间的延长,变幅逐渐增大。相较于‘爱沃’,‘青永久709’对NaN3处理反应更敏感,其M1代各指标的变幅更大。

