日本结缕草ZjHY5的克隆、亚细胞定位及转录自激活检测
马 媛, 杨卓雄, 董 笛, 李舒文, 晁跃辉, 许立新
(北京林业大学草业与草原学院, 北京 100083)
光作为重要环境因子之一通过光受体显著的影响植物种子萌发、幼苗脱黄化、器官发育、开花和种子发育等发育过程,植物的生长和繁殖取决于植物光合作用所获得的能量[1]。光质、光强以及光照时间的差异都能对植物的光形态建成造成影响[2]。为了感知环境中的光刺激,植物发展出了复杂的分子调控网络。不同的光感受器可以通过对核心信号网络的调节,进一步协调特定的激素和代谢信号通路来调节植物的生长和发育[3]。植物萌发过程中,幼苗的子叶封闭,抑制根的生长,并增强下胚轴的伸长来推动茎分生组织向上生长,从而突破土壤表层,引发光形态建成及暗适应(Dark-adapted)向光适应(Light-adapted)的转变[4]。植物在生命周期中经历光环境的转变时(即植物由暗适应向光适应的转变过程中),光传感网络中的转录因子在下游转录反应中起着重要作用[5]。光感受器可接受光环境的转变信号,并激活bZIP,bHLH,MYB,Zinc-finger,GATA等多种中介转录因子。这些中介转录因子与光响应元件(LREs,Light responsive elements)结合调节转录[6]。拟南芥(Arabidopsisthaliana)中碱性亮氨酸拉链(bZIP)转录因子家族基因LONGHYPOCOTYL5(HY5)在光诱导基因表达中起中心调控因子的作用[7]。拟南芥hy5突变体在光下不能进行从暗适应到光适应的过渡[8]。从暗适应过渡到光适应的一个普遍特征是某些器官(如下胚轴)的细胞扩张受到抑制,而另一些器官的细胞扩张增加,以及茎和根的分生组织进行持续的细胞分裂而开始生长[5]。拟南芥hy5突变体失去了对下胚轴伸长的抑制,呈现出典型的暗适应生长模式,这表明HY5基因在植物光响应上起到关键作用[8]。HY5可以通过调控下游基因的表达来协调光信号及特定基因表达,以响应光信号传导,从而正向调控植物的光形态建成过程[8]。相较于野生型,hy5突变苗在远红光和UV-B光下,下胚轴长度有所增加,同时,HY5也可促进光敏色素、隐色素和UV-B光受体下游的光形态发生[9]。
此外,HY5也是植物生长发育的重要调控因子,它参与细胞伸长、细胞增殖、叶绿体发育、色素积累和营养物质同化等多项发育过程[10]。近年来,HY5在激素、营养、萜烯合成、防御和温度反应等信号级联中的作用也逐渐被揭示[6]。
日本结缕草(Zoysiajaponica)主要生长在中国、韩国、日本等东亚国家的温暖和过渡气候的地区,是观赏草坪及运动场草坪中最广泛使用的多年生暖季型草坪草之一。结缕草耐践踏、弹性良好、再生力强、病虫害少且只需较少的维护投入[11-12]。但是,北方地区的日本结缕草生长季节短,绿期短,这成为结缕草利用的主要限制因素[13]。本研究对日本结缕草ZjHY5基因生物信息、亚细胞定位及自激活检测的研究,可为后续日本结缕草响应光刺激的基础调控网络研究奠定基础。
1 材料与方法
1.1 试验材料
试验所用日本结缕草购自Hancock公司,种植于北京林业大学草坪研究所人工气候箱内,光周期为14/10 h(日/夜),温度为26℃,湿度为60%。大肠杆菌感受态DH5α,DNA Maker DL2000PlusⅡ购自北京全式金公司。无缝连接酶购自碧云天生物公司。GoldStar Best MasterMix从北京康为世纪生物公司购买。pMD18-T克隆载体,反转录试剂盒、限制性内切酶NcoI、限制性内切酶EcoRⅠ、酵母缺素培养基、酵母转化试剂盒、PrimeSTAR MAX Premix、金担子素(Aureobasidin A)和X-α-Gal等均购自Takara公司。RNA提取试剂盒、纯化试剂盒和质粒DNA提取试剂盒均从OMEGA公司购买。酵母菌株Y2HGold、酵母诱饵表达载体pGBKT7为本课题组保存。其它常规试剂均为国产分析纯化。引物合成由睿博生物技术有限公司完成。
1.2 试验方法
1.2.1引物设计 根据本实验室测得的日本结缕草转录组数据,应用Primer Premier 5软件设计ZjHY5-F和ZjHY5-R引物,用于扩增ZjHY5基因的全长序列。使用通用引物M13-F和M13-R来完成pMD-18T载体检测。依据ZjHY5全长序列测序结果和载体pGBKT7序列设计pGBKT7-ZjHY5-F和pGBKT7-ZjHY5-R载体连接引物,用于构建酵母表达载体,并应用通用引物T7和3-BD来进行检测。Y3-ZjHY5-F(GGGGACTCTTGACCATGGTAGCTTTTCTTCCCCCTTGCGG)及Y3-ZJHY5-R(ACACGCGTACTAGTCAGATC-GCTCTTGGTGAAGTGGTGCT)用于亚细胞定位载体的构建。应用通用引物Y3-F(GGGGACTCTTGACCATGGTA)及Y3-R(ACACGCGTACTAGTCAGATC)进行检测。
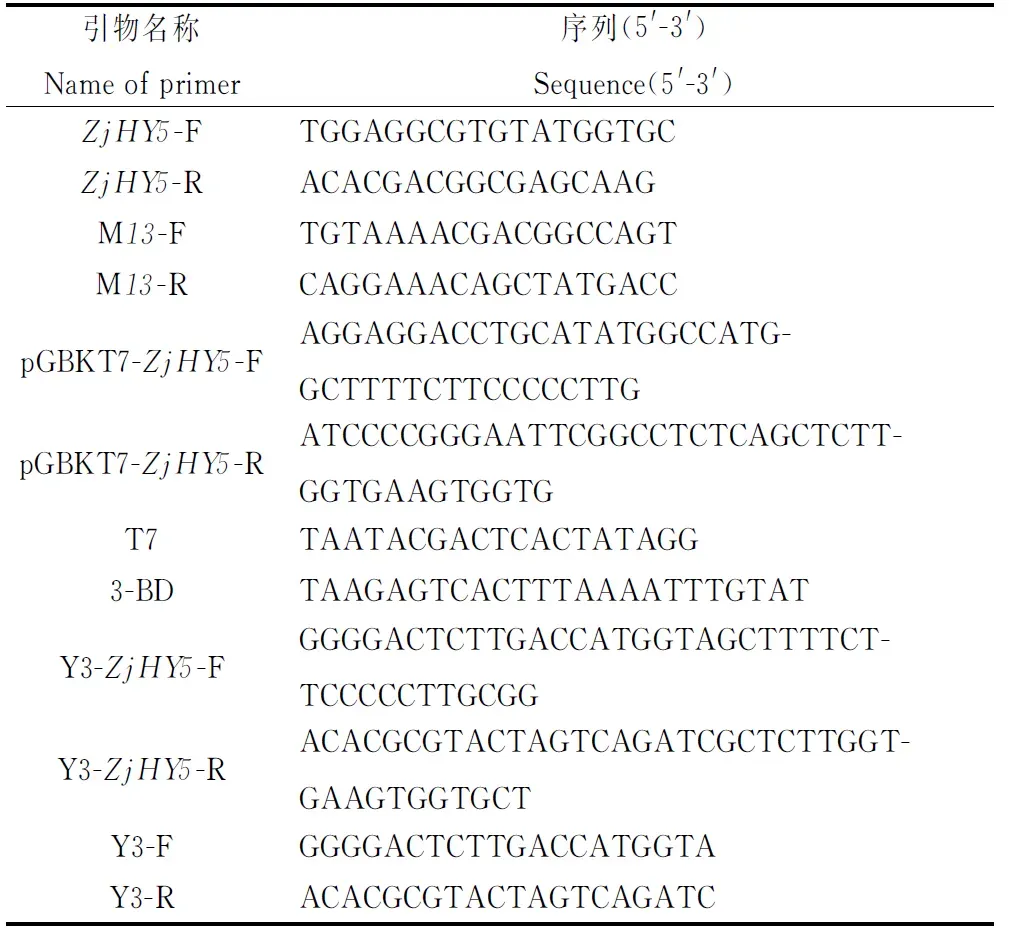
表1 引物序列Table 1 Sequence of primers
1.2.2ZjHY5基因克隆 选取生长12周新鲜健康的日本结缕草株系,将其叶片摘下并剪碎放入研钵中,加入液氮进行研磨。按照RNA提取试剂盒说明书来提取RNA。对日本结缕草叶片总RNA进行反转录,用合成的cDNA作为模板,以ZjHY5-F和ZjHY5-R为引物,用2×GoldStar Taq MasterMix扩增ZjHY5基因片段。PCR反应程序:95℃预变性10 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,30个循环;72℃5 min;12℃保温。PCR产物通过琼脂糖凝胶电泳进行检测,将符合长度预期的片段进行纯化,纯化后的产物与pMD-18T载体连接,然后转化大肠杆菌DH5α感受态细胞,于37℃下进行卡那霉素抗性筛选培养,挑取菌落,应用通用引物M13-F及M13-R进行PCR检测,程序为:95℃预变性10 min;95℃变性30 s,55℃退火30 s,72℃延伸60 s,30个循环;72℃5 min;12℃保温。将检测长度符合大肠杆菌菌落送至生物技术公司进行测序,将测序结果进行比对确保扩增正确的目的基因。
1.2.3生物信息学分析 ZjHY5蛋白保守结构域通过NCBI网站(https://www.ncbi.nlm.nih.gov/)来进行分析。通过SOPMA (https://prabi.ibcp.fr/htm/site/web/home)对ZjHY5蛋白一级、二级、三级结构进行预测,利用ExPASy数据库(http://expasy.org/)对ZjHY5蛋白各级结构的特性进行分析。Cell-PLoc 2.0网站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)用于预测ZjHY5蛋白在细胞内的定位情况。目的基因ZjHY5信号肽的预测用SignalP4.1Server (http://www.cbs.dtu.dk/services/SignalP)来完成。
1.2.4pGBKT7-ZjHY5诱饵表达载体构建 将测序结果符合预期的大肠杆菌菌液进行质粒提取并以其为模板,使用引物pGBKT7-ZjHY5-F和pGBKT7-ZjHY5-R进行PCR扩增来用于诱饵表达载体的构建。利用限制性内切酶NcoⅠ将载体pGBKT7在37℃条件下酶切处理15 min,通过In-Fusion连接酶将纯化后的扩增产物和酶切产物在50℃下连接15 min。然后将其转化至大肠杆菌DH5α,转化后涂在LB培养基上进行卡那霉素筛选培养。挑菌后进行菌落PCR检测,经过凝胶电泳检测选取片段大小合适的大肠杆菌菌液送至生物公司测序验证。
1.2.5Y2HGold酵母感受态细胞转化及自激活作用检测 将符合测序结果的大肠杆菌菌液大量富集并提取质粒,得到重组质粒pGBKT7-ZjHY5。应用醋酸锂法制备Y2HGold感受态酵母细胞,并将重组质粒pGBKT7-ZjHY5转入其中[12]。将转化得到的酵母菌均匀地涂在SD/-Trp培养基上培养,2~3 d后将培养基上的菌落进行PCR扩增以检验酵母重组质粒pGBKT7-ZjHY5是否成功转化至Y2HGold细胞。将上述成功转化的菌液分别稀释10倍、100倍、1 000倍后接种在缺失培养基SD/-Trp,SD/-Trp/X-α-Gal和SD/-Trp/X-α-Gal/AbA中,于30℃下倒置培养3~4 d后,观察其生长状态并记录[12]。
1.2.6亚细胞定位 使用引物Y3-ZjHY5-F和Y3-ZjHY5-R进行PCR扩增,并应用EcoR Ⅰ对Y3载体进行单酶切,用于亚细胞定位载体的构建,并将其转化到制备好的EHA105农杆菌感受态中,准备生长健康的本生烟草(Nicotianatabacum)叶片并完成注射,然后将其置于黑暗条件下培养2 d。通过使用共聚焦显微镜(Leica,SP-8)来观察信号在细胞中的分布情况。
2 结果与分析
2.1 ZjHY5的克隆及保守结构域分析
应用日本结缕草cDNA为模板,进行PCR扩增,ZjHY5基因开放阅读框为711 bp,编码236个氨基酸残基(图1,图2)。保守结构域分析显示,ZjHY5蛋白属于bZIP超家族(图3)。ZjHY5内存在bZIP-HY5-like保守结构域。在调节一系列不同细胞的过程中,bZIP因子在同源及异源二聚体的网络中发挥作用。bZIP结构基序包含一个基本区域和一个亮氨酸拉链。α-螺旋和亮氨酸残基分开的7个氨基酸,与一个平行的亮氨酸拉链结构域形成稳定二聚体。
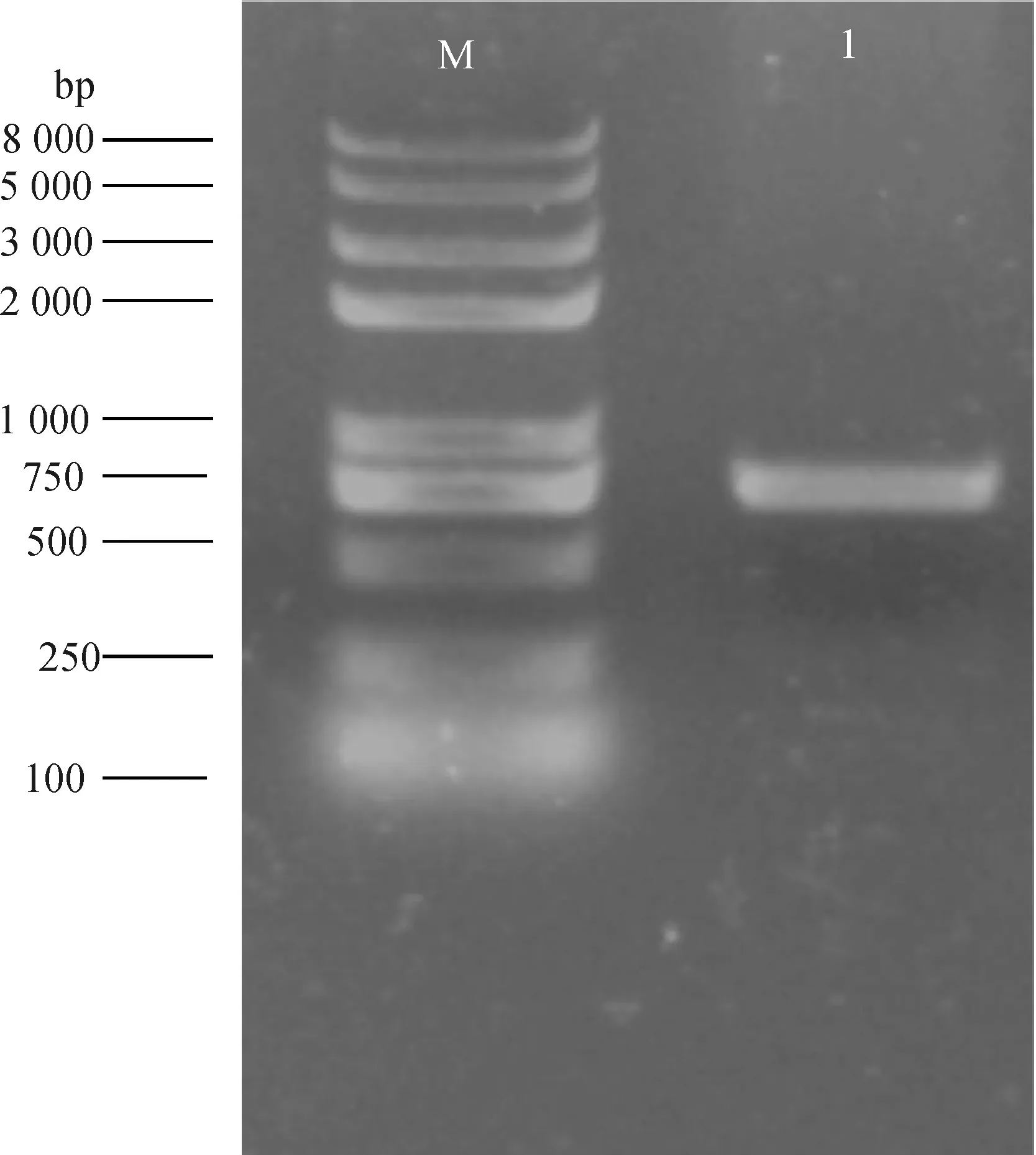
图1 日本结缕草ZjHY5基因的克隆Fig.1 Cloning of ZjHY5 gene from Zoysia japonica

图2 日本结缕草ZjHY5 基因的cDNA序列及蛋白质序列Fig.2 cDNA sequence and protein sequence of ZjHY5 gene from Zoysia japonica

图3 日本结缕草ZjHY5 的保守结构域Fig.3 The conserved domain of ZjHY5 from Zoysia japonica
2.2 ZjHY5蛋白特性
ZjHY5蛋白由236个氨基酸构成,分子式为C1076H1771N345O368S3,蛋白分子质量为25.525 1 kD,理论等电点为8.89。其负电荷残基数量为37,正电荷残基数量为40;不稳定指数为 55.00,经预测,其蛋白性质不稳定。二级(图4)及三级结构预测(图5)结果显示,ZjHY5蛋白主要由α螺旋及无规则卷曲构成,其各占二级结构总比例的47.46%和41.53%,其余结构(包括延伸链及β转角)仅占总比例的11.01%。信号肽预测(图6)结果显示,ZjHY5蛋白有信号肽的概率为1.327%。利用MEGA 5.0 软件对ZjHY5与HY5同源蛋白进行比对并绘制系统进化树,进化树显示日本结缕草中的HY5蛋白与漆姑草(Saginajaponica)及苜蓿(Medicagosativa)中HY5蛋白氨基酸相似度最高(图7)。
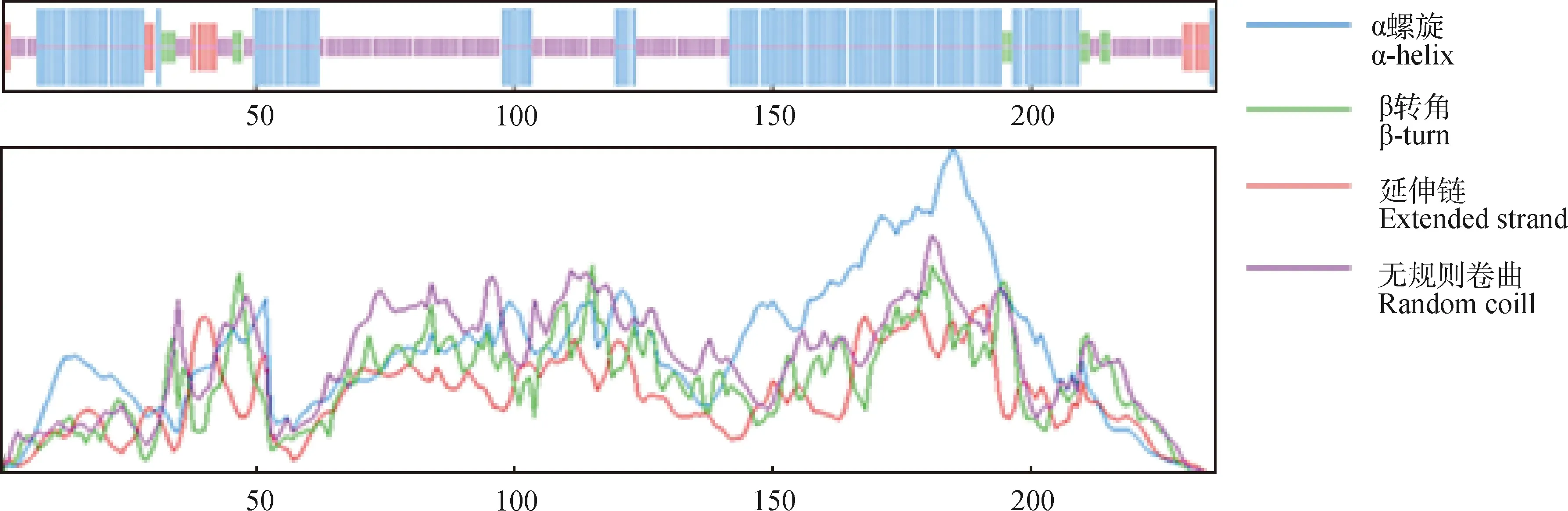
图4 日本结缕草ZjHY5蛋白的二级结构预测Fig.4 Secondary structure prediction of ZjHY5 protein from Zoysia japonica

图5 日本结缕草ZjHY5蛋白的三级结构预测Fig.5 Tertiary structure prediction of ZjHY5 protein from Zoysia japonica
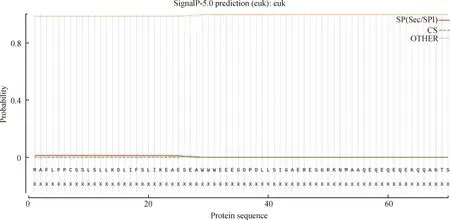
图6 日本结缕草ZjHY5信号肽预测Fig.6 Prediction of ZjHY5 signal peptide from Zoysia japonica

图7 日本结缕草ZjHY5蛋白的遗传进化树分析Fig.7 Phylogenetic analysis of ZjHY5 protein from Zoysia japonica注:DlHY5表示QRV61374.1 龙眼(Dimocarpus longan)HY5-like,MdHY5表示NP 001280752.1 苹果(Malus domestica)HY5,BrHY5表示XP 009121971.1 芜菁(Brassica rapa)HY5-like,GrHY5表示AIC64080.1 滇龙胆草(Gentiana rigescenss)HY5,SlHY5表示NP 001234820.1 番茄(Solanum lycopersicum)HY5,AtHY5表示BAA21327.1 拟南芥(Arabidopsis thaliana)HY5,VvHY5表示AGX85877.1 葡萄(Vitis vinifera)HY5,MtHY5表示XP_003622910.1 苜蓿(Medicago truncatula)HY5-like,CqHY5表示QEM23328.1 南漆姑草(Colobanthus quitensis)HY5-likeNote:DlHY5 stands for QRV61374.1 Dimocarpus longan HY5-like,MdHY5 stands for NP 001280752.1 Malus domestica HY5,BrHY5 stands for XP 009121971.1 Brassica rapa HY5-like,GrHY5 stands for AIC64080.1 Gentiana rigescenss HY5,SlHY5 stands for NP 001234820.1 Solanum lycopersicum HY5,AtHY5 stands for BAA21327.1 Arabidopsis thaliana HY5,VvHY5 stands for AGX85877.1 Vitis vinifera HY5,MtHY5 stands for XP_003622910.1 Medicago truncatula HY5-like,CqHY5 stands for QEM23328.1 Colobanthus quitensis HY5-like
2.3 亚细胞定位
亚细胞定位预测结果显示ZjHY5蛋白定位于细胞核中,为了进一步验证ZjHY5在细胞中的定位情况,进行烟草的亚细胞定位试验。将成功转化35S-ZjHY5-YFP以及35S-YFP载体的农杆菌进行烟草注射,并在共聚焦显微镜下观察荧光蛋白分布情况,预测结果显示,ZjHY5蛋白定位于细胞核(图8A,图8B,图8C)。
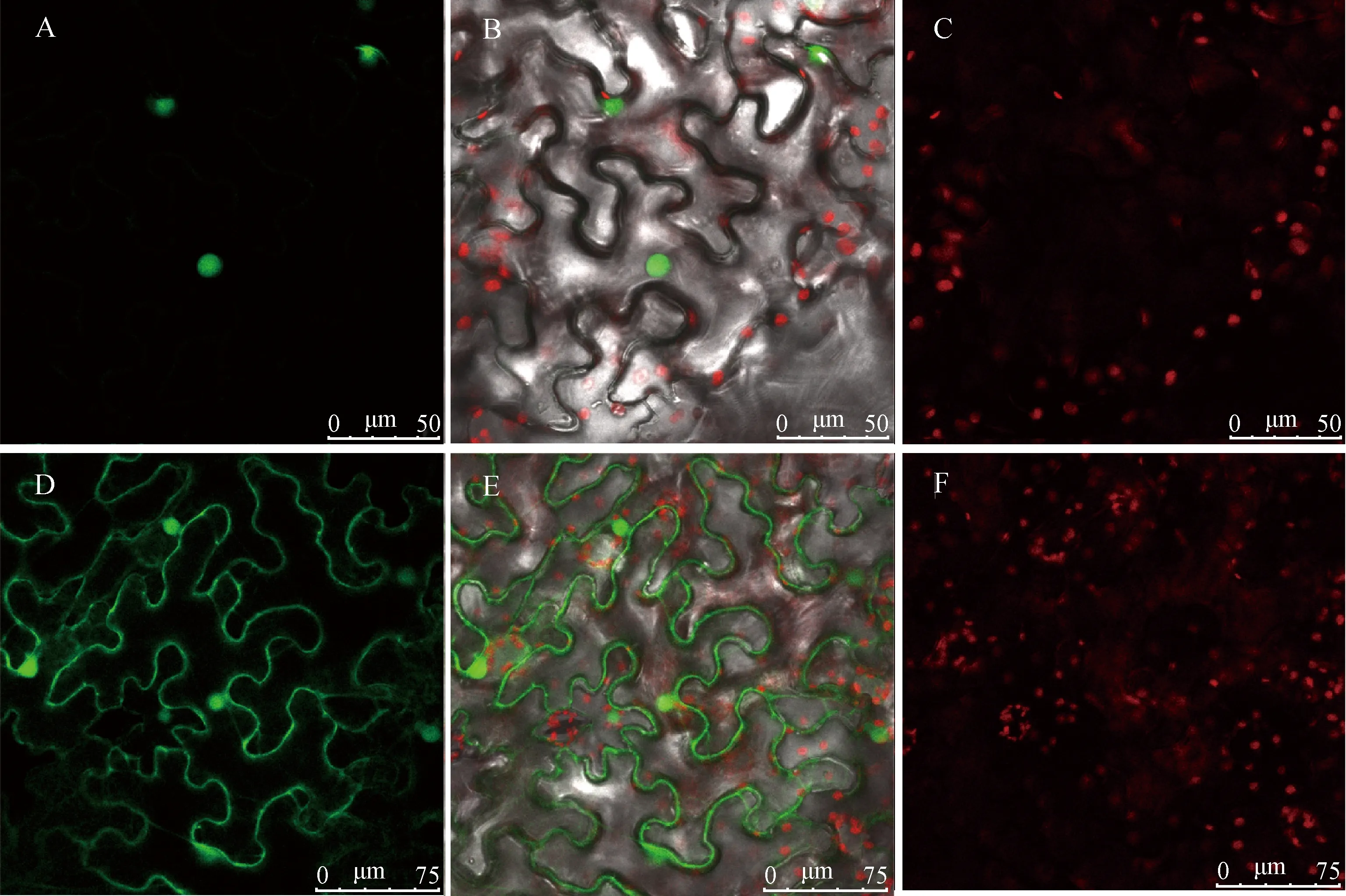
图8 ZjHY5亚细胞定位Fig.8 Subcellular localization of ZjHY5注:A,D为激发光下35S-ZjHY5-YFP;B,E为融合场;C,F为叶绿体自发荧光Note:A,D stand for ultraviolet field 35S-ZjHY5-YFP fluorescence;B,E stand for merged;C,F stand for chloroplast autofluorescence
2.4 酵母自激活检测
将成功转化pGBKT7-ZjHY5诱饵表达载体的酵母菌株经过稀释后,涂布于3种缺陷固体培养基SD/-Trp,SD/-Trp/X-a-Gal,SD/-Trp/X-a-Gal/AbA上培养2~3 d,并对其生长情况进行观察。结果表明,SD/-Trp单缺培养基有酵母菌落正常生长,SD/-Trp/X-a-Gal培养基上有酵母菌落正常生长但没有显示蓝色,转入pGBKT7-ZjHY5的酵母菌株在SD/-Trp/X-a-Gal/AbA培养基上未见生长且无颜色变化(图9)。因此构建成功的pGBKT7-ZjHY5诱饵表达载体不能激活酵母菌株营养缺陷型报告基因的表达,可用于后续酵母双杂交系统进行的蛋白筛选。

图9 pGBKT7-ZjHY5酵母转化转录自激活检测Fig.9 Autonomous transcriptional activation of PGBKT7-ZjHY5
3 讨论
ZjHY5基因属于bZIP超家族中的一员。bZIP超家族是最大、最保守的转录因子家族之一,其广泛分布于各个真核生物基因组中并参与光形态建成和光信号传导,种子成熟及种子萌发等生物学过程[14]。ZjHY5蛋白二级结构的主要形式为α螺旋和无规则卷曲,两者共约占二级结构总比例的90%。信号肽预测发现,ZjHY5蛋白有信号肽的概率为1.327%,预测结果显示ZjHY5蛋白无信号肽。进化树构建结果显示,ZjHY5蛋白与漆姑草(Saginajaponica)及苜蓿(Medicagosativa)中HY5蛋白的亲缘关系最近。HY5转录因子已经被证实是光形态建成的正向调控因子,参与植物光、激素及应激信号的应激反应[15-16]。有研究者认为,光受体靶向转录因子HY5可能是一种潜在的茎到根信号转换器,HY5在子叶中经过光合作用介导的诱导,可以从茎运输到根,可能通过韧皮部,然后在根中激活硝酸盐转运体[17]。HY5具有向根系传播光环境信息的潜在功能[18]。HY5作为下胚轴伸长、花青素和叶绿素积累的调节因子,受到组成型光形态建成1(Constitutively photomorphogenic 1,COP1)介导,整合大量的内外信号通路,在光诱导的光形态建成中发挥最突出的作用[19]。HY5受COP1泛素连接酶调控[19]。在黑暗条件下,PhyB部分失活,光形态形成因子的活性受到抑制,光敏色素互作因子(Phytochrome-interacting factors,PIFs)的稳定性提高,COP1与转录因子HY5相互作用,通过破坏它们与各自的光响应启动子元件(以LRE1为例)的接触,改变它们的活性构象从而使它们丧失转录活性(图10A)。细胞核内,COP1酶以HY5为靶点,在黑暗环境中介导HY5蛋白降解,从而抑制光形态建成(图10B),HY5蛋白在细胞核内行使调控功能,这同亚细胞定位结果相似。亚细胞定位结果显示ZjHY5蛋白定位于细胞核中。在光照情况下,红光通过光受体PhyB抑制COP1来增强bHLH转录因子家族MYC蛋白的稳定性[20]。MYC转录因子是光形态形成的调控因子和PhyB的靶标,可以增强HY5的活性,从而促进光形态发生[21]。试验结果表明ZjHY5无自激活活性,可用于后期蛋白互作试验以探究日本结缕草ZjHY5基因在光诱导基因表达中的调控作用。
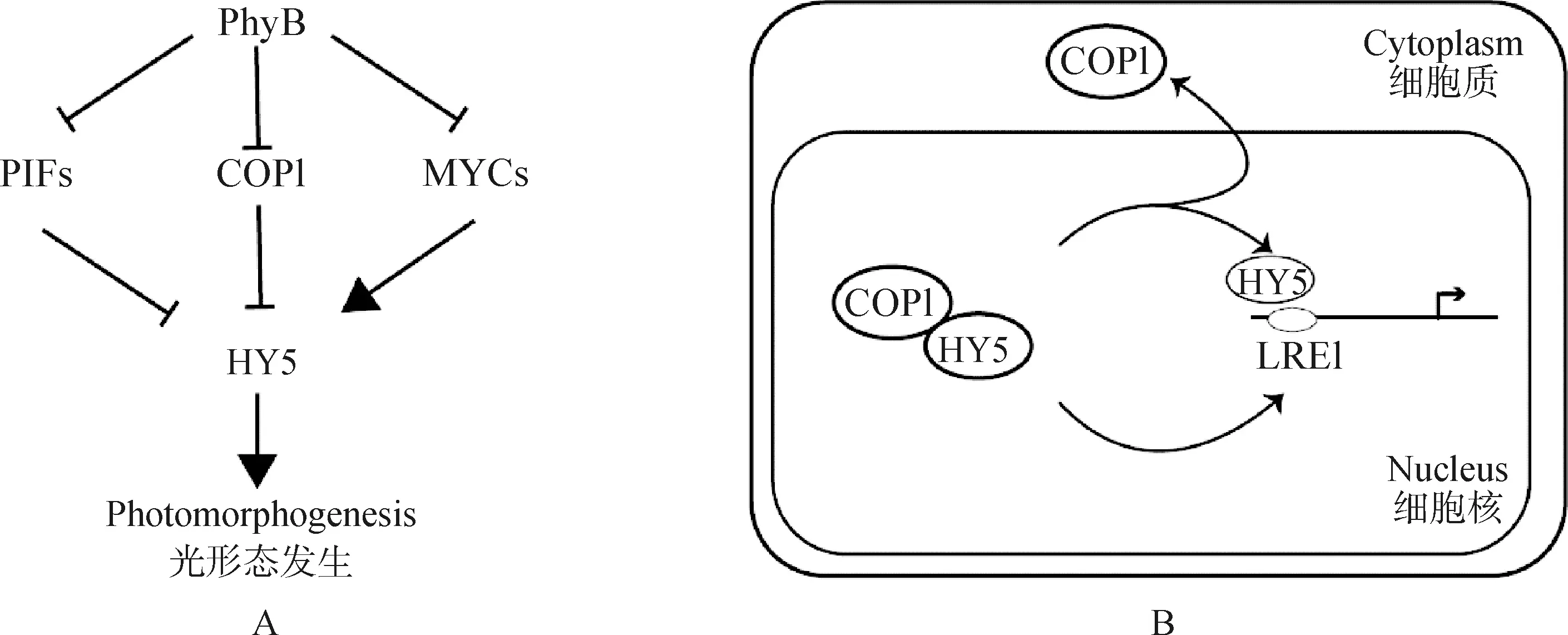
图10 COP1-HY5调控模式模型[19,21]Fig. 10 COP1-HY5 module regulatory model
4 结论
本试验成功克隆日本结缕草ZjHY5基因。ZjHY5基因开放阅读框为711 bp,编码236个氨基酸残基。预测结果显示该基因ZjHY5蛋白无信号肽,进化树构建结果显示,ZjHY5蛋白与漆姑草及苜蓿中HY5蛋白的亲缘关系最近。亚细胞定位结果显示,ZjHY5定位于细胞核中。本试验成功构建了pGBKT7-ZjHY5酵母诱饵载体,通过对比不同培养基上的酵母单菌落生长情况,发现ZjHY5基因无自激活活性,可用于后续酵母双杂交试验筛选与ZjHY5编码蛋白相互作用的相关蛋白,为研究ZjHY5基因的作用机制奠定基础。

