苜蓿根瘤菌接种数量与方式对接种效果的影响
李佳欢, 希 娜, 漫 静, 任 成, 邓 波*
(1.中国农业大学草业科学与技术学院, 北京 100193; 2.沈阳农业大学园艺学院, 沈阳 辽宁 110866;3.内蒙古大学生态与环境学院, 呼和浩特 内蒙古 010021; 4.中国科学院植物研究所, 北京 100093)
苜蓿(MedicagosativaL.)是优质的豆科牧草,蛋白含量高,能与根瘤菌共生形成根瘤,将空气中的氮气转变为可供自身利用的氨态氮[1]。根瘤菌接种能够减少生产中氮肥施用量,缓解施氮引发的环境问题,目前已广泛应用在豆科植物种植中[2]。然而,根瘤菌的田间接种效果往往不能达到预期[3]。影响根瘤菌接种效果的因素包括环境因素[4-6]、根瘤菌和宿主特性[7]、土著菌的竞争[8]、接种技术[9]等。用来提高根瘤菌的接种效果的方法有很多,如增大接种量、从土著菌中筛选高效根瘤菌[10]、与其它促生菌双接种[11-12]、添加外源根系分泌物诱导[13]等,增大接种量和改变接种方式可以显著的增加根瘤菌在根系定殖率。
增大接种量是最早提出的,也是迄今为止最常见的提高接种效果的方法。研究表明为了使接种菌的田间占瘤率达到50%,根瘤菌的接种数量至少要达到土著菌的1 000倍[14]。然而,增大接种量的方法并不总是有效。在Bogino等的试验中,接种菌数量提高后,接种菌的田间占瘤率依然小于10%,这可能是因为根系的生长快,根瘤菌的移动性较弱,接种菌在根系生长后期根尖根际定殖量少,根瘤菌不能到达结瘤敏感区,结瘤数降低[15-16]。
通过沟施的方式接种根瘤菌,能有效增大根瘤菌的分布范围,提高接种菌在田间的竞争能力。在沟施的接种方式下,接种菌的接种数量与土著菌的比例由1∶1提高到999∶1时,接种菌的田间占瘤率由4%提高到60%[17]。沟施的方法接种根瘤菌还能防止根瘤菌受包衣剂中杀菌剂的伤害[9,18]。值得注意的是,利用沟施的方法接种根瘤菌时,由于接种菌的分散性与较低的存活率,在根系生长早期(主根)的结瘤数可能偏低。相反的,利用种子包衣的方法接种根瘤菌时,接种菌聚集在种子周围,在根系生长早期有较大的根瘤菌定殖率,较浅的主根部分结瘤数较高,但由于根瘤菌的弱移动性,深根和侧根的结瘤数可能较低。采用种子包衣和沟施的方法接种根瘤菌时,根瘤在根系上的分布可能存在一定差异。根系的不同部位具有不同的资源吸收特征[19],这种特性可能使不同部位根瘤的固氮能力存在差异,从而影响根瘤菌的接种效果。然而,鲜有关于接种方式的研究在说明根瘤菌接种效果时,同时考虑结瘤数、根瘤分布和固氮酶活性差异三种因素。
本研究设置3个接种量与2种接种方式,将根系分为6部分,结合根瘤在根系的分布和固氮酶活性,在温室条件下探究根瘤菌接种方式(种子包衣和沟施)及根瘤菌接种数量(103,105,107个·株-1)对苜蓿根瘤菌接种效果的影响,为提高苜蓿根瘤菌的接种效率提供参考依据。
1 材料与方法
1.1 试验材料
供试紫花苜蓿品种为‘中苜1号’,由中国农业科学院北京畜牧兽医研究所提供。为方便与基质中根瘤菌或种子自带内生根瘤菌进行区分,统计接种菌定殖量与结瘤数,供试根瘤菌株为绿色荧光蛋白基因标记的Sm1021菌株(gfp-Sm1021)(抗400 mg·L-1硫酸链霉素(str)及80 mg·L-1壮观霉素(spe),由中国农业大学王涛教授实验室馈赠,经试验验证,荧光标记前后,Sm1021菌株的结瘤能力并未发生变化。
1.2 试验方法
培养基质准备:试验在花盆中进行(底直径4 cm,上直径9 cm,高18 cm)。每盆中装750 mL灭菌蛭石(高温高压,121℃,103 kPa,60 min,重复2次),并用低氮营养液[20]浇透。
根瘤菌接种液准备:YEM液体培养基[20],28℃,180 rmp震荡培养根瘤菌40 h后(对数期),取适量菌液离心,用无菌水洗涤2次,根据试验要求用无菌水将菌液调节至合适浓度。本试验预设接菌量约为103,105,107个·株-1左右(分别为C1,C2,C3),经平板计数法测定,最终菌液浓度为1.3×103个·株-1(C1)、1.9×105个·株-1(C2)、6×106个·株-1(C3)。
种子发芽:选取饱满的‘中苜1号’种子,75%乙醇浸泡5 min后用无菌水冲洗。纸床培养发芽,光暗周期为16小时光照,8小时黑暗,发芽温度为光照时26℃,黑暗时20℃。
根瘤菌接种与植株培养:种子发芽4天后(根系长2~3 cm),选择健壮的幼苗移栽至花盆中。移栽同时接种根瘤菌。以不接菌为对照组,其余管理手段一致。试验处理如表1所示。试验选用种子接种(Seed Inoculation,SI)(温室试验中常用种子接种代替田间的种子包衣)和沟施接种(In-furrow Inoculation,FI)2种方式。种子接种办法为:用低氮营养液调节蛭石基质含水量至田间持水量。准备好发芽后的种子(根长2 cm),用移液枪移取20 μL接种液接种于植株根系。接种后迅速移栽至蛭石中,每盆2株。沟施接种方式为:移取20 μL接种液至低氮营养液中(低氮营养液体积与种子包衣处理中相同),在种子根系滴加20 μL无菌水,迅速移栽至蛭石中,每盆2株。每个处理重复60盆。
表1 根瘤菌接种处理Table 1 Treatments of rhizobial inoculation
取样及测定:(1)根长和根瘤菌定殖量:按时间顺序取样,分别在接种后第5,8,10 d取根尖以上0~2 cm根系,每次取样时每个处理分别取5盆(10株),测定植株根长和根尖根瘤菌定殖量。利用平板涂布法计接种根瘤菌在根尖的定殖数,Sm1021在紫外光的照射下为绿色(图1a)。(2)根瘤菌结瘤数:接种40 d后,每个处理分别取5盆植株(10株),将根系分为0~4 cm主根、0~4 cm侧根、4~8 cm主根、4~8 cm侧根、8~12 cm主根、8~12 cm侧根六部分,分别测定接种根瘤菌的结瘤数,将根瘤中的根瘤菌在平板上进行扩增培养,在紫外光照射下呈绿光的即为接种菌侵染形成的根瘤,不发光则为内生根瘤菌或其他根瘤菌形成的根瘤(图1b)。(3)植株生物量与蛋白含量:接种40 d后,每个处理取10盆,收获整株植株,测定植株地上、地下部分生物量及蛋白含量。(4)根瘤干重与固氮酶活性:根系不同部位根瘤干重和固氮酶活性的测定均取自FI-C3处理。取20~30个根瘤置于西林瓶中,70℃烘干48 h至恒重,用万分之一天平称重后计算单个根瘤干重。取20~30个根瘤置于西林瓶中,采用乙炔还原法测定根瘤菌的固氮酶活性[21]。利用岛津GC-2010气相色谱仪进行测定,色谱柱为以三氧化二铝做填充物的毛细柱,柱长为30 m,直径0.53 mm,膜厚10 μm。温度设定:柱温60℃,进样器温度130℃,检测温度150℃。检测器:氢火焰检测器。
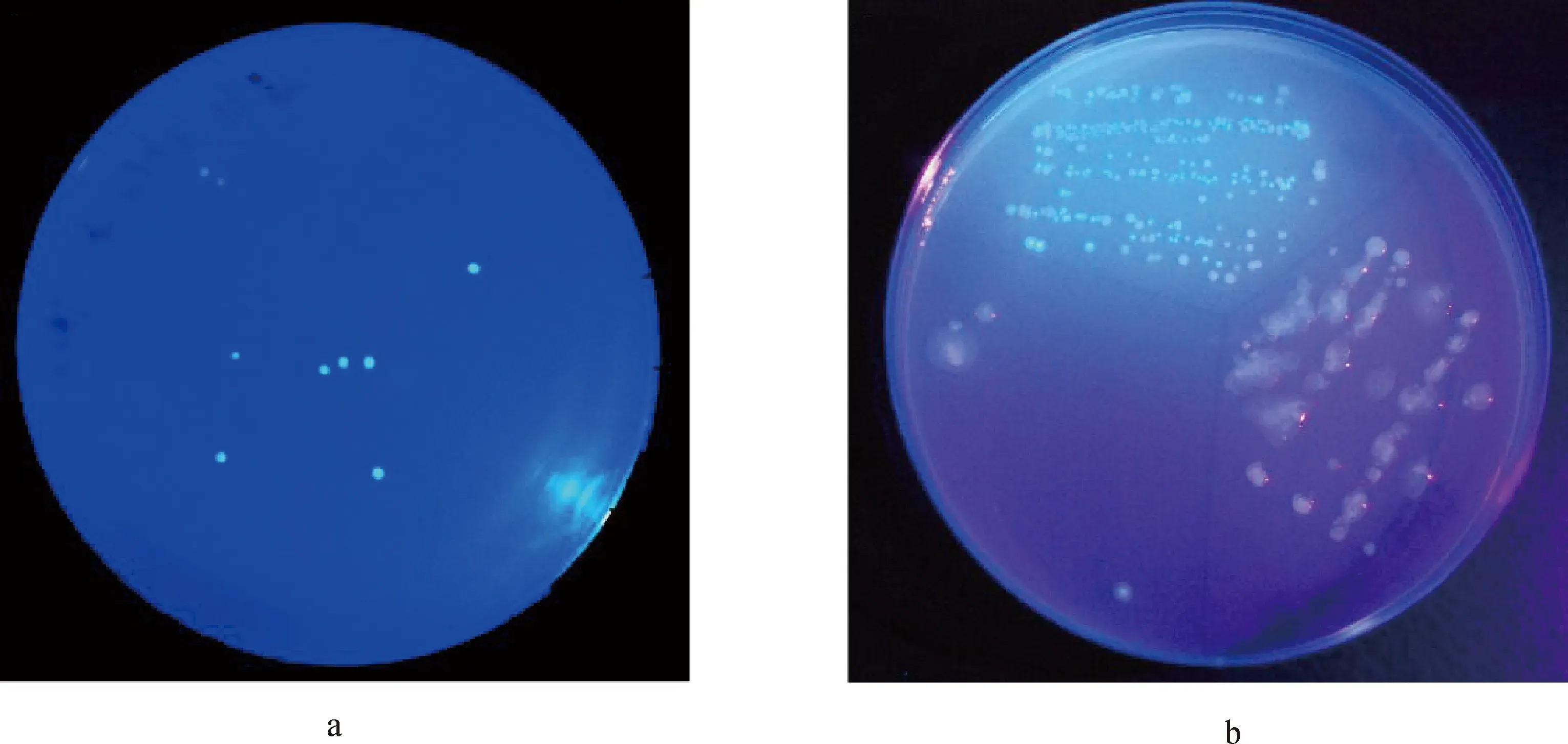
图1 接种根瘤菌gfp-Sm1021定殖量及结瘤情况测定Fig.1 Determination of colonization and nodulation of inoculated Rhizobium gfp-Sm1021
1.3 数据分析
使用Microsoft Excel 2010整理数据;采用SPSS 18.0 进行方差分析,使用Duncan法进行多重比较,使用SigmaPlot绘图。
2 结果与分析
2.1 接种方式与接种数量对根瘤菌在根尖定殖量的影响
如图2所示,随着主根的生长,根尖距离根基的距离逐渐增大。种子接种的情况下,根瘤菌在根尖表面和根内的定殖量随着根系的伸长迅速减少,根系生长后期几乎无根瘤菌在其根尖表面定殖,接种浓度越小,下降趋势越明显。沟施接种的情况下,根瘤菌在根系生长早期的根尖定殖量少于种子包衣处理,但由于其分布均匀,随着根系的伸长,根尖表面根瘤菌的定殖数量并无下降趋势,在根系生长至8 cm时,定殖量基本与种子接种相接近。在根系生长较长时,沟施接种情况下,接种菌在根尖的定殖量超过种子接种。除图2中展示的3个处理外,其它3个处理的根瘤菌定殖量过少,利用平板涂布法未能测出数值,但依然可以看出,无论何种接种方式,随着接种量的增加,根瘤菌的定殖量是增加的,但对种子接种在根系生长后期定殖量少的问题缓解作用很小。
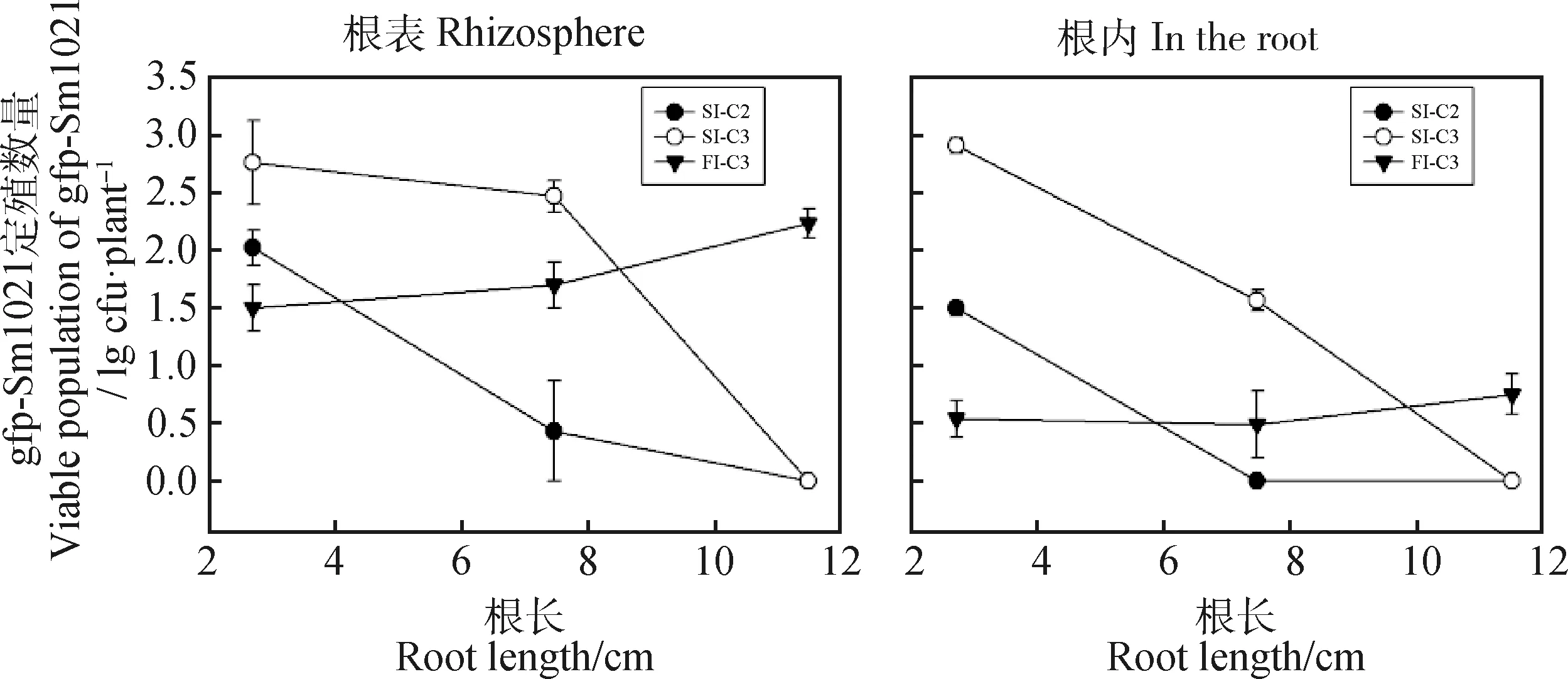
图2 根瘤菌gfp-Sm1021在苜蓿根尖表面及根内定殖量Fig.2 Viable population of gfp-Sm1021 colonized on root surface and in root
2.2 接种方式与接种数量对根瘤菌结瘤数的影响
增大接种量与接种范围均显著提高苜蓿总结瘤数(表2)。接种量由C1增加至C3时,在种子接种(SI)和沟施接种(FI)处理下,单株总结瘤数分别增加了54.66 %和75.30 %。C2与C3处理间植株结瘤数无显著差异。接种量相同时,沟施接种时植株结瘤数显著高于种子接种处理(P<0.001)。接种量为C1,C2,C3时,沟施接种处理中测得的根瘤数分别比种子接种多63.81%,70.54%和85.66%。种子包衣处理中,C2,C3和C1相比,增大接种量增加了0~4 cm主根、8~12 cm主根和8~12 cm侧根结瘤数。沟施接种处理中,C2,C3和C1相比,增大接种量主要增加了0~4 cm主根、0~4 cm侧根、4~8 cm侧根、8~12 cm主根和8~12 cm侧根结瘤数。与种子包衣相比,沟施接种增加了0~4 cm侧根、4~8 cm主根、4~8 cm侧根和8~12 cm侧根结瘤数。
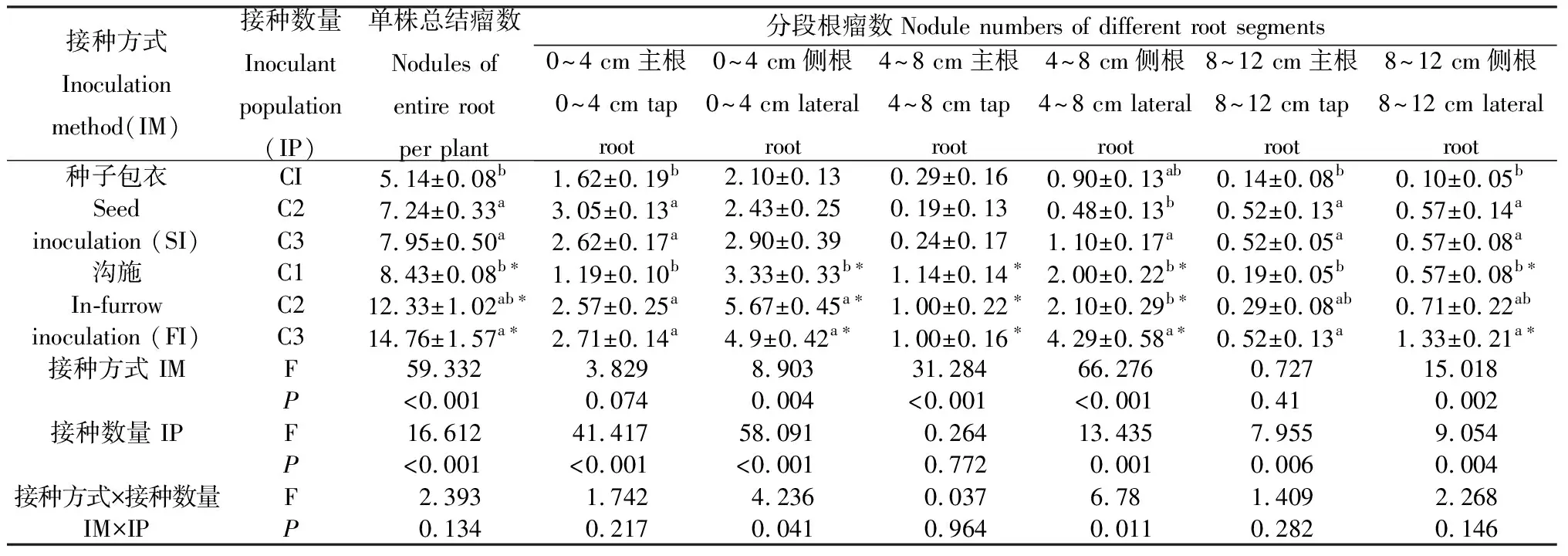
表2 根瘤菌gfp-Sm1021在苜蓿根系不同位置的结瘤数及根瘤菌接种方式和接种数量对结瘤数影响的方差分析Table 2 Nodule numbers of gfp-Sm1021 rhizobia in different positions of alfalfa root system and two-way analysis of variance (ANOVA) for the effects of inoculation method and inoculant population on nodule numbers
2.3 接种方式与接种数量对植株干重及蛋白质含量的影响
根瘤菌接种量、接种方式及其交互作用均显著影响苜蓿植株地上和地下生物量(图3a)。与对照(未接菌处理)相比,接种根瘤菌后,苜蓿地上生物量显著增加。利用种子包衣的方式进行接种时,接种量越大,植株地上生物量越大,但C2与C3接种量处理间无显著差异。沟施接种时,接种量C1处理的植株地上生物量最大,C2与C3处理间无显著差异,均小于C1处理。接种量为C1时,沟施接种处理的地上生物量高于种子接种处理;接种量为C2和C3时,沟施接种的地上生物量低于种子接种处理。
根瘤菌接种可以提高苜蓿地下生物量,三个接种量C1,C2和C3间具有显著差异,接种量越大,地下生物量越小(图3a)。接种量为C1和C2时,植株地下生物量与对照相比显著增加;接种量为C3时,植株地下生物量与对照间无显著差异。接种量为C1和C2时,沟施接种处理的地下生物量显著低于种子接种处理;接种量为C3时,沟施接种与种子接种处理间地下生物量无显著差异。根瘤菌接种量显著影响苜蓿植株蛋白含量,但接种方式及其与接种量间的交互作用对蛋白含量影响不显著(图3b)。与对照(未接菌处理)相比,接种根瘤菌后,苜蓿蛋白含量显著增加,接种量越高,蛋白含量越高。种子接种时,C2与C3接种量间植株蛋白含量差异不显著。沟施接种时,C3接种量处理时,植株蛋白含量显著小于C2。
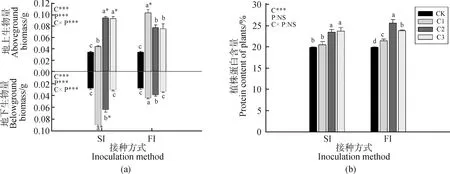
图3 不同接种处理下苜蓿地上、地下生物量和蛋白含量Fig.3 Above and below ground biomass and protein content of alfalfa in different treatments注:不同小写字母代表在同一接种方式下,不同根瘤菌接种数量间差异显著(P<0.05);*代表接种量相同时,不同根瘤菌接种方式(种子包衣与沟施)间差异显著(P<0.05)Note:Lowercase letters represent the significant difference between inoculation population under the same inoculation method at the 0.05 level. * represent the significant difference between seed inoculation and in-furrow inoculation in the same inoculant population treatment at the 0.05 level
2.4 根系不同部位根瘤干重及固氮酶活性
根系不同位置形成的根瘤干重和固氮酶活性(乙烯生成速率)均具有显著差异(图4)。主根的根瘤干重显著高于侧根(图4a)。上部分根系形成的根瘤固氮酶活性较高,其中,0~4 cm主根、0~4 cm侧根和4~8 cm主根的根瘤固氮酶活性显著高于其它部位,8~12 cm侧根形成根瘤固氮酶活性最低(图4b)。

图4 根系不同位置根瘤的干重及固氮酶活性Fig.4 Dry weight and of nodules nitrogen-fixing ability of nodules located on different root segments.注:不同小写字母代表不同根段间根瘤的干重和固氮酶活性差异显著(P<0.05)Note:Lowercase letters represent the significant difference of dry weight and nitrogenase activity of nodules located on different root segments at the 0.05 level
3 讨论
接种高效根瘤菌可提高豆科植物的生物固氮量,促进植株生长,提高土壤肥力[22-23]。由于与土著菌竞争时接种菌的竞争能力较弱,根瘤菌的田间接种效果并不理想。分布范围小是接种菌竞争能力弱的主要原因之一。根瘤菌需要通过根毛进入植株根系[24],植株根系具有结瘤活性的细胞位于根尖成熟根毛区以下尚未完全发育成熟的位置,随着根系生长,细胞结瘤活性在几小时内消失[25]。根瘤菌在结瘤活性位点处的根际定殖是侵染结瘤的前提。根瘤菌的运动主要依靠鞭毛进行,移动性差[26-27],随着根系的伸长,种子接种方式接种的根瘤菌在根尖的定殖数量减少。研究表明,在没有渗透水的情况下,菌株Rhizobiumjaponicum的垂直移动距离不足2.7 cm[28]。在本试验中也发现,随着根系的生长,种子接种根瘤菌在根尖表面和内部的定殖量快速下降。增大接种量可在一定程度上增大接种菌的定殖量与定殖范围,但并不能从根本上改善种子接种的束缚性。沟施接种处理中根瘤菌均匀分布在植株生长基质中,由于密度较小,在根尖的定殖量虽在根系生长早期少于种子接种处理,但在根系的整个生长过程中保持在稳定水平。
增大接种量可显著提高植株结瘤数,这与Bogino等人研究结果相同[17]。种子包衣处理时,增加的根瘤主要集中在0~4 cm主根部分,下部分根系及侧根的结瘤数很少,与根瘤菌的定殖动态基本平行,这再次印证了种子接种的局限性。接种量达到C2时,继续增大接种量无法提高根瘤菌结瘤数,说明当接种根瘤菌达到一定数量时,接种量已不是限制接种菌结瘤数的主要因素。同一接种量下,增大接种范围可以增加根瘤菌的分布范围,从而提高根瘤菌的结瘤数[29]。在本试验中,沟施接种处理时,主根的结瘤数与种子接种处理间无显著差异,侧根的结瘤数显著高于种子接种。说明相比于种子包衣,沟施的接种方式可以提高接种菌的分布范围,增加其在侧根的定殖率,从而增加侧根的结瘤数。
根瘤能固定空气中的氮素,将气态氮转变为氨态氮,供应植物吸收利用,提高植株干重及蛋白含量[20]。本试验中,接种根瘤菌后,植株地上和地下干重均增加。接种量越大,植株根瘤数越多,地上生物量越高。然而,沟施接种情况下,接种量C2与C3处理间的植株结瘤数虽高于C1处理,但地上生物量小于C1处理。植物-微生物间的关系随着植株养分需求量的变化而改变。当植株获得养分足够时,植物与共生菌之间的共生关系转变为寄生[30-31],削弱植株生长。沟施接种C2和C3接种量处理中,过多的根瘤可能消耗了大量的碳水化合物,导致地上生物量的降低。此外,通过测定根系不同部位根瘤的固氮酶活,发现0~4 cm主根、0~4 cm侧根、4~8 cm主根处根瘤的固氮酶活性更高。沟施接种中,增加的根瘤多位于4~8 cm侧根、8~12 cm主根与8~12 cm侧根,增加的根瘤并未起到较高的固氮作用,反而消耗了植株的碳水化合物。这可能也是C2和C3接种量下,沟施接种比种子接种的结瘤数多但地上生物量低的原因。Bogino等在花生(ArachishypogaeaL.)上的研究也发现,根瘤菌菌株C-145在沟施时虽然能在植株根系形成更多的根瘤,但生物量降低。然而,在研究中并未继续探究该现象的原因[8]。本试验结果表明,在接种量低(C1)的情况下,通过沟施接种增加根瘤菌的接种范围,可提高苜蓿结瘤数与地上生物量。在接种量高(C2,C3)的情况下,沟施接种处理中侧根增加的根瘤大部分固氮酶活性较差,使沟施接种的优势降低,这在以往关于接种方式的研究中一直被忽略,导致沟施的作用被高估。根系是植株养分吸收的主要器官,其生长具有可塑性。为了获得充足的养分资源,植株向根系分配更多的碳水化合物,根系生物量增加。随着结瘤数的增加,根系的生物量降低,也从侧面表明根瘤是特殊的氮素资源。
4 结论
在一定接种量范围内,增加接种量能提高苜蓿根瘤菌的接种效率。接种量较低时,沟施接种的效果比种子包衣好,但在接种量较高时,沟施接种的优势消失,主要是由于沟施接种增加的根瘤多位于侧根且固氮酶活性较低。因此,在田间进行根瘤菌接种时,以种子包衣为优,适当增大接种量可提高接种效果。

