糖浓度变化对牛肺泡巨噬细胞促炎细胞因子释放的影响
谭天宇,才冬杰,王之盛,左之才,*
(1.四川农业大学 动物医学院,动物疫病与人类健康四川省重点实验室,四川 成都 611130;2.四川农业大学 动物营养研究所,四川 成都 611130)
肺泡巨噬细胞是调节肺部炎症反应维持肺炎症微环境的最重要的免疫细胞。在肺部受到外来(如细菌、病毒感染)或内在致病因素(如内源性炎症介质)刺激后,肺泡巨噬细胞被活化并释放促炎细胞因子、趋化因子等促进肺部炎症反应的发生。但过度的炎症反应会加重肺组织损伤,肺泡巨噬细胞的活化被认为是多种肺部疾病(如急性肺损伤)的始发因素。有研究表明,高浓度的葡萄糖(即高糖)也能够活化肺泡巨噬细胞,引起促炎细胞因子释放。葡萄糖本是细胞重要的能量来源,保证了细胞能量的需求与利用,但高糖(体外试验一般为25.5 mmol·L)能通过氧化应激途径激活并上调糖基化终末产物受体(RAGE)与Toll样受体4(TLR4),进一步激活下游信号通路MyD88/NF-κB,从而促进炎症反应。目前有关高糖体外促炎作用机制的研究主要有人单核细胞、牛主动脉内皮细胞等,而高糖促进BAMs促炎细胞因子释放的过程是否伴随着RAGE-TLR4-MyD88-NF-κB上调,尚不清楚。
综上所述,本文研究葡萄糖浓度变化对BAMs RAGE-TLR4-MyD88-NF-κB基因表达以及对促炎细胞因子TNF-α、IL-1β及IL-6释放的影响,初步探讨高糖促进BAMs炎症反应的分子机制。
1 材料与方法
1.1 实验材料
高糖DMEM、低糖DMEM培养基购自索莱宝(中国),胎牛血清购自生工生物工程有限公司(中国),TNF-α、IL-1β、IL-6的ELISA检测试剂盒购自晶美生物工程有限公司(中国),Premix酶、反转录试剂盒购自宝生物公司(日本)。
原代牛肺泡巨噬细胞采自健康牛新鲜肺部组织。
-、、4、-65、88的实时荧光定量检测引物见表1,引物由生工生物工程有限公司合成。

表1 各基因实时荧光定量引物序列Table 1 Primer sequence of genes for real-time PCR
1.2 方法
1.2.1 牛肺泡巨噬细胞的采集与分组处理
参照文献[13]中原代牛肺泡巨噬细胞采集方法,肺泡巨噬细胞阳性率大于96%。在四川省雅安市某肉牛屠宰场中,取出无呼吸道症状肉牛眼观健康无病变的新鲜且完整的牛肺,结扎气管防止污染,带回四川农业大学雅安校区兽医院进行原代肺泡巨噬细胞的分离。用经过高压灭菌且含有200 IU·mL青霉素、200 μg·mL链霉素的PBS对肺表面进行冲洗,并将PBS经气管灌入肺部,使用注射器收集灌洗液,重复3次。收集到的灌洗液经200目尼龙纱布过滤,1 200×离心6 min,收集细胞。PBS洗涤细胞,1 200 r·min离心6 min,用含10%胎牛血清的DMEM低糖培养液重悬细胞,对细胞进行计数,置于37 ℃二氧化碳恒温培养箱培养6 h。PBS洗去未贴壁细胞,消化重悬细胞,调整细胞数为1×10mL,并通过台盼蓝染色法计算细胞存活率。分装于细胞培养瓶中,置于培养箱内培养3 h。用5.5 mmol·L(Ⅰ组、对照组)、15.5 mmol·L(Ⅱ组)和25.5 mmol·L葡萄糖(Ⅲ组)及5.5 mmol·L葡萄糖+20 mmol·L甘露醇(Ⅳ组、渗透压对照组)诱导BAMs 12 h,并使用25.5 mmol·L葡萄糖诱导BAMs 0、3、6、12、24 h,每组设置3个平行。分别收集处理后的上清液及下层细胞,上清液用于ELISA检测TNF-α、IL-1β、IL-6水平,下层细胞用于检测、4、88、-的mRNA转录水平。
1.2.2 实时荧光定量PCR检测牛肺泡巨噬细胞、4、88和-的mRNA转录水平
对收集到的BAMs中总RNA采用Trizol法进行提取,并测定总RNA浓度及纯度,采用反转录试剂盒对总RNA进行反转录,得到的cDNA置于-80 ℃保存备用。以cDNA为模板,对每组、4、88、-的mRNA水平进行检测。实时荧光定量PCR反应体系:上下游引物各0.5 μL,Premix6.0 μL,cDNA模板5.0 μL。反应条件:95 ℃ 3 min;95 ℃ 10 s,58 ℃ 30 s,循环40次,每个循环后检测荧光强度值。实时定量PCR的结果采用 2法进行计算,用内参基因-对各基因表达水平均一化,2法计算公式:△CT=CT-CT,△△CT=△CT-△CT。
1.2.3 ELISA检测牛肺泡巨噬细胞上清液中TNF-α、IL-1β、IL-6浓度
参照ELISA试剂盒说明书检测每组上清液中TNF-α、IL-1β、IL-6蛋白浓度。
1.3 统计学分析
采用SPSS22.0软件对实验数据进行统计分析,结果用′±表示,多重比较进行组间统计学处理。<0.05为差异有显著统计学意义,<0.01表示差异具有极显著统计学意义。
2 结果与分析
2.1 不同浓度葡萄糖对BAMs RAGE、TLR4、MyD88、NF-κB p65基因表达及促炎细胞因子IL-1β、IL-6、TNF-α释放的影响
Ⅲ组、4、88和-65mRNA表达极显著(<0.01)高于Ⅰ组,Ⅰ组、Ⅱ组及Ⅳ组间、4、88和-65的mRNA表达均无显著性差异(>0.05)。即只有25.5 mmol·L葡萄糖处理BAMs 12 h能够引起、4、88、-65基因表达相较于Ⅰ组极显著(<0.01)上调,并且与25.5 mmol·L葡萄糖引起的渗透压升高无关(图1)。Ⅲ组上清液中的IL-1β、IL-6及TNF-α浓度极显著(<0.01)高于其他各组(Ⅰ、Ⅱ、Ⅳ组),而Ⅱ组上清液中IL-1β、IL-6浓度极显著(<0.01)高于Ⅰ组与Ⅳ组,TNF-α浓度显著(<0.05)高于Ⅰ组与Ⅳ组。即15.5 mmol·L和25.5 mmol·L葡萄糖处理BAMs 12 h,能引起BAMs促炎因子TNF-α、IL-1β、IL-6释放增加,且25.5 mmol·L相较于15.5 mmol·L葡萄糖增加更显著(<0.01),并且与25.5 mmol·L葡萄糖引起的渗透压升高无关(图2)。
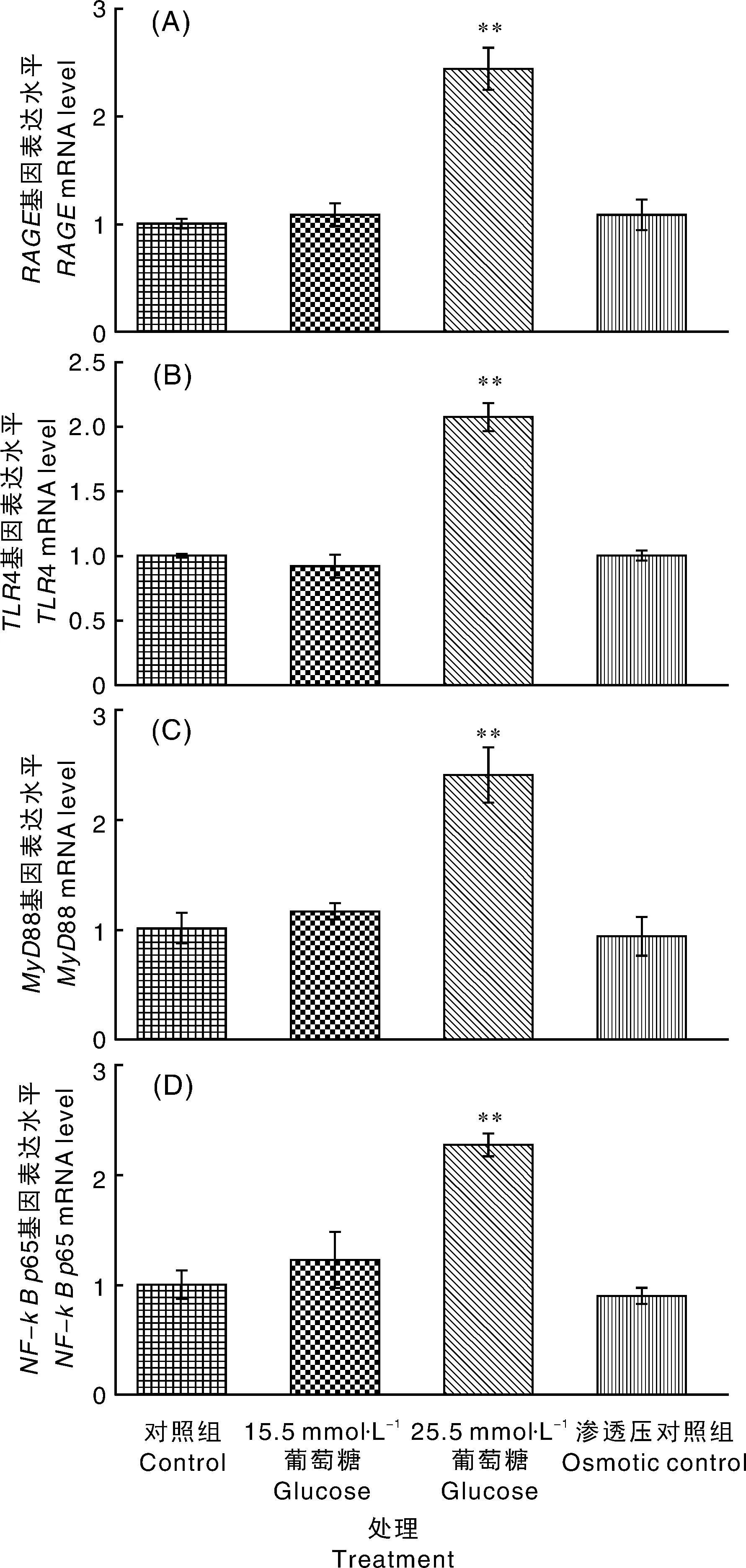
*表示与对照组差异显著(P<0.05),**表示与对照组差异极显著(P<0.01)。下同。* meaned there was a significant difference from the control group (P<0.05),** meaned there was a very significant difference from the control group (P<0.01).The same as below.图1 不同浓度葡萄糖处理BAMs 12 h对RAGE、TLR4、MyD88、NF-κBp65基因表达的影响Fig.1 Effects of different concentrations of glucose on gene expression of RAGE,TLR4,MyD88 and NF-κB p65 in bovine alveolar macrophages induced for 12 hours
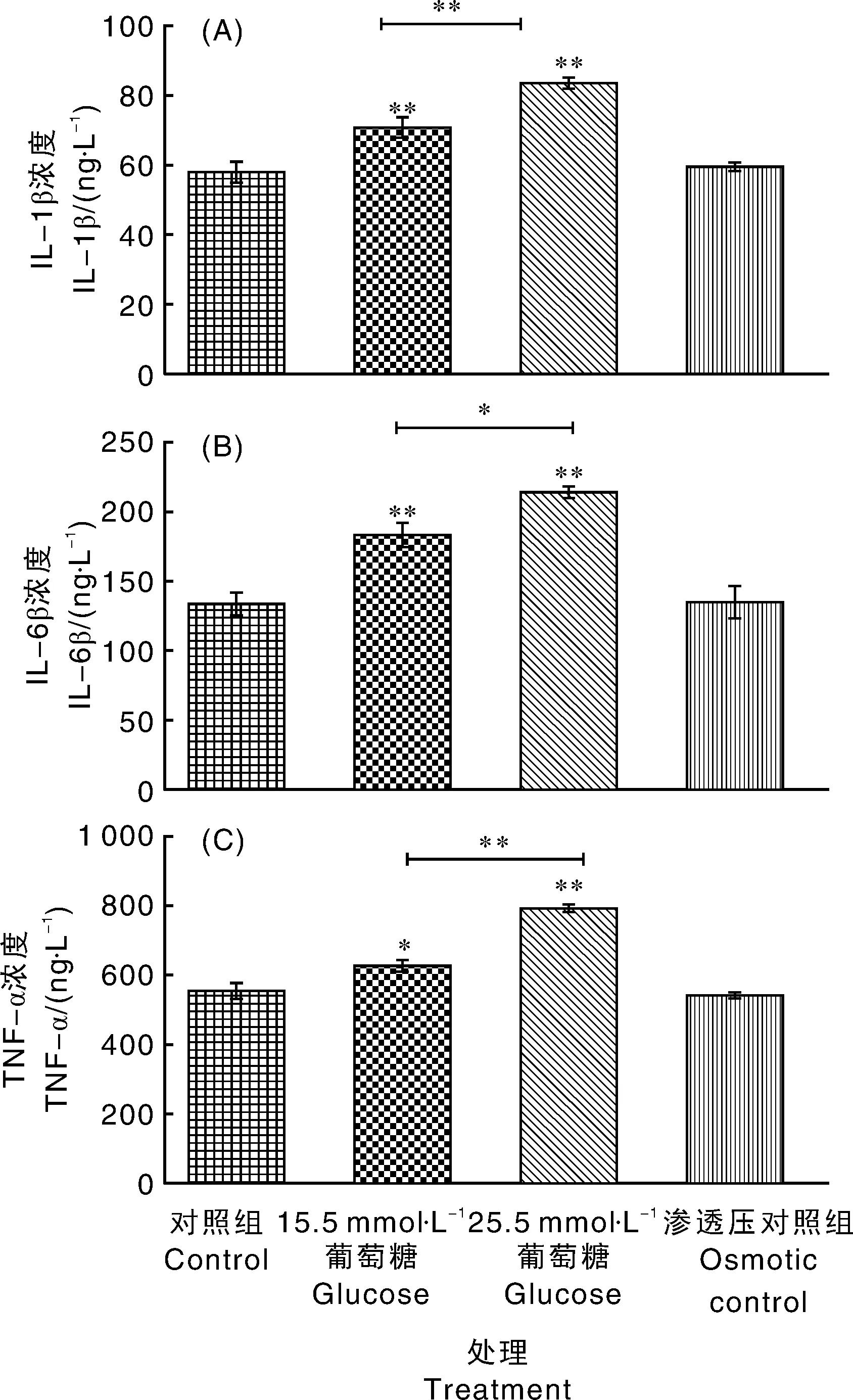
图2 不同浓度葡萄糖诱导BAMs 12 h对IL-1β、IL-6及TNF-α释放的影响Fig.2 Effects of different concentrations of glucose on releasing of IL-1β,IL-6,TNF-α in bovine alveolar macrophages induced for 12 hours
2.2 25.5 mmol·L-1葡萄糖处理不同时间对BAMs RAGE、TLR4、MyD88、NF-κB p65基因表达及促炎细胞因子IL-1β、IL-6、TNF-α释放的影响
、4、88及-mRNA水平均在12 h处于峰值,极显著(<0.01)高于其他时间点;mRNA水平在6 h显著高于0 h(<0.05),在24 h极显著(<0.01)高于0、3、6 h,其他时间点间无显著性差异(>0.05);88、4、-65mRNA水平在3 h时显著(<0.05)高于0 h,4 mRNA水平6 h时显著(<0.05)高于0、3、24 h,但88、-65在3、6、24 h间无显著性差异(>0.05)。-65在24 h时仍极显著(<0.01)高于0 h,但4、88 24 h与0 h无显著性差异(>0.05),如图3所示。
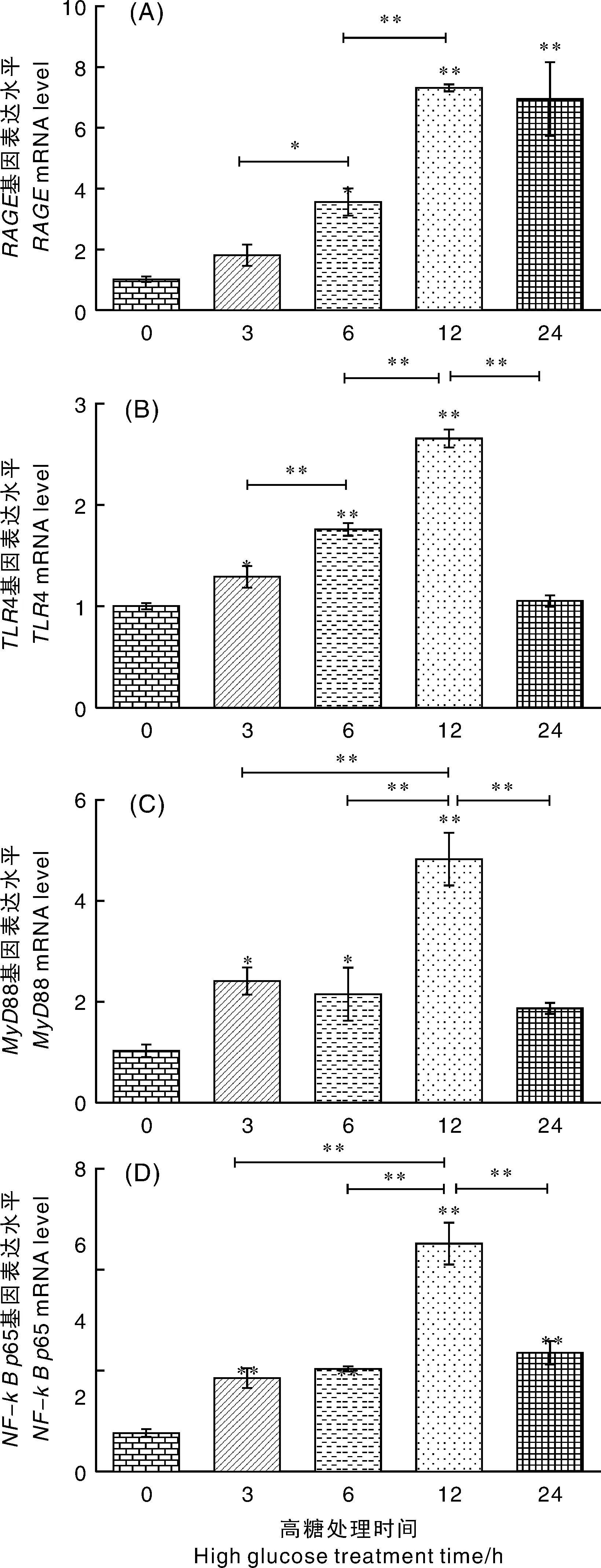
图3 高糖诱导时间对牛肺泡巨噬细胞RAGE、TLR4、MyD88、NF-κB p65基因表达的影响Fig.3 Effects of different high glucose induction time on gene expression of RAGE,TLR4,MyD88 and NF-κB p65 in bovine alveolar macrophages
TNF-α、IL-1β、IL-6浓度在6、12、24 h均极显著(<0.01)高于0 h,在3~24 h呈现时间依赖效应,24 h时IL-1β、TNF-α显著(<0.05)高于12 h,但IL-6 24 h与12 h无显著性差异(>0.05),如图4所示。

图4 高糖诱导时间对BAMs IL-1β、IL-6及TNF-α释放的影响Fig.4 Effects of different high glucose induction time on releasing of IL-1β,IL-6,TNF-α in bovine alveolar macrophages
3 讨论
高糖能够促进细胞炎症反应,并与IL-1β、IL-6及TNF-α等促炎因子水平呈正相关。目前研究发现,高糖主要通过TLR4、RAGE等固有免疫受体发挥促炎作用,但受体下游信号传导途径尚有待进一步研究。TLR4是机体重要的模式识别受体,能够识别诸多病原相关分子模式如细菌脂多糖等,激活下游炎症信号通路,在先天性免疫中发挥重要作用。Devaraj等研究发现,25.5 mmol·L高糖能诱导人单核细胞TLR4表达上调,并进一步促进NF-κB的活化,促进单核细胞炎症反应。Li等研究发现,25.5 mmol·L高糖能够诱导人巨噬细胞TLR4的激活,并促进TNF-α与IL-1β的合成与释放。高糖相关体外细胞试验中,25.5 mmol·L葡萄糖浓度是对于大部分体外培养细胞的高糖浓度,因此本次研究也采用25.5 mmol·L作为最高葡萄糖浓度。在本次研究中发现,25.5 mmol·L葡萄糖处理3 h后,BAMs4、-65基因表达显著上调,并于12 h达到峰值,并通过检测BAMs培养上清液发现,在该过程中IL-1β、IL-6及TNF-α浓度与25.5 mmol·L葡萄糖处理时间呈正相关,IL-1β、IL-6浓度于24 h达到峰值,TNF-α于12 h达到峰值。上述结果表明,25.5 mmol·L葡萄糖能够促进BAMs促炎因子IL-1β、IL-6及TNF-α的释放,该过程可能与激活TLR4/NF-κB有关。
RAGE是机体另一个重要的模式识别受体,与TLR4发挥类似的作用,RAGE与TLR4共享部分配体及下游炎症信号通路。Zhao等研究发现,25.5 mmol·L高糖能够通过激活RAGE,激活下游MAPK/NF-κB炎症信号通路,诱导人星形胶质细胞的炎症反应。髓样分化因子88(MyD88)是TLR4胞内重要的接头蛋白,能够接收TLR4传导至胞内的信号,并进一步传导至NF-κB,使NF-κB活化入核,促进细胞合成炎性细胞因子如TNF-α、IL-1β、IL-6等。但有研究提出,MyD88可能接收来自RAGE传导至胞内的信号,并激活下游炎症信号通路。基于此,我们研究发现,BAMs经25.5 mmol·L葡萄糖处理6 h后,基因显著上调,在该过程中88、-65同样显著上调,、88、-65基因表达于12 h达到峰值。因此,推测MyD88活化与高糖诱导的RAGE激活也有关联,并进一步传导至NF-κB,发挥促炎作用。有研究指出,RAGE与TLR4在不同细胞或不同处理下,发挥主要功能的受体不同。在本次研究发现高糖处理24 h后,4、88基因表达与0 h无显著差异,、-65基因表达仍显著高于0 h,但-65基因表达显著低于12 h,提示高糖处理BAMs 24 h后,激活NF-κB维持炎症反应的主要受体可能为RAGE。
牛在应激条件下(如运输应激)血糖浓度常显著升高。并且在应激过程中,牛肺部常产生由机体与病原共同导致的肺部过度炎症反应,而肺泡巨噬细胞在肺部炎症反应的发生发展中发挥重要作用。本研究发现,体外高糖能够诱导BAMs释放促炎细胞因子,但还需动物试验来进一步讨论血糖升高和运输应激过程中肺部炎症反应的关系。
综上所述,高糖能够诱导BAMs促炎细胞因子TNF-α、IL-1β和IL-6的释放,并且该过程可能与高糖激活BAMs RAGE-TLR4-MyD88-NF-κB炎症信号通路有关。本试验初步探讨了高糖促进BAMs炎症反应的分子机制,以期为高糖相关肺部炎性疾病的预防及治疗提供新的思路。

