猪圆环病毒2型和3型双重荧光定量PCR检测方法的建立
牟泓晔,周小杰,杨永春,王晓杜,周莹珊,2,*,宋厚辉,*
(1.浙江农林大学 动物科技学院·动物医学院,浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,动物健康互联网检测技术浙江省工程研究中心,浙江 杭州 311300;2.浙江农林大学 动物科技学院·动物医学院,浙江省动物医学与健康管理国际科技合作基地,中澳动物健康大数据分析联合实验室,浙江 杭州 311300)
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科(Circoviridae)圆环病毒属()的单股环状无囊膜DNA病毒。其中猪圆环病毒2型(PCV2)是主要的致病型病毒,在临床中常引起断奶仔猪多系统衰竭综合征,皮炎肾病综合征,繁殖障碍以及呼吸道、肠道和多系统的炎症反应。2015年,一种新型的猪圆环病毒3型(PCV3)被发现。这两种病毒感染在临床上有相似的繁殖障碍和呼吸道、肠道症状,给临床检测和防治带来一定困难。因此,急需建立一种检测方法对PCV2和PCV3的临床感染进行快速鉴别区分,以便及时做好防治和控制病原工作。
目前针对PCV2和PCV3的检测方法有普通PCR检测、普通二重PCR检测、单重荧光定量PCR检测、蛋白琼脂扩散检测、抗体胶体金免疫层析检测、间接ELISA检测等检测方法,这些检测方法均能对PCV2和PCV3病原进行特异性检测,但尚存在不足还需进一步完善。因此,本研究基于已有实验基础针对PCV2和PCV3特异性序列分别设计2对引物和1对探针,应用man探针法双重荧光定量PCR技术建立了一种可以同时检测区分PCV2和PCV3的定量检测方法,为PCV2和PCV3混合感染的诊断提供了特异、灵敏、快速的初步检测依据。
1 材料与方法
1.1 病毒及病料
猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪细小病毒(PPV)、伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、经商品化试剂盒检测为阳性的PCV2和PCV3病料均由本实验室保存。181份来自浙江省不同规模养殖场猪胸腔附近的肌肉及全血样品由本室采集并保存。
1.2 试剂及仪器
ProbeqPCR检测试剂盒购自大连宝生物公司,病毒核酸提取试剂盒购自武汉市藤源恒峰生物科技有限公司,小提质粒试剂盒和质粒纯化试剂盒购自北京天根公司,Trizol试剂购自上海赛默飞世尔科技有限公司。
MX3000P型荧光定量PCR仪购自Agilent(美国),SynergyH1型酶标仪购自BioTek(美国),全自动样品快速研磨仪购自上海净信公司,低温高速离心机和小型高速离心机购自Eppendorf(德国)。
1.3 引物和探针的设计与合成
参照GenBank发表的PCV2 Cap基因和PCV3 Cap基因的保守序列,利用SnapGene软件设计PCV2和PCV3特异性引物和Man探针。其中,PCV2的2条引物序列分别为5′-TCACCTATGACCCCTATG-3′和5′-GGAAGTAATCAATAGTGGAATC-3′,扩增片段长度117 bp;PCV3的2条引物序列分别为5′-TGGCTCAACACATATGAC-3′和5′-ACGGACTTGTAACGAATC-3′,扩增片段长度125 bp。针对PCV2和PCV3设计的探针序列分别为FAM-ACTCCTCTCGCCATACCATAACC-BHQ1和HEX-TGCCGTAGAAGTCTGTCATTCCA-BHQ1。设计的引物和探针均由杭州有康生物科技有限公司进行合成
1.4 重组质粒标准品的构建和鉴定
使用病毒核酸提取试剂盒分别提取PCV2、PCV3阳性病料核酸作为模板,PCR扩增相应目的基因。反应条件均为:98 ℃ 3 min;98 ℃ 15 s,52 ℃ 5 s,68 ℃ 5 s,共35个循环;68 ℃ 5 min。PCR产物纯化回收后连接到pMD18-T载体,构建重组质粒,PCR鉴定为阳性后由上海金唯智生物科技有限公司测序鉴定后测定质粒浓度,计算拷贝数,作为质粒标准品。
1.5 反应条件的优化与标准曲线建立
本研究建立在单重荧光定量实验的基础上,采用矩阵法调整引物和探针的浓度,以此确定一个优化后的反应体系。以PCV2和PCV3质粒为DNA模板,分别稀释到1×10拷贝·μL,再依次进行10倍稀释,绘制标准曲线。
1.6 特异性试验
使用病毒核酸提取试剂盒提取PRRSV、PRV、PPV、CSFV、PEDV、TGEV核酸后,将各病毒DNA和反转录得到的cDNA作为模板,利用优化后的体系和条件进行扩增,检测其特异性。
1.7 敏感性试验
将PCV2和PCV3的阳性质粒进行1∶1混合作为混合质粒,作10倍稀释,稀释后的浓度为1.0×10~1.0×10拷贝·μL进行敏感性检测,以ddHO为阴性对照,同时利用本实验室建立的常规PCR进行检测,比较两种方法的灵敏度差异。
1.8 重复性试验
分别以浓度为10、10、10拷贝·μL的1.7节中标准品混合物作为模板分别进行3次重复扩增,进行组内重复试验,选取3个不同时间点,对上述标准品模板分别扩增,进行组间重复试验,计算Ct值的标准差(SD)和变异系数(CV)检测其重复性。
1.9 临床样品符合率检测
从浙江省不同规模养猪场采集到181份临床猪肉和全血样品,猪肉样品通过磁珠研磨裂解提取核酸,全血离心后取上层血清利用Trizol法抽提核酸,分别通过本研究中构建的双重荧光定量检测方法和普通荧光PCR检测方法对其进行PCV2(GB/T35901-2018)和PCV3(T/CVMA X8-2019)检测后分析其阳性符合率。
2 结果与分析
2.1 PCV2和PCV3重组质粒标准品的构建
PCV2和PCV3重组质粒以阳性病料核酸为模板经PCR扩增后,分别在117 bp和125 bp出现目的条带(图1),表明成功扩增出目的基因。根据公式计算pMD-PCV2和pMD-PCV3的初始拷贝数分别为1.07×10拷贝·μL和1.2×10拷贝·μL。
2.2 荧光定量PCR反应条件优化结果与标准曲线的建立
经过实验优化后,建立的双重荧光定量反应总体系20 μL,其中Premix酶10 μL,上下游引物均为0.4 μL(0.2 μmol·L),探针均为0.8 μL(0.2 μmol·L),模板各2 μL,剩余体积用DEPC水补足,反应程序为95 ℃ 30 s;95 ℃ 15 s,60 ℃ 34 s,共40个循环。

M,DL2000 DNA分子质量标记;1,PCV3基因;2,PCV2基因。M,DL2000 DNA Marker;1,PCV3 gene;2,PCV2 gene.图1 目的基因的PCR扩增结果Fig.1 Amplification of the target genes by PCR
采用上述优化的反应条件,分别以8个稀释度(1.0×10拷贝·μL~1.0×10拷贝·μL)的PCV2和PCV3标准品为模板进行荧光定量PCR扩增,以不同浓度标准品的对数值为横坐标,反应循环数为纵坐标绘制PCV2和PCV3的标准曲线(图2),二者标准曲线的斜率分别为-3.258和-3.408,相关系数分别为0.995和0.996,线性关系良好。
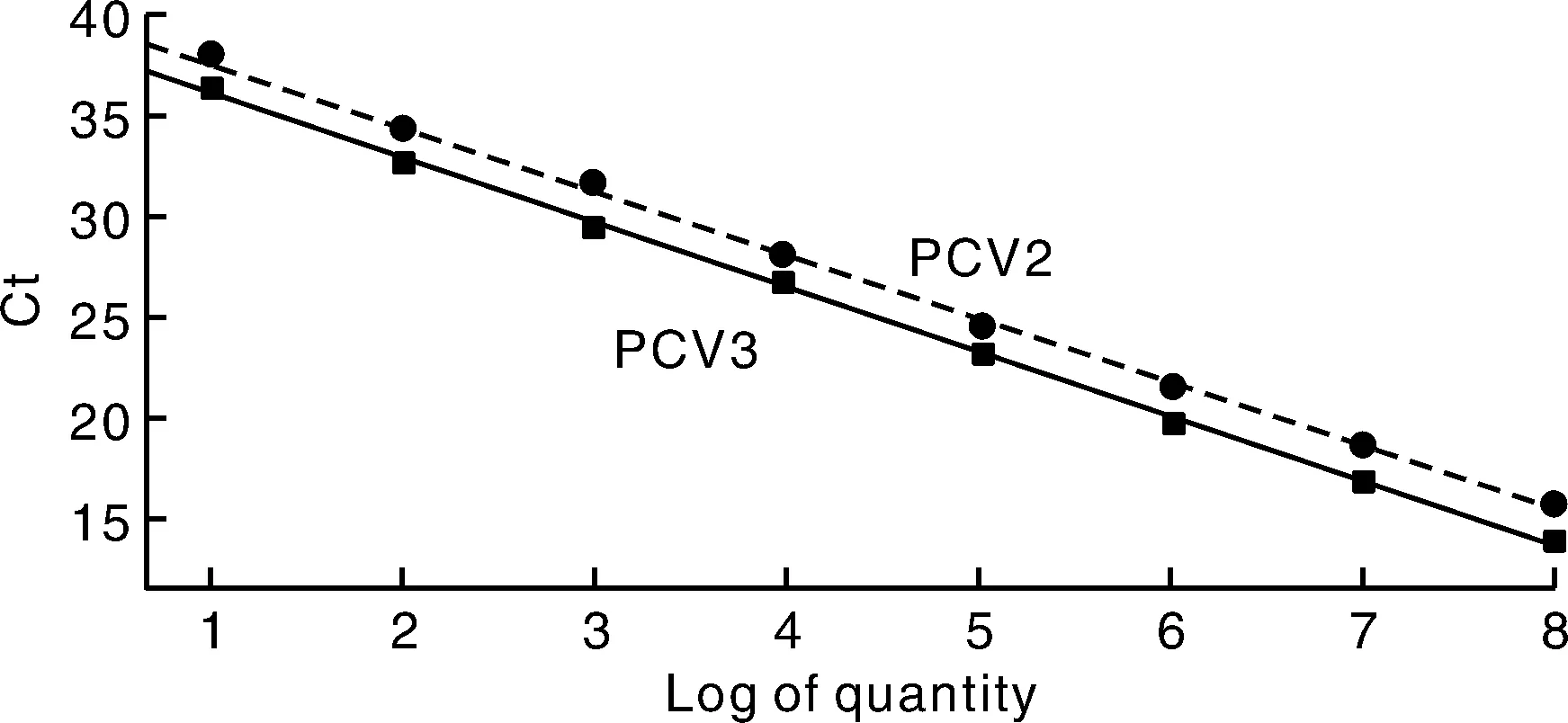
图2 TaqMan荧光定量PCR检测标准曲线Fig.2 The standard curve of TaqMan fluorescence quantitative PCR
2.3 特异性试验结果
将建立的双重荧光定量方法对PRRSV、PRV、PPV、CSFV、PEDV、TGEV、PCV2、PCV3进行检测,结果显示,仅PCV2和PCV3呈阳性,其余均为阴性,表明该检测方法特异性良好(图3)。
2.4 敏感性试验结果
以10倍系列稀释的标准品为模板,用建立的双重荧光定量PCR方法进行检测,结果表明,该检测方法所能检测的PCV2和PCV3的最低检测浓度均为10 拷贝·μL(图4),而常规PCR对PCV2重组质粒标准品最低检测限为10拷贝·μL,对PCV3为10拷贝·μL(图5)。表明该方法敏感性优于常规PCR,敏感性较高。

1,猪圆环病毒2型;2,猪圆环病毒3型;3,猪繁殖与呼吸综合征病;4,伪狂犬病病毒;5,猪细小病毒;6,猪瘟病毒(CSFV);7,猪流行性腹泻病毒;8,猪传染性胃肠炎病毒;9,ddH2O。1,PCV2;2,PCV3;3,PRRSV;4,PRV;5,PPV;6,CSFV;7,PEDV;8,TGEV;9,ddH2O.图3 双重荧光定量PCR特异性检测结果Fig.3 Specificity detection results of duplex fluorescence quantitative PCR

1~8,pMD-PCV2质粒浓度为1.0×108~1.0×101拷贝·μL-1;9,PCV2阴性对照;a~h,pMD-PCV3质粒浓度为1.0×108~1.0×101拷贝·μL-1;i,PCV3阴性对照。下同。1-8,1.0×108-1.0×101 copies·μL-1 of pMD-PCV2;9,PCV2 negative control;a-h,1.0×108-1.0×101 copies·μL-1 of pMD-PCV3;i,PCV3 negative control.The same as below.图4 双重荧光定量PCR敏感性检测结果Fig.4 Sensitivity detection results of duplex fluorescence quantitative PCR
2.5 重复性试验结果
分别以倍比稀释的质粒标准品混合物作为模板进行组内和组间的重复性试验,结果显示,PCV2和PCV3的所有重复样品的组内和组间的变异系数(CV)均小于2%(表1),表明该检测方法重复性良好。

表1 PCV2与PCV3标准品可重复性试验Table 1 Reproducibility test of PCV2 and PCV3 standard products
2.6 临床样品检测结果
将采集的浙江省181份猪肉及全血样品用建立的双重荧光定量PCR方法检测(表2),结果显示,样品中PCV2阳性检出率为50.83%(92/181),PCV3阳性检出率为37.57%(68/181),PCV2与PCV3混合感染阳性检出率为12.15%(22/181)。普通荧光PCR检测结果显示PCV2阳性检出率为50.28%(91/181),PCV3阳性检出率为36.46%(66/181),PCV2与PCV3混合感染阳性检出率为11.60%(21/181),根据金标准计算符合率的方法(标准检测方法与本文中建立的检测方法检出阳性样品数的比值),两种方法检测PCV2和PCV3的符合率分别为98.91%和97.06%,PCV2和PCV3混合感染符合率为95.45%,表明所建立的双重荧光定量PCR检测方法与国家标准普通荧光PCR检测符合率较高,可用于临床检验。
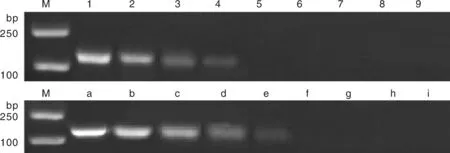
1~8,pMD-PCV2质粒浓度为1.0×108~1.0×101拷贝·μL-1;9,PCV2阴性对照;a~h,pMD-PCV3质粒浓度为1.0×108~1.0×101拷贝·μL-1;i,PCV3阴性对照。1-8,1.0×108-1.0×101copies·μL-1 of pMD-PCV2;9,PCV2 negative control;a-h,1.0×108-1.0×101copies·μL-1 of pMD-PCV3;i,PCV3 negative control.图5 普通PCR敏感性检测结果Fig.5 Sensitivity detection results of ordinary PCR
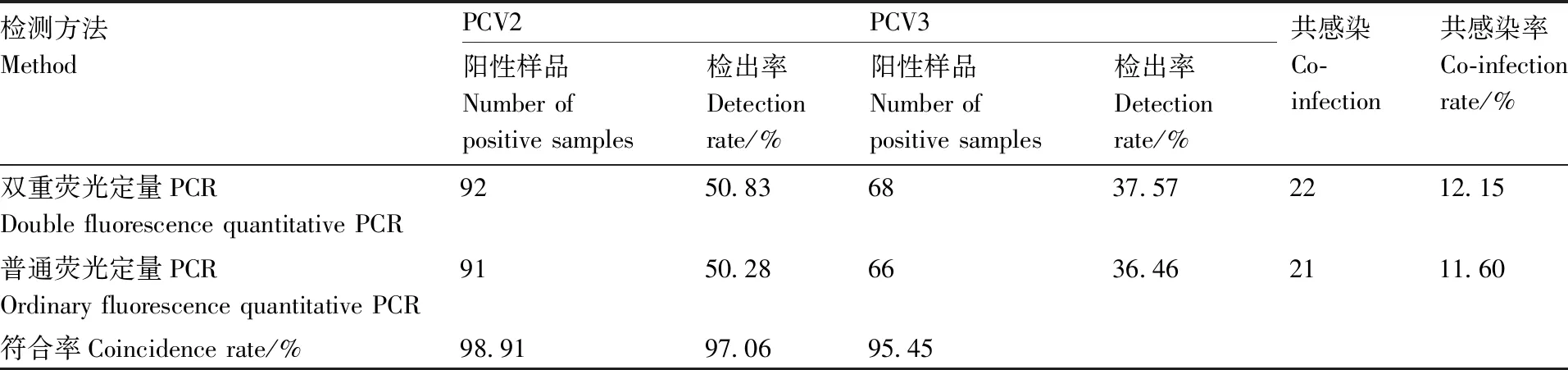
表2 临床样品的检测结果Table 2 Test results of clinical samples
3 讨论
猪圆环病毒感染在临床上多引起皮炎肾病综合征和繁殖障碍等疾病,PCV2和PCV3均具有易感性,常通过呼吸道和消化道等途径感染猪群,各年龄段的猪群均易感且发病症状各不相同,常与其他传染性病毒交叉感染给养殖业带来威胁。并且研究发现,PCV2与PCV3两种致病型也常混合感染,两者引起的临床症状相似,给临床诊断带来一定难度。因此,需要一种检测手段对其进行鉴别。
随着现代分子生物学的发展,已有多种检测手段能对PCV2和PCV3进行特异性检测,尤其是荧光定量PCR的发展,对临床检测有重要意义。我国已有针对PCV2病原的荧光定量PCR标准检测方法,但目前尚未有对PCV2和PCV3检测的OIE标准,使得临床上PCV2和PCV3的检测受限,并且目前也没有针对PCV2和PCV3的双重荧光定量PCR检测方法来对其进行区别。因此,本研究设计了一种双重荧光定量检测方法能精准地检测出圆环病毒2型和3型,对PCV2和PCV3的早期鉴别诊断有重要意义。
本研究以PCV2和PCV3的重组质粒为标准品模板进行PCR扩增,结果显示,可扩增出曲线,当模板浓度为10 拷贝·μL时仍可检测到荧光信号;对比文献[7]中普通二重PCR检测方法,本研究建立的检测方法不需跑胶验证更高效便捷,无试剂对人体造成毒害作用,且只能特异性地扩增出圆环病毒,其他病毒均呈阴性;对比文献[6]普通PCR核酸检测只能单一检测出PCV2,本研究可对PCV2和PCV3进行特异性区分;对比文献[9]中建立的多克隆抗体检测方法造价低,更适用于针对临床中大批量样品的检测;另外本研究中应用的man探针技术比文献[8]中染料法检测精度更高并能对PCV2与PCV3进行特异性区分。因此,本研究中建立的双重荧光定量检测方法对PCV2与PCV3的鉴别诊断及流行病学检测提供了新的试验依据,对临床检测有重要的应用价值。
4 结论
本文建立的针对猪圆环病毒2型和3型的TaqMan双重荧光定量检测方法,可以同时、快速、特异性地检测出PCV2和PCV3,通过对其的试验检测,结果显示,该检测方法特异性良好,仅能检测出PCV2和PCV3阳性,其他病毒均为阴性。最低检测极限PCV2和PCV3均能达到10 拷贝·μL,灵敏性良好。组内和组间的变异系数均小于2%,可重复性良好。181份来自浙江省临床样品的PCV2和PCV3的检测阳性符合率分别为98.91%和97.06%,PCV2和PCV3混合感染阳性符合率为95.45%,适用于临床样品的检测。因此,本研究建立的PCV2和PCV3双重荧光定量检测方法对于临床上的早期检测具有一定实际意义,对于PCV2和PCV3的预防和控制具有重要价值。
——一道江苏高考题的奥秘解读和拓展

