辽东地区胡桃楸人工林根际和非根际土壤细菌多样性
吴光伟,傅靖棋,赫亮亮,范新蕊,苏治鑫,朱 瑞,孙建文,张丽杰
(1.沈阳农业大学林学院/辽宁省林木遗传育种与培育重点实验室,沈阳 110161;2.辽宁省检验检测认证中心,沈阳 110032;3.抚顺县三块石林场,辽宁 抚顺 113108;4.抚顺市林业发展服务中心,辽宁 抚顺 113006)
土壤微生物是森林生态系统的重要组成部分,在土壤形成、有机质合成与分解、物质转化与能量传递等方面具有调控作用[1-7]。而细菌作为土壤微生物中最丰富的类群,以其对环境变化的敏感性和活跃性成为影响土壤健康的重要指示指标[8-14];在森林生态系统中,细菌群落及多样性不仅影响着土壤养分及有机质的变化,而且也影响着树木的生长发育,参与了物种更新及植物群落演替的过程[15-18];同时,森林凋落物、根系分泌物以及微环境也影响着土壤理化性质及土壤微生物群落分布[19-21]。因此,植物根系、土壤环境及土壤微生物之间相互影响形成稳定的互惠关系促进树木的生长发育[22-23]。
胡桃楸(Juglans mandshurica)为胡桃科胡桃属落叶乔木,是我国东北地区珍贵的阔叶乡土树种,也是东北地区重要的木本油料树种[24-26]。由于过度采伐等因素的干扰使胡桃楸天然林日益减少,已被列为国家Ⅱ级珍稀濒危树种[26-28]。在辽东山区现有天然林中,胡桃楸中幼林占有大部分比例,且多为萌生林,其干形、分叉较多,成材率降低。因此,大力发展胡桃楸人工林,培育速生优质大径材成为当前迫切任务[29]。目前关于胡桃楸的研究主要集中在林分分布规律[30]、次生林物种组成及多样性[31]、地位指数[32]、天然林优树选择及果实多样性[33]、生殖生物学[34-35]、花芽发育物质代谢[36]和化学物质[37-39]等方面,而有关辽东山区胡桃楸示范林土壤微生物细菌群落多样性未见报道。因此,本研究选取2017年在辽宁省抚顺县三块石林场建立的胡桃楸示范林根际和非根际土壤,通过Illumina NovaSeq 高通量测序技术分析土壤细菌多样性及群落结构与土壤理化性质的相关性,以期阐明胡桃楸人工林土壤细菌微生物多样性,为培育速生优质胡桃楸大径材林木提供理论依据。
1 材料与方法
1.1 研究区概况
研究地位于辽宁省抚顺县三块石林场长水沟11 林班26 小班(东经124°21'~125°38',北纬41°45'~42°28')。研究地年平均气温6.04℃,年均降水886.4mm,全年无霜期145d。该地区土壤类型为暗棕色森林土,气候类型为温带大陆性季风气候。
1.2 材料
2020年5月初,在人工示范林内分别设置3 块15m×15m的样方,在每个样方内沿S形路径随机设置10个采集地点,去除表层土壤,根际土取样时先将3a 生胡桃楸苗木挖出,自然抖落法收集根际土壤,距离根系大于1cm的土壤记为非根际土壤,将采集的土壤放入自封袋中做好标记放入冰盒,用于土壤微生物高通量测序以及土壤理化性质的测定。
1.3 试验方法
采用pH 计测定土壤pH 值;使用元素分析仪测定土壤全碳(TC)、全氮(TN)和速效氮(AN)含量;使用H2SO4-HClO4酸溶法测定全磷(TP)含量;使用NH4F-HCl 测定有效磷(AP)含量[39]。土壤基因组DNA 采用试剂盒法(MO BIO Laboratories, Carlsbad, CA, USA)提取,应用细菌16S V4-V5 区引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和909R(5'-CCCCGYCAATTCMTTTRAGT-3')进行PCR 扩增和构建文库,使用Illumina 测序平台进行上机测序。
1.4 数据处理方法
使用SPSSV22.0 软件进行数据处理及分析,用皮尔逊相关系数评价土壤的理化性质与细菌多样性指数的相关性,以及优势细菌类群与土壤理化性质之间的相关性。
2 结果与分析
2.1 胡桃楸人工示范林土壤的理化性质
由表1可知,示范林根际土壤pH为6.15,极显著高于非根际土壤;根际土壤全碳含量为28.65g·kg-1,显著高于非根际土壤;根际土壤全氮含量为2.37g·kg-1,显著高于非根际土壤;根际土壤速效氮含量为284.73mg·kg-1,低于非根际土壤;根际土壤全磷含量为0.94g·kg-1,极显著高于非根际土壤;根际土壤有效磷含量为12.82mg·kg-1,极显著高于非根际土壤。

表1 胡桃楸示范林地土壤理化性质Table 1 Physical and chemical properties of soil in Juglans mandshurica demonstration forest land
2.2 胡桃楸人工示范林土壤细菌多样性
由表2 可知,示范林地胡桃楸根际土壤细菌香农指数为6.55,显著高于非根际土壤;根际土壤细菌ACE 指数为2112.60,显著高于非根际土壤;Chao1指数为1985.72,极显著高于非根际土壤。
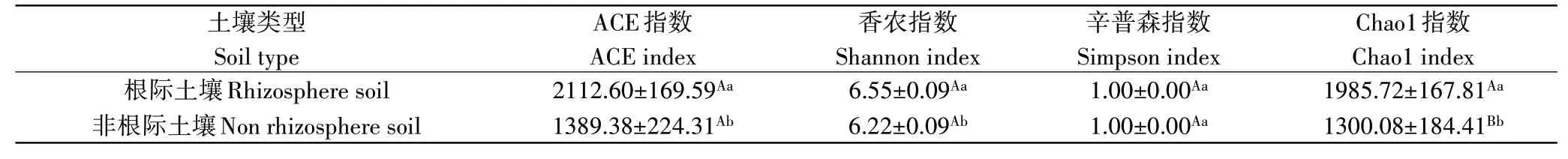
表2 示范林地胡桃楸土壤细菌α多样性指数Table 2 Bacteria diversity index of Juglans mandshurica demonstration forest land
2.3 胡桃楸人工示范林土壤细菌α多样性与土壤理化性质相关性分析
由图1可知,示范林地胡桃楸土壤细菌的香农指数与土壤pH、全磷含量和有效磷含量呈极显著正相关(r=0.959,p<0.01;r=0.955,p<0.01;r=0.925,p<0.01),且与土壤全碳含量和全氮含量呈显著正相关(r=0.903,p<0.05;r=0.917,p<0.05);ACE 指数与土壤pH、全磷含量和有效磷含量呈极显著正相关(r=0.949,p<0.01;r=0.971,p<0.01;r=0.931,p<0.01),且与土壤全碳含量和全氮含量呈显著正相关(r=0.903,p<0.05;r=0.914,p<0.05);Chao1指数与土壤pH、全磷含量和有效磷含量呈极 显 著 正 相 关(r=0.957,p<0.01;r=0.964,p<0.01;r=0.944,p<0.01),且与土壤全碳含量和全氮含量呈显著正相关(r=0.895,p<0.05;r=0.909,p<0.05);辛普森指数与土壤pH、全碳含量、全磷含量和有效磷含量呈极显著正相关(r=0.937,p<0.01;r=0.963,p<0.01;r=0.968,p<0.01;r=0.945,p<0.01;r=0.881,p<0.01)。

图1 土壤细菌α多样性指数与土壤理化性质的Pearson相关性分析Figure 1 Pearson correlation analysis between soil bacteria α diversity index and soil physical and chemical properties
2.4 胡桃楸人工示范林土壤细菌群落丰度分析
由图2a可知,在细菌门水平上,胡桃楸根际土壤优势细菌主要为:放线菌门(Actinobacteriota)占42.57%;变形菌门(Proteobacteria)占24.94%;酸杆菌门(Acidobacteriota)占15.00%;绿弯菌门(Chloroflexi)占4.71%;芽单胞菌门(Gemmatimonadota)占2.18%;甲基微菌门(Methylomirabilota)占1.90%;粘球菌门(Myxococcota)占1.73%。非根际土壤优势细菌主要为:放线菌门(Actinobacteriota)占41.31%;变形菌门(Proteobacteria)占23.79%;酸杆菌门(Acidobacteriota)占16.20%;绿弯菌门(Chloroflexi)占4.67%;甲基微菌门(Methylomirabilota)占2.52%;芽单胞菌门(Gemmatimonadota)占2.00%;粘球菌门(Myxococcota)占1.55%。
由图2b可知,在细菌纲水平上,胡桃楸根际土壤优势细菌分别为:嗜热油菌纲(Thermoleophilia)占26.29%;α-变形菌纲(Alphaproteobacteria)占17.45%;放线菌纲(Actinobacteria)占11.01%;γ-变形菌纲(Gammaproteobacteria)占7.49%;维氏细菌纲(Vicinamibacteria)占7.21%;酸杆菌纲(Acidobacteriae)占3.52%;KD4_96 占2.91%;芽球菌纲(Blastocatellia)占2.57%;MB_A2_108 占2.53%,酸微菌纲(Acidimicrobiia)占2.42%;芽单胞菌纲(Gemmatimonadetes)占2.08%;甲基微菌纲(Methylomirabilia)占1.90%。非根际土壤优势细菌主要为:嗜热油菌纲(Thermoleophilia)占27.26%;α-变形菌纲(Alphaproteobacteria)占17.06%;放线菌纲(Actinobacteria)占8.99%;维氏细菌纲(Vicinamibacteria)占7.06%;γ-变形菌纲(Gammaproteobacteria)占6.73%;酸杆菌纲(Acidobacteriae)占4.64%;KD4_96 占2.86%;芽球菌纲(Blastocatellia)占2.84%;MB_A2_108 占2.65%;甲基微菌纲(Methylomirabilia)占2.52%;酸微菌纲(Acidimicrobiia)占2.06%;芽单胞菌纲(Gemmatimonadetes)占1.94%。

图2 示范林地胡桃楸土壤细菌群落相对丰度Figure 2 Relative abundance of Juglans mandshurica soil bacterial community in demonstration forest land
由图2c 可知,在细菌目水平上,根际土壤优势细菌分别为:盖勒氏菌目(Gaiellales)占17.26%;根瘤菌目(Rhizobiales)占13.97%;土壤红杆菌目(Solirubrobacterales)占8.28%;维氏细菌目(Vicinamibacterales)占6.56%;伯克氏菌目(Burkholderiales)占4.59%;法兰克目(Frankiales)占3.94%;芽单胞菌目(Gemmatimonadales)占2.08%;拟单胞菌目(Pyrinomonadales)占2.01%;罗氏杆菌目(Rokubacteriales)占1.88%;酸杆菌目(Acidobacteriales)占1.84%;小单孢菌目(Micromonosporales)占1.74%;黄单胞菌目(Xanthomonadales)占1.62%;IMCC26256占1.52%;丙酸杆菌目(Propionibacteriales)占1.17%。非根际土壤优势细菌主要为:盖勒氏菌目(Gaiellales)占18.64%;根瘤菌目(Rhizobiales)占14.12%;土壤红杆菌目(Solirubrobacterales)占7.98%;维氏细菌目(Vicinamibacterales)占6.40%;伯克氏菌目(Burkholderiales)占3.99%;法兰克目(Frankiales)占3.47%;罗氏杆菌目(Rokubacteriales)占2.51%;酸杆菌目(Acidobacteriales)占2.45%;拟单胞菌目(Pyrinomonadales)占2.32%;芽单胞菌目(Gemmatimonadales)占1.94%;黄单胞菌目(Xanthomonadales)占1.52%;IMCC26256 占1.32%;小单孢菌目(Micromonosporales)占1.27%;丙酸杆菌目(Propionibacteriales)占1.03%。
由图2d可知,在细菌科水平上,根际土壤优势细菌分别为:黄色杆菌科(Xanthobacteraceae)占11.07%;盖勒氏菌科(Gaiellaceae)占4.67%;67_14占4.20%;土壤红杆菌科(Solirubrobacteraceae)占4.08%;芽单胞菌科(Gemmatimonadaceae)占2.08%;核单胞菌科(Pyrinomonadaceae)占2.01%;小单孢菌科(Micromonosporaceae)占1.74%;热酸菌科(Acidothermaceae)占1.61%;丛毛单胞菌科(Comamonadaceae)占1.21%;类诺卡氏菌科(Nocardioidaceae)占1.17%;亚硝化单胞菌科(Nitrosomonadaceae)占1.14%,黄单胞菌科(Xanthomonadaceae)占1.03%。非根际土壤优势细菌主要为:黄色杆菌科(Xanthobacteraceae)占11.74%;盖勒氏菌科(Gaiellaceae)占5.12%;67_14占4.62%;土壤红杆菌科(Solirubrobacteraceae)占3.36%;芽单胞菌科(Gemmatimonadaceae)占1.94%;核单胞菌科(Pyrinomonadaceae)占2.32%,小单孢菌科(Micromonosporaceae)占1.27%;热酸菌科(Acidothermaceae)占1.72%,类诺卡氏菌科(Nocardioidaceae)占1.03%。
由图2e可知,在细菌属水平上,根际土壤优势细菌属分别为:盖勒氏菌属(Gaiella)占4.67%;束缚菌属(Conexibacter)占2.14%;慢生根瘤菌属(Bradyrhizobium)占2.05%;RB41 占2.01%,嗜酸栖热菌属(Acidothermus)占1.61%,红游动菌属(Rhodoplanes)占1.44%,土壤红杆菌属(Solirubrobacter)占1.30%,游动放线菌属(Actinoplanes)占1.03%。非根际土壤优势细菌主要为:盖勒氏菌属(Gaiella)占5.12%;束缚菌属(Conexibacter)占1.86%;慢生根瘤菌属(Bradyrhizobium)占2.31%;RB41 占2.32%,嗜酸栖热菌属(Acidothermus)占1.72%,红游动菌属(Rhodoplanes)占1.51%。
2.5 胡桃楸土壤优势细菌类群与土壤理化性质的相关性
由图3可知,土壤微生物中放线菌门(Actinobacteriota)和变形菌门(Proteobacteria)与土壤pH、全磷含量、全氮含量和有效磷含量呈正相关,且与土壤速效氮含量呈负相关;酸杆菌门(Acidobacteriota)与土壤理化性质呈负相关(土壤速效氮含量除外);绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)和粘球菌门(Myxococcota)与土壤pH、土壤全碳含量和全氮含量呈正相关;甲基微菌门(Methylomirabilota)与土壤pH 呈显著负相关(r=-0.916,p<0.05),与土壤有效磷含量呈极显著负相关(r=-0.925,p<0.01)。

图3 土壤优势细菌门类群与土壤理化性质相关性分析Figure 3 Correlation analysis between dominant bacterial phyla groups and soil physical and chemical properties
3 讨论与结论
大量研究表明,不同林型和物种均会不同程度地影响根际与非根际土壤理化性质。丁新景等[41]通过对黄河三角洲刺槐根际与非根际细菌结构及多样性研究发现,刺槐根际与非根际土壤pH、电导率、土壤含水量、硝态氮和速效钾含量差异不显著;根际土壤中有机质含量、碱解氮、有效磷以及可溶性有机碳和可溶性有机氮含量显著高于非根际土壤。周乃富等[42]通过对油茶林地土壤养分进行分析测定发现根际土壤有效磷的含量明显高于非根际土壤;苟小林等[43]对不同气候区的两种优势植物根际土壤养分特征进行研究发现根际与非根际土壤全氮含量存在显著差异(p<0.05);戴齐等[44]通过对不同植被类型草灌根际与非根际土壤理化性质进行研究发现同一植被类型全磷含量在根际土壤中明显低于非根际土壤;李德文等[45]对杜仲根际与非根际的土壤理化性质分析得出根际土壤中的C、N、P含量均高于非根际土壤。在本研究中,通过对胡桃楸人工示范林根际和非根际土壤理化性质分析,结果表明:根际与非根际土壤理化性质具有较大的差异,根际土壤全碳、全氮含量均显著高于非根际土壤(p<0.05),根际土壤全磷含量、土壤pH 值以及有效磷含量和胡桃楸非根际土壤达到极显著水平差异(p<0.01),与上述研究结果一致,说明不同植被类型会影响土壤理化性质。
胡桃楸在生长过程中根系会分泌大量的有机酸、胡桃醌等物质,这些分泌物的产生会使胡桃楸根系生长范围内形成一个特殊的根际微环境,同时也影响了根际土壤微生物的种类和数量,使胡桃楸根际与非根际土壤理化性质存在较大的差异[46]。土壤微生物群落的种类和数量影响着树木对土壤中C、N 的吸收以及利用[47]。本研究利用NovaSeq 测序技术分析了辽东山区胡桃楸人工示范林内根际与非根际土壤微生物种类及多样性,结果发现:胡桃楸根际土壤微生物中细菌丰富度高于非根际土壤,在细菌门水平上主要是放线菌门(Actinobac‐teriota)、变形菌门(Proteobacteria)和酸杆菌门(Acidobacteriota),其丰富度均超过15%,是该地区胡桃楸示范林根际与非根际土壤微生物的优势菌群,这一研究结果与前人[48-50]的研究一致。柳春林等[51]通过对不同演替阶段的森林土壤细菌多样性进行研究结果表明放线菌门和变形菌门以及酸杆菌门是细菌中主要优势菌群;杜滢鑫等[52]在大庆盐碱地中选取9 种植物对其根际土壤微生物群落结构及功能多样性研究,结果显示土壤中存在的放线菌门、变形菌门和酸杆菌门是细菌中的绝对优势种;汪其同等[53]通过测定杨树人工林根际和非根际土壤微生物多样性,结果表明杨树的根际土壤细菌群落丰度高于非根际,该研究与本研究结果相一致,说明不同树种根际微生物主要菌群相对丰度类似。变形菌门与土壤碳含量呈正相关,该研究结果与前人研究结果相一致[54]。且放线菌门、变形菌门和酸杆菌门是胡桃楸根际土壤细菌中的绝对优势种,该研究结果与陈雅昕等研究结果一致[55]。变形菌门和酸杆菌门的比例是土壤养分含量的一个指标,变形菌门与营养丰富的土壤有关,它可能在土壤细菌群落的建立中起关键作用。酸杆菌门可以有效的降解植物残体,其相对丰度与土壤pH 值有关,在本研究中酸杆菌门与土壤pH值呈负相关,与刘彩霞等研究结果相一致[56]。在本研究中发现胡桃楸根际土壤细菌优势菌属中慢生根瘤菌属(Bradyrhizobium)占比例较高,而慢生根瘤菌是根瘤菌的一种,在缺氮土壤中尤为重要,其生长速度较慢,能够与部分植物形成特殊的共生关系,植物为其提供所需的能量,慢生根瘤菌可固定氮来促进植物的新陈代谢。除了这些常见的微生物外,在本研究的土壤样本中还发现了一些独特的微生物,例如嗜酸栖热菌属,通常在酸性环境中发现,但在植物根际中鲜有报道,它们的功能以及和植物之间的关系有待进一步研究。在根际土壤微生物中,有很多种类的细菌通过不同的机制影响着植物根系对土壤养分的吸收,同时与土壤理化性质之间相互制约、相互影响,树木从土壤中吸收养分并将代谢物释放到土壤中,进而影响土壤中微生物的多样性及土壤结构。本研究首次探明了辽东山区胡桃楸人工林根际和非根际土壤细菌群落多样性特征,并对土壤理化性质和土壤微生物多样性进行了相关性分析,该研究为胡桃楸人工林健康经营和培育优质速生大径材提供了理论基础。
本研究通过对示范林胡桃楸根际土壤进行高通量测序探讨根际与非根际土壤微生物多样性及群落结构与土壤理化性质之间的关系,研究得出:根际与非根际土壤理化因子差异显著,胡桃楸示范林根际和非根际土壤在门、纲、目、科、属分类水平上的优势细菌类群主要为放线菌门(Actinobacteriota)、嗜热油菌纲(Thermoleo‐philia)、盖勒氏菌目(Gaiellales)、黄色杆菌科(Xanthobacteraceae)以及盖勒氏属(Gaiella)。土壤理化因子与微生物多样性指数相关性较强。甲基微菌门(Methylomirabilota)与土壤pH 呈显著负相关(r=-0.916,p<0.05),与土壤有效磷含量呈极显著负相关(r=-0.925,p<0.01)。以土壤微生物优势细菌门类群与土壤理化性质进行相关性分析,结果表明土壤pH 值和有效磷含量是影响该地区胡桃楸人工林土壤细菌群落结构差异的主控因子。该研究结果首次揭示了辽宁东部山区人工示范林内胡桃楸土壤细菌多样性及群落结构相关性,为高效培育胡桃楸人工示范林奠定了理论基础,具有重要的实践意义。

