黄金万红膏对银屑病模型小鼠治疗效果研究
叶建州,李元策,尹力玄,尹俊林
(1.云南中医药大学第一附属医院 皮肤病专科医院,云南 昆明 500021;2.云南民族大学 民族医药学院 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500)
银屑病(psoriasis)是一种具有遗传倾向免疫介导的炎症性皮肤病[1].不同人种发病率差异较大,在全球范围内发病率为2%~3%,我国的发病率为0.13%~1.23%,近年来我国银屑病发病率在逐年升高[2].银屑病主要病理表现为表皮角质化过度及角化不全、角化不全区可见Munro微脓肿.颗粒层明显减少或消失,棘层肥厚,表皮突向下延伸,真皮乳头上方棘层变薄,毛细血管扩张,延伸并迂曲,周围可见淋巴细胞、中性粒细胞等浸润[3].临床上将银屑病分为四类:寻常型银屑病、关节病型银屑病、脓胞型银屑病及红皮病型银屑病[4].其中寻常银屑病占其中的90%[5],同时,银屑病患者并发症如糖尿病、肥胖症、心血管疾病及高胆固醇的几率也显著增高[6].临床上常用的外用治疗银屑病的药物有维生素D3类似物卡泊三醇、糖皮质激素、阿维A等,其中卡泊三醇刺激较大且价格较高,糖皮质激素长期使用导致局部皮萎缩、阿维A乳膏长期涂抹会导致皮肤干燥[7],因此目前市面上仍没有较为理想的治疗银屑病的药物.
目前对于银屑病的发病机理尚不明确,但目前的研究表明银屑病发病与自身免疫有着密切关系.对于银屑病发病机制的研究,最早的时候研究发现银屑病患者体内的interferon(IFN-γ)、tumor necrosis factorα(TNF-α)、interleukin 2(IL-2)、IL-1、IL-12等T helper-1(Th1)型细胞因子高表达,所以这些细胞因子一度被认为是银屑病发病的关键因素[8].其中特别是IFN-γ,其能够上调趋化因子和粘附分子[9],将淋巴细胞集中到炎症部位并刺激树突状细胞产生IL-1和IL-23,这2种炎症因子与银屑病严重程度明显相关[10].外源刺激可以影响CD4+中Th1和Th2的比例,其中银屑病患者中炎症性Th1细胞显著增加,Th2细胞数量相对减少[11].
近年来从T细胞中发现了新的Th17类型,其通过分泌IL-17和IL-22等细胞因子,作用于上皮部分的CD11c+树突状细胞(DCs)[12],进而能够刺激其分泌各种细胞因子,刺激角质形成细胞KC过度增殖.随后又发现Th17/Treg比例的改变可以刺激树突状细胞分泌细胞因子,造成角质细胞过度增殖,单核细胞浸润等症状.
最近对于银屑病发病机制的研究集中在IL-23/Th17作用轴上,其作用机制首先是真皮中DCs细胞产生IL-23活化Th17细胞,并使其产生并释放Th17类的细胞因子,如IL-17A、IL-17F、IL-22等促炎性的细胞因子,这些细胞因子作用于角质形成细胞KC上,使KC细胞产生抗菌肽、趋化因子以及多种细胞因子,进一步维持和加重银屑病的症状[13].在这个过程中KCs与免疫细胞相互作用,互相刺激形成了正向循环.
黄金万红膏是云南中医药大学第一附属医院制备的一种用于治疗皮肤病的医院中药制剂,应用于临床数十年[14],由紫草、地黄、黄连、当归、虎杖、冰片等制成.具有清热解毒、祛腐生肌的功效,用于烧伤、烫伤、婴儿红臀属热毒内盛者.动物试验表明黄金万红膏对豚鼠完整皮肤及破损皮肤均无刺激[15],在临床实际应用中发现对多种皮肤病具有良好的治疗效果,在近30年的临床治疗对银屑病有较显著的疗效.
为探索黄金万红膏在小鼠实验中对银屑病的疗效机制,本文利用IMQ诱导的银屑病小鼠模型,对黄金万红膏治疗银屑病的药效学进行研究.为进一步深入探索万红膏的功效提供理论基础.
1 材料和方法
1.1 材料
1.1.1 实验动物
体重18~22 g,Babl/c小鼠,周龄为6~8周,雌雄各半(湖南斯莱克景达实验动物有限公司).
1.1.2 试剂及仪器
黄金万红膏(云南省中医医院);脱毛膏(广州梦希蓝化妆品有限公司);凡士林乳膏(山东德新康医疗科技有限公司);咪喹莫特乳膏(四川明欣药业有限责任公司);卡泊三醇乳膏(利奥制药有限公司,爱尔兰);IL-17、IL-22、TNF-α ELISA试剂盒(杭州联科生物技术股份有限公司);DMIL LED三目倒置显微镜(Leica,德国);SpectraMax i3x酶标仪(Molecular Devices,美国).
1.2 方法
1.2.1 动物模型建立
将60只18~22 g,6~8周,雌雄各半Babl/c小鼠分为空白对照组10只,模型组50只.在小鼠背部用脱毛膏脱毛形成 2 cm×3 cm 的造模区域,观察两日无新毛长出后,模型组每只每日均匀涂抹5%咪喹莫特乳膏 62.5 mg 于背部造模区域,空白对照组每天涂抹等量凡士林连续涂抹6日.造模完成后观察是否有云母状鳞屑、红斑及角质增厚等症状.
1.2.2 银屑病模型动物的治疗
造模成功后将50只模型组小鼠分为万红膏高剂量组(200 mg/d)、万红膏中剂量组(100 mg/d)、万红膏低剂量组(50 mg/d)、卡泊三醇组(200 mg/d)、咪喹莫特组,每组10只.万红膏高剂量组每只每天涂抹 200 mg 万红膏、中剂量组每天涂抹 200 mg(质量比,凡士林∶万红膏=1∶1)混合制剂、低剂量组每天涂抹 200 mg(质量比,凡士林∶万红膏=3∶1)混合制剂、卡泊三醇组每天涂抹 200 mg 5%卡泊三醇乳膏、咪喹莫特组每天涂抹 200 mg 凡士林,除此之外,各模型组每天继续涂抹 62.5 mg 5%咪喹莫特乳膏维持银屑病症状.空白对照组每只每天共涂抹 262.5 mg 凡士林.治疗结束后观察各组小鼠的背部造模区域的银屑病症状,观察各组间的表观差异.初步简单判断给药组是否对小鼠银屑病有治疗效果.
1.2.3 小鼠体重测量
在小鼠治疗过程中每天对各组小鼠体重进行测量并记录,取每组平均值,绘制成折线图,并利用数据分析软件对各组数据进行差异显著性分析.
1.2.4 PASI评分
在银屑病小鼠治疗过程中,观察其小鼠银屑病症状,并根据小鼠PASI评分标准进行打分.PASI评分主要分为鳞屑、红斑和角质增厚3部分,每个部分从无到全覆盖为0~4分(表1).取每组的平均值,绘制成折线图,观察各治疗组于模型组之间的差异,进行差异显著性分析.
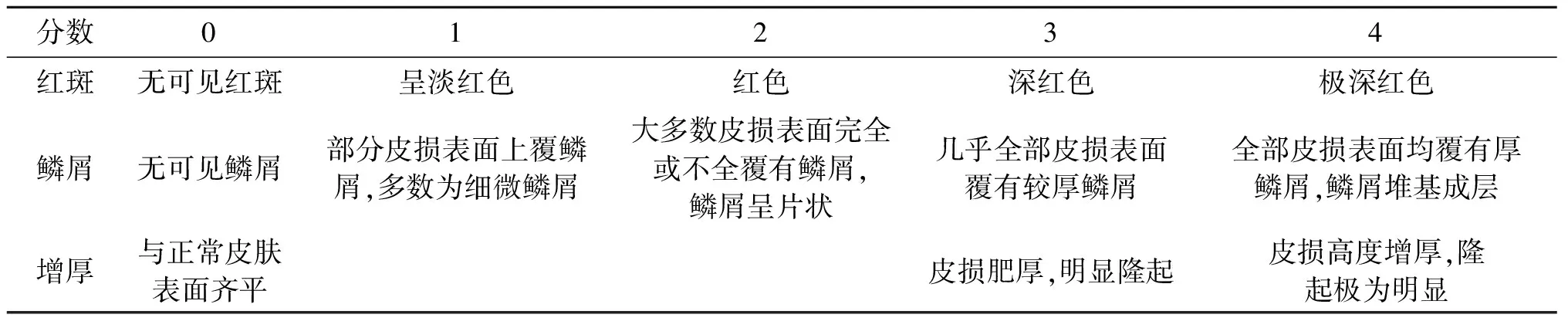
表1 银屑病PASI评分标准
1.2.5 小鼠银屑病组织病理学观察
于治疗 6 d 后取小鼠背部造模区域皮肤组织,浸泡于福尔马林中 24 h,置于包埋盒内自来水冲洗 1 h.分别浸泡于75 %、85 %、95 %、100 %乙醇、二甲苯中脱水 1 h,共 5 h.石蜡浸泡3次,每次 40 min,共 2 h.包埋后,放到冰上静置.将包裹好的蜡块切成 4 nm 蜡片,平铺于载玻片上,苏木素浸染 5 min.冲洗2次,0.5 %盐酸酒精分化 3 s.冲洗2次,伊红染色 2 min.冲洗1次,蒸馏水漂洗2次,每次 30 s.接着用85%、95%乙醇分别泡 2 min,100 %乙醇泡2次,每次 2 min,二甲苯浸泡2次,每次 5 min.吹干,中性树胶封片,显微镜下观察.
1.2.6 q-PCR检测小鼠背部造模组织IL-17A、IL-17F、IL-23 mRNA表达量
将组织液氮低温粉碎后加入RNAios Plus(TaKaRa,9109),室温静置 5 min.移入 1.5 mL 离心管,吹匀后加入 100 μL 氯仿,混匀静止 10 min.4 ℃,12 000 r/min 离心 10 min,弃上清.加入 200 μL 异丙醇,冰上静止 10 min,离心.加入 500 μL 75 %乙醇.离心 10 min 去上清.按HIScript Ⅲ RT SuperMix for qPCR(Vazyme,R323-01)试剂盒步骤进行反转,去除gDNA、反转录为cDNA,加入引物、DNA模板等在定量PCR仪上进行q-PCR检测(见表2).
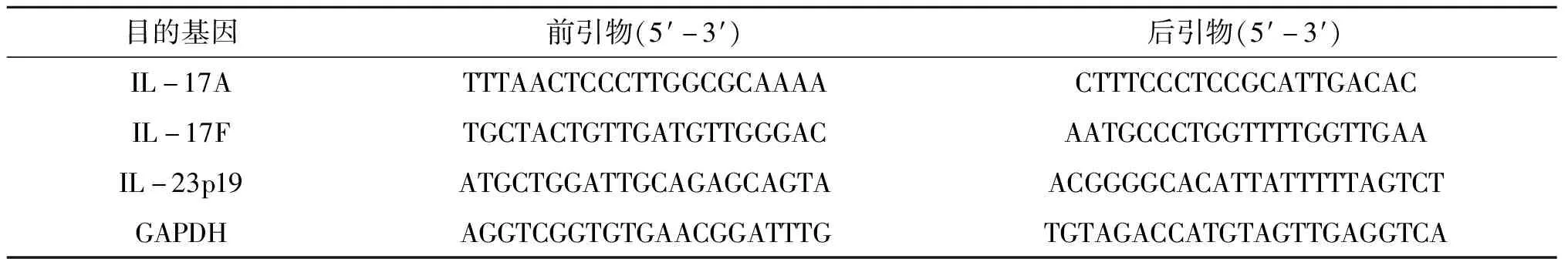
表2 q-PCR检测引物序列
1.2.7 ELISA法检测小鼠血清中IL-17A、TNF-α、IL-22的含量
实验结束后,采用眼球取血法取走小鼠血液,静置 30 min 后离心提取血清.分别将标准品和样品加入ELISA试剂盒(联科生物,EK222HS-96;EK282HS-96;EK217HS-96)的反应孔中(100 μL/孔),封板胶封孔,37 ℃ 孵育 90 min.洗板4次,加入生物素化抗体工作液.洗板4次,加入酶结合物工作液(100 μL/孔).洗板4次,加入显色剂(100 μL/孔),37 ℃ 孵育10~20 min.加入终止液(100 μL/孔),混匀后即刻测量OD450值(5 min 内).以标准品浓度为横坐标,OD值为纵坐标,用计算机软件进行回归拟合生成标准曲线.将测得的样品OD值带入到标准曲线中算出样品浓度.
1.2.8 统计学处理
实验数据以平均值±标准误差表示,用 SPSS 17.0 软件进行数据分析.采用student t检验对各治疗组与IMQ组进行差异显著性检测,*P<0.05,**P<0.01,***P<0.001.
2 结果
2.1 小鼠体重变化结果
从小鼠的治疗过程中体重变化结果显示,雌鼠雄鼠变化差异一致,无明显性别差异.空白对照组在第0、3、6天,小鼠体重分别为(23.22±1.04)g、(22.71±1.14)g、(23.48±1.18)g上升了1%,说明小鼠体重在治疗过程中无明显变化;黄金万红膏高剂量组在第0、3、6天,小鼠体重分别为(18.79±1.10)g、(19.39±1.07)g、(19.5±1.33)g上升了3.7%,说明小鼠体重在治疗过程中无明显变化;黄金万红膏中剂量组在第0、3、6天,小鼠体重分别为(17.86±0.94)g、(18.6±0.89)g、(18.00±0.89)g,上升了0.7%,说明小鼠体重在治疗过程中无明显变化;黄金万红膏低剂量组在第0、3、6天,小鼠体重分别为(18.98±0.76)g、(18.86±0.86)g、(17.67±1.43)g,下降了6%,说明小鼠体重在治疗过程中无明显变化;卡泊三醇组组在第0、3、6天,小鼠体重分别为(19.61±1.24)g、(18.83±1.12)g、(16.54±0.97)g,说明小鼠体中在治疗过程中从第3天开始出现明显下降,共降低15.6%.以上实验结果说明卡泊三醇对小鼠体重具有降低作用,黄金万红膏对小鼠体重无明显影响.见图1A图,图1所有数据来源于10次独立实验,所得数据以均mean±SE表示,各组与卡泊三醇组进行T检验,*P< 0.05,**P< 0.01,***P< 0.001.
2.2 小鼠表观症状及PASI评分结果
小鼠表观症状PASI评分结果显示:黄金万红膏高剂量组在第0、3、6天PASI评分分别为10.66±0.21、2.16±0.16、1.16±0.40;黄金万红膏中剂量组在第0、3、6天PASI评分分别为10.83±0.16、3.66±0.21、2±0.25;万红膏低剂量组在第0、3、6天PASI评分分别为10.83±0.16、4.66±0.49、3±0.516;卡泊三醇组组在第0、3、6天PASI评分分别为10.83±0.16、3.66±0.49、2.16±0.40;模型对照组在第0、3、6天PASI评分分别为10.66±0.21、6.83±0.47、5.66±0.33;万红膏各剂量组与模型对照组相比评分明显降低.黄金万红膏高剂量组与IMQ组相比角质增厚明显降低,鳞屑 明显减少,红斑变少(见图1B).总体来看,黄金万红膏高剂量组于IMQ组之间存在显著性差异,表明黄金万红膏对银屑病的症状有明显的治疗效果.
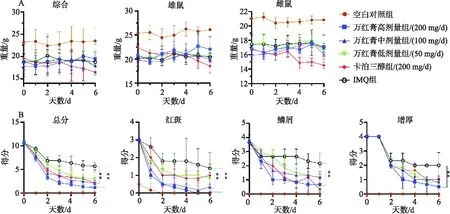
图1 治疗过程中小鼠体重变化(A)及小鼠PASI评分(B)
2.3 HE染色切片观察病理学变化结果
从图2A中可以看出相较于模型对照组IMQ组各治疗组鳞屑,A图红斑明显减少证明万红膏对小鼠银屑病模型具有一定的治疗效果.从病理切片HE染色的结果来看,黄金万红膏高、中、低3个剂量组的角化不全及角化过度相较于IMQ组有明显的减轻(图2B,蓝色箭头).黄金黄金万红膏高剂量组相对于IMQ组,棘层明显变薄,细胞层是明显减少;万红膏中剂量组相对于高剂量组,棘层变厚,但相对于IMQ组明显变薄;黄金万红膏低剂量组相对于IMQ组,棘层无明显变薄(图2B, 红色箭头).上述结果表明黄金万红膏能够减少银屑病导致的角化不全及角化过度的现象,同时能够降低棘层厚度.
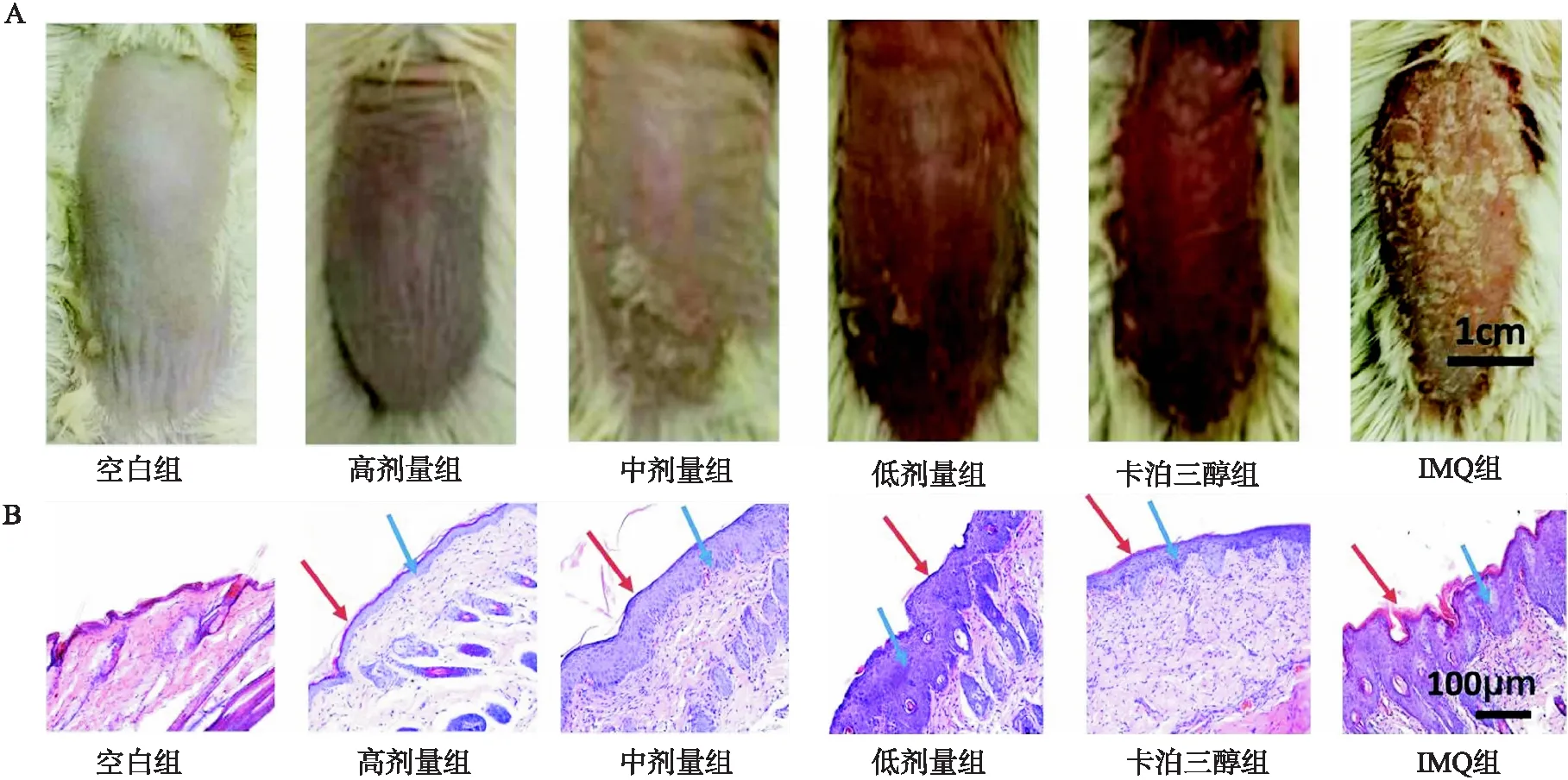
图2 为治疗结束后各组小鼠中具有代表性的图片(A)及H&E染色图(B)
2.4 q-PCR检测小鼠背部组织IL-17A、IL-17F、IL-23的mRNA的变化结果
小鼠背部组织IL-17A、IL-17F、IL-23的mRNA的变化结果显示,黄金万红膏高剂量组IL-17F mRNA相对含量为0.191±0.005,中剂量组为0.320±0.052,低剂量组为0.43±0.005,卡泊三醇组为0.015±0.005.黄金万红膏各治疗组相对于IMQ组有明显的降低,从高到低分别降低了0.809、0.68、0.57.同时随着给药量的增加IL-17F mRNA相对含量逐渐降低.黄金万红膏高剂量组的IL-23 mRNA相对含量为0.186±0.021,中剂量组为0.450±0.057,低剂量组为0.611±0.093,卡泊三醇组为0.015±0.005,万红膏各治疗组相对于IMQ组有明显的降低,从高到低分别降低了0.814、0.55、0.389,同时随着给药量的增加IL-23 mRNA相对含量逐渐降低.黄金万红膏高剂量组的IL-17A mRNA相对含量为0.325±0.055,中剂量组为0.66±0.060,低剂量组为1.245±0.175,卡泊三醇组为0.015±0.005,其中黄金万红膏高剂量组与中剂量组的IL-17A的mRNA的表达量相对于IMQ组显著降低,高剂量组降低了0.675,中剂量组降低了0.34,万红膏低剂量组略有上升.总之,黄金万红膏能够降低银屑病相关的炎症因子IL-17A、IL-23、IL-17F 的mRNA的表达(图3A).
2.5 ELISA小鼠血清中IL-17A、TNF-α、IL-22的含量结果
小鼠血清中IL-17A、TNF-α、IL-22的含量的检测结果显示,IMQ组中TNF-α含量为(447.94±89.86)pg/mL,黄金万红膏高剂量组含量为(50.10±2.56)pg/mL,中剂量组含量为(110.84±5.89)pg/mL,低剂量组含量为(113.52±20.44)pg/mL,卡泊三醇组含量为(97.19±14.09)pg/mL.黄金万红膏高剂量组中TNF-α的含量降低了 397.84 pg/mL,下降幅度为88.81%.IMQ组中IL-22的含量为(53.01±0.537)pg/mL,万红膏高剂量组的含量为(33.07±7.153)pg/mL,黄金万红膏中剂量组的含量为(47.97±8.742)pg/mL,万红膏低剂量组的含量为(48.03±1.773)pg/mL,卡泊三醇组的含量为(39.28±6.063)pg/mL,其中万红膏高剂量组中IL-22的含量下降了19.94 IL-22的含量pg/mL,下降幅度为37.6%.IMQ组中IL-17A的含量为(57.13±1.737)pg/mL,万红膏高剂量组的含量为(11.65±1.076)pg/mL,万红膏中剂量组的含量为(14.17±2.612)pg/mL,万红膏低剂量组的含量为(16.10±3.606)pg/mL,卡泊三醇组的含量为(4.31±0.592)pg/mL,其中万红膏高剂量组中IL-17A的含量降低了 45.48 pg/mL,下降幅度为79.6 %(图3B).万红膏各剂量组中TNF-α及IL-17A的含量均显著下降,万红膏高剂量组中IL-22的含量显著下降,说明万红膏能够降低血清中TNF-α、IL-17A及IL-22的含量.图3所有数据来源于10次独立实验,所得数据以均mean±SE表示,各治疗组与IMQ组对比进行t检验,*P<0.05,**P<0.01,***P<0.001.
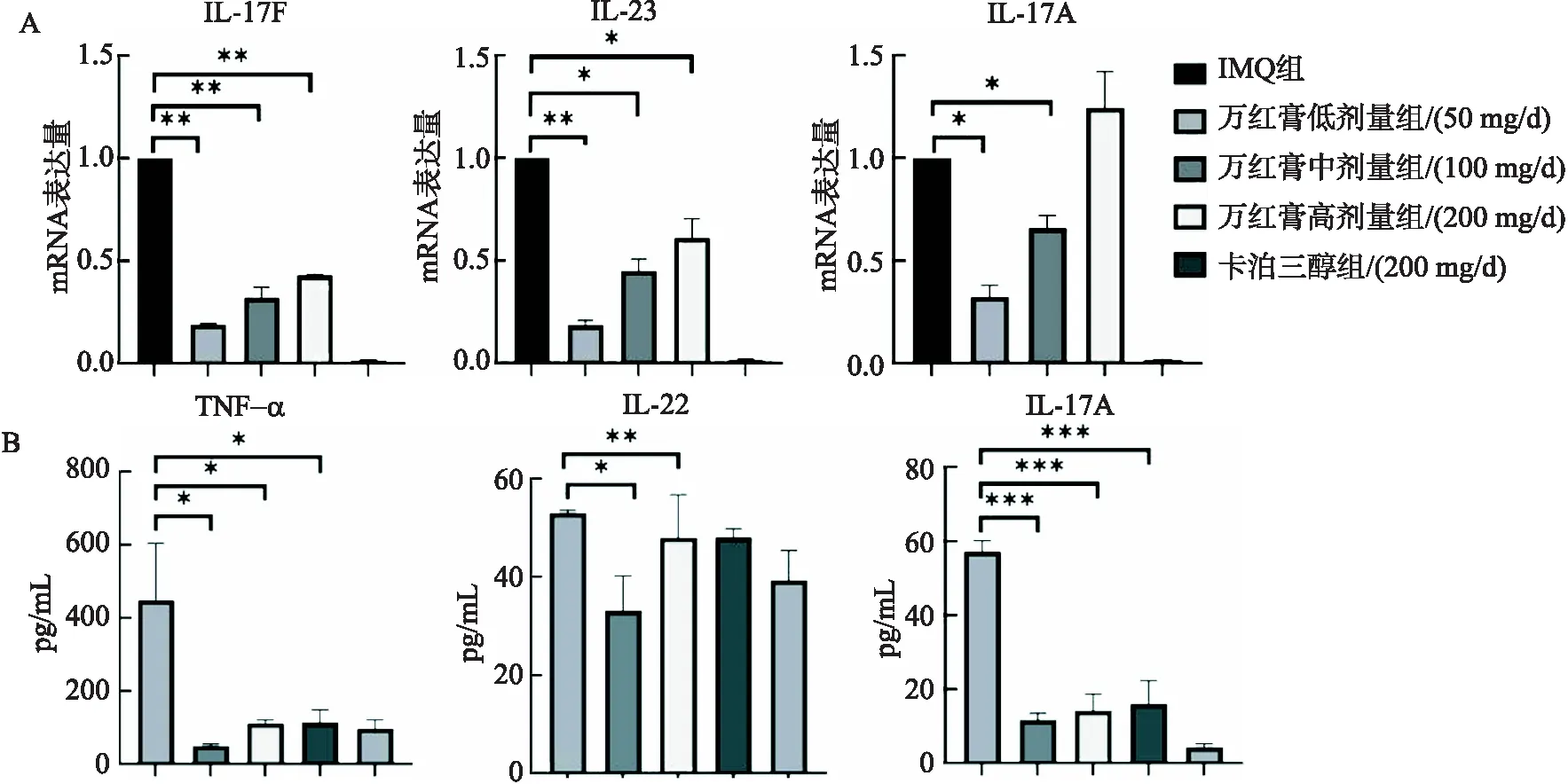
图3 各组小鼠qPCR检测造模皮肤中相关细胞因子的mRNA表达量及ELISA检测血清中相关细胞因子含量
3 结语
在治疗过程中卡泊三醇组小鼠体重出现明显下降是由于卡泊三醇具有明显的刺激以及对肾脏的副作用[16],黄金万红膏不同剂量治疗组在治疗过程中体重无明显变化,说明黄金万红膏与常用的治疗银屑病的临床药物卡泊三醇相比,对小鼠的刺激明显减轻,治疗效果更为温和.治疗后,小鼠银屑病鳞屑、角质增厚、红斑明显减少,银屑病相关的促炎因子IL-17A、IL-17F、IL-23的mRNA的表达量均下降,推测其可能是通过抑制Th17细胞的激活过程从而降低了IL-17A、IL-17F、IL-23的表达.经黄金万红膏治疗后,小鼠的TNF-α、IL-17A、IL-22的表达量均有下降,结果与mRNA检测结果一致,显示黄金万红膏能够降低TNF-α、IL-17A、IL-22等银屑病相关的炎症因子的产生.上述的分子指标均为与IL-23/Th17轴相关的炎症因子,据此推测黄金万红膏可能通过改变Th17的增殖分化来对银屑病产生影响,该研究结果将为进一步研究万红膏治疗银屑病的机制研究提供新的思路及理论基础.

