2种鳞毛蕨属植物醇提物的抗氧化、降血糖及抗炎活性
黄 瑶,李红锐,李育晓,孙静贤,熊 勇,邵金良,黄相中,田 凯
(1.云南民族大学 民族药资源化学国家民族事务委员会-教育部重点实验室,云南 昆明 650504;2.农业部农产品质量监督检验测试中心(昆明),云南 昆明 650223)
鳞毛蕨属(DryopterisAdanson)植物在我国分布广泛并多达300余种,其中已有20余种被列为药用植物[1-2].有关鳞毛蕨属植物的药理活性研究表明,该属中多种植物具有良好的驱虫[3]、抑菌[4]、抗炎[5]、抗肿瘤[6]、抗氧化以及抗病毒等活性[7].
重齿鳞毛蕨(Dryopterisjuxtaposita)与假边果鳞毛蕨(Dryopteriscaroli-hopei)具有相似的生长环境,生长于海拔 1 500-2 500 m 的山谷或溪边林下,在云南、四川、西藏南部等地均有分布.经文献调研发现,关于重齿鳞毛蕨和假边果鳞毛蕨的化学成分和药理活性的研究较少,杨申明等[8]采用75%乙醇按料液比(m/v,1∶12)回流提取 3 h 得到重齿鳞毛蕨的粗提物并通过分光光度法测得黄酮类化合物提取率可达1.05%.由于黄酮类化合物是普遍存在于蕨类植物中的一类化学成分,不同种蕨类植物的总黄酮含量各有不同,且总黄酮成分复杂不同植物之间化学成分的结构也会存在差异,进而导致各植物的药理活性也将存在差异[9].重齿鳞毛蕨和假边果鳞毛蕨在云南地区资源丰富,为了更好地开发和利用这2种蕨类植物,文中采用95%的乙醇回流提取重齿鳞毛蕨和假边果鳞毛蕨药材获得乙醇提取物,通过DPPH法、ABTS法、pNPG法以及脂多糖诱导RAW264.7巨噬细胞所建立的炎症模型探究其抗氧化、降血糖和抗炎活性,为重齿鳞毛蕨和假边果鳞毛蕨更深入的研究与利用提供参考.
1 材料与方法
1.1 材料与仪器
实验所用重齿鳞毛蕨(Dryopterisjuxtaposita)与假边果鳞毛蕨(Dryopteriscaroli-hopei)均采自云南省新平县,经云南大学陆树刚教授鉴定;1,1-二苯基-2-苦肼基自由基(DPPH)(梯希爱化成工业发展有限公司);2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺)二氨盐(ABTS)(梯希爱化成工业发展有限公司);阿卡波糖(百灵威科技有限公司);脂多糖(LPS)(Sigma公司);α-葡萄糖苷酶(Sigma公司);RAW264.7细胞系(中国科学院昆明动物研究所);磷酸盐缓冲液(PBS)(上海源培生物科技股份有限公司);NO检测试剂盒(碧云天生物技术公司);4-硝基苯-α-D-吡喃葡萄糖苷(pNPG)(Sigma公司);无水乙醇(天津市致远化学试剂有限公司);DMSO(天津市致远化学试剂有限公司);CY-500A型高速多功能粉粹机(上海塞耐机械有限公司);多功能酶标仪(昆明友宁科技有限公司);HH-4数显恒温水浴锅(金坛市富华仪器有限公司).
1.2 实验方法
1.2.1 重齿鳞毛蕨和假边果鳞毛蕨乙醇提取物的制备
重齿鳞毛蕨和假边果鳞毛蕨的全草干燥后粉碎,分别称取粗粉 20.0 g,用体积分数为95%乙醇回流提取3次,每次提取时间为 2 h,弃除滤渣并对滤液进行收集,通过减压蒸馏分别得重齿鳞毛蕨乙醇提取物(DJE)和假边果鳞毛蕨乙醇提取物(DCE).
1.2.2 清除DPPH自由基的活性
参照文献[10],分别将DJE和DCE用无水乙醇配制质量浓度为:5.0、10.0、20.0、40.0、60.0、80.0、100.0 μg/mL 的样品待测液,取 2.0 mL 不同质量浓度的DJE和DCE各待测溶液,加入 2.0 mL DPPH(0.2 mmol/L)溶液,将溶液充分摇匀后于室温下进行避光反应,时间为 30 min,反应结束后立即用多功能酶标仪于 517 nm 处测定其吸光度值(A),每组实验分别设置3组平行实验.阳性对照组(Vc)、样品背景组和空白对照组采用同样的实验操作进行测定.
DPPH自由基清除率S(%)=[1-(A1-A2)/A0]×100,
式中,吸光度A0为 2.0 mL 无水乙醇+2.0 mL DPPH溶液;吸光度A1为 2.0 mL 待测样品+2.0 mL DPPH溶液;吸光度A2为 2.0 mL 待测样品+2.0 mL 无水乙醇.
1.2.3 清除ABTS自由基的活性
参照文献[11]的方法,精确称取适量的DJE和DCE,按一定的梯度将其质量浓度分别配制为5.0、10.0、20.0、40.0、60.0、80.0、100.0 μg/mL,分别取DJE和DCE各待测液 0.2 mL 加入到含有 0.8 mL ABTS+工作液的试管,将其充分混匀后于室温下进行反应,时间为 6 min,反应结束后立即用多功能酶标仪于 734 nm 处测定其吸光值(A).每组实验分别设置3组平行实验,以Vc为阳性对照.
ABTS自由基清除率S(%)=(A1-A2)/A1×100,
式中,吸光度A1为 0.2 mL 无水乙醇+0.8 mL ABTS工作液;吸光度A2为 0.2 mL 样品+0.8 mL ABTS工作液.
1.2.4 抑制α-葡萄糖苷酶的活性
实验方法参照文献[12-14]并进行了一定的改动,各化合物采用96孔板对其进行活性测定.将待测的样品用DMSO配制成终质量浓度为:0.8、1.6、3.2、6.4、12.8、25.6、51.2 μg/mL 的样品待测液,实验中设置酶活性组、酶空白组、实验组、实验对照组,阳性对照为阿卡波糖.具体实验反应体系如下表:
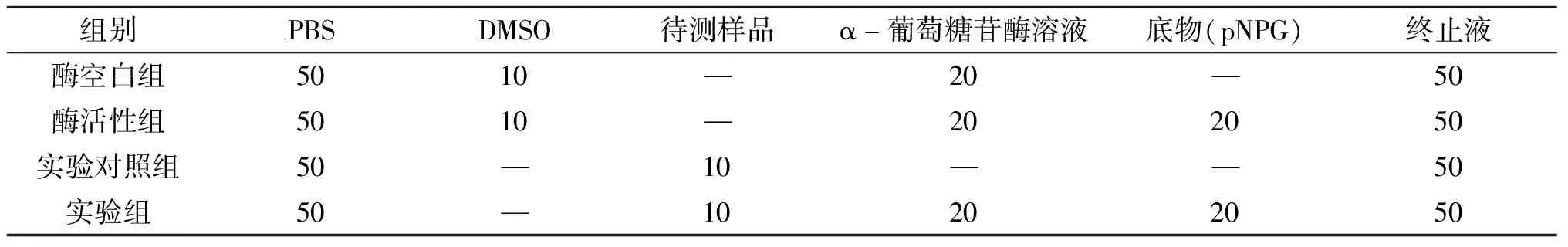
表1 待测样品反应体系各组成的体积 μL
各组加入底物之前先将反应体系于 37 ℃ 进行恒温孵育,时间为 5 min,加入底物后继续将反应体系于相同温度下孵育 15 min 后向各反应体系中加入终止液.实验中各组分别设置3个复孔,各孔的总反应体积为 150 μL,其中总体积不足的组分采用PBS进行补足.采用多功能酶标仪于 400 nm 处测定吸光度值(A).
α-葡萄糖苷酶抑制率(%)=[1-(A实验-A对照实验)/(A酶活性-A酶空白)]×100.
1.2.5 体外抗炎活性的测定
1)DJE和DES对RAW264.7细胞毒活性测定
参照文献[15]的方法,将处于对数生长期的RAW264.7细胞加入胰蛋白酶进行消化,制成细胞悬液,并将细胞的密度调整为 1×105个/L,以 200 μL/每孔接种于96孔培养板中,在条件为 37 ℃、5% CO2的培养箱中进行培养,时间为 24 h.培养结束后,分别将DJE和DES待测样品(终质量浓度为:6.25、12.50、25.00、50.00、100.00和 200.00 μg/mL 加入培养板中(50 μL/每孔),每个样品的各个浓度设置3个复孔.加样结束后放回培养箱继续进行培养,时间为 24 h,之后将浓度为 5 mg/mL 的MTT溶液分别加在各个孔中,体积为 20 μL,加样结束后再继续进行培养(4~6 h).取出96孔板,轻轻吸弃各孔上清液,再在每孔中加入DMSO溶液(150 μL),在避光和室温条件下进行振荡,时间为 15 min,振荡结束后立即用多功能酶标仪于波长 490 nm 处测定其吸光度值(A),对细胞的存活率进行计算:
细胞存活率(%)=(A样品/A空白)×100.
2)DJE和DES对LPS诱导的RAW264.7细胞NO分泌量的影响
参照文献[16]的方法,前期细胞培养方法参见(1),分别将实验配制的DJE和DCE待测液(终质量浓度为:6.25、12.50、25.00、50.00和 100.00 μg/mL)加入培养板中(50 μL/每孔),每个样品的各个浓度设置3个复孔.阳性对照组:加入L-NMMA(终质量浓度为:12.50 μg/mL).除空白组其余各组均分别以 50 μL/每孔的量加入脂多糖(LPS)刺激细胞,LPS终质量浓度为 2 μg/mL.加样结束后细胞在培养箱中继续进行培养,时间为 24 h,培养结束后分别取出各孔的上清液,并按照试剂盒的操作方法对其NO含量进行测定.
1.3 数据处理
2 结果与分析
2.1 DPPH自由基清除活性的结果
DJE和DCE对DPPH自由基的清除结果如图1所示,由实验结果可知DJE和DCE在实验质量浓度范围内(5.0~100.0 μg/mL)对DPPH自由基具有不同程度的清除活性,且二者活性均呈质量浓度依赖性,可随着质量浓度的增加而不断增强.DJE在5.0~80.0 μg/mL浓度内的活性始终弱于阳性对照(Vc),而当质量浓度达80.0~100.0 μg/mL 时,其活性与阳性对照组(Vc)相当.实验结果显示:DJE IC50值为(15.21±1.19)μg/mL清除DPPH自由基的活性强于相同浓度下的DCE IC50值为(74.29±2.03)μg/mL.
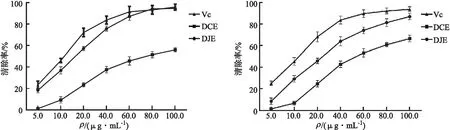
图1 DJE和DCE对DPPH自由基的清除活性 图2 DJE和DCE对ABTS自由基的清除活性
2.2 ABTS自由基清除活性的结果
DJE和DCE对ABTS自由基的清除结果如图2所示,由结果可知DJE和DCE在实验质量浓度范围内(5.0~100.0 μg/mL)对ABTS自由基的清除活性呈浓度依赖性,可随着质量浓度的增加而不断增强;当质量浓度达到 100.0 μg/mL 的时候,DJE和DCE对ABTS自由基所具有的清除率是83.7%和56.37%.在实验设定的质量浓度范围内(5.0~100.0 g/mL)阳性对照Vc对ABTS自由基的清除活性始终强于DJE和DCE,其中DJE和DCE的IC50值分别可达(25.60±2.13)μg/mL和(53.69±1.85)μg/mL.实验结果显示:在实验质量浓度范围内DJE和DCE对ABTS自由基均显示出良好的清除活性,其中DCE对ABTS自由基的清除活性明显弱于DJE.
2.3 体外抑制α-葡萄糖苷酶活性的结果
一分子pNPG经α-葡萄糖苷酶催化后可分解为一分子对硝基酚和一分子葡萄糖,对硝基酚在 400 nm 出现特征吸收峰,且pNPG和葡萄糖在该波长下吸收很弱可忽略,因此采用pNPG法测定反应体系在 400 nm 处的吸光值可用于评价待测样品对α-葡萄糖苷酶抑制能力的强弱[16].DJE和DCE两者的体外降血糖活性可根据其对α-葡萄糖苷酶的抑制活性而进行评价,其结果如表2所示.当质量浓度为(0.8~51.2)μg/mL时,待测样品DJE和DCE对α-葡萄糖苷酶具有良好的抑制作用,二者的IC50值分别可达(1.04±0.27)μg/mL和(5.73±1.18)μg/mL.与阳性对照Acarbose相比,重齿鳞毛蕨和假边果鳞毛蕨粗提物在均较低的浓度就对α-葡萄糖苷酶显示出明显的抑制作用.

表1 DJE和DCE对α-葡萄糖苷酶的体外抑制活性
2.4 体外抗炎活性的测定
2.4.1 DJE和DCE对RAW264.7细胞增殖的影响
DJE和DCE对RAW264.7细胞增殖的影响结果如图3所示,由实验结果可知,DJE和DCE在浓度为6.25~12.50 μg/mL 时对RAW264.7细胞的正常生长与繁殖没有显著的影响.随着两者质量浓度的不断增加,细胞的存活率呈现出降低的趋势,尤其是当DJE质量浓度为 200.00 μg/mL 时,RAW264.7细胞的存活率低于50%.
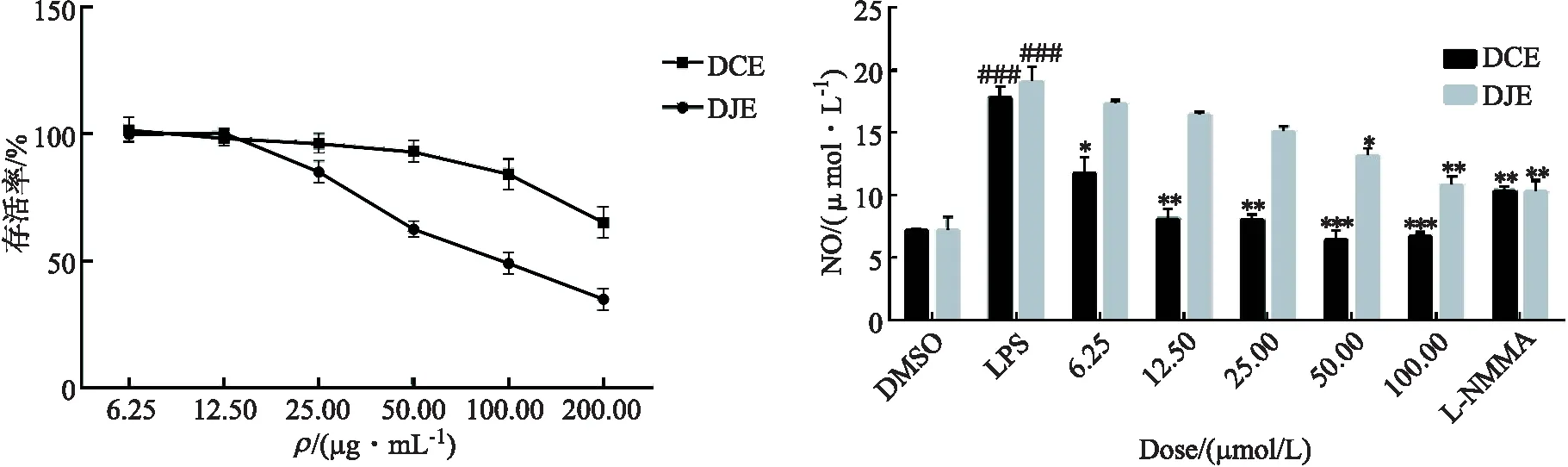
图3 DJE和DCE对RAW264.7细胞存活率的影响 图4 不同质量浓度的DJE和DCE对LPS刺激的RAW264.7细胞NO分泌量的影响
2.4.2 DJE和DCE对LPS诱导的RAW264.7细胞NO分泌量的影响
通过脂多糖诱导的小鼠巨噬细胞RAW264.7炎症模型探究DJE和DCE的抗炎活性,实验结果见图4,与空白组相比,###表示p<0.001;与模型组相比,***、**和*分别表示p<0.001、p<0.01和p<0.05.与空白组相比,模型组RAW264.7细胞经LPS诱导后分泌出大量NO(p<0.01),表明细胞模型建立成功.实验组经不同浓度的DJE和DCE待测样品干预后,NO的释放量均有不同程度的降低.综合考虑DJE和DCE对RAW264.7细胞增殖影响,在不影响细胞正常增殖的情况下,即DJE样品质量浓度为6.25~12.50 μg/mL 时以及DCE样品质量浓度为6.25~50.00 μg/mL 时,2种植物的乙醇提取物均能不同程度抑制炎症细胞释放NO,具有潜在的抗炎活性.
3 结语
DJE和DCE均有清除DPPH和ABTS自由基的活性且有浓度依赖性,2种抗氧化活性评价方法均显示DJE的抗氧化活性强于DCE,尤其是当DJE浓度为80.0~100.0 μg/mL 时,其活性与阳性对照(Vc)相当.DJE和DCE均能不同程度地抑制α-葡萄糖苷酶的活性,IC50值分别为(1.04±0.27)μg/mL 和(5.73±1.18)μg/mL.当待测样品浓度为6.25~12.50 μg/mL 时,DJE和DCE对RAW264.7细胞的正常生长与繁殖没有显著的影响,然而随着两者浓度的增大,细胞存活率逐渐减小.在抗炎活性测试中,实验组经不同质量浓度的DJE和DCE待测样品干预后,NO的释放量均有不同程度的降低,在不影响细胞正常增殖的情况下,DJE样品浓度为6.2~12.50 μg/mL 时以及DCE样品质量浓度为6.25~50.00 μg/mL 时,2种植物的乙醇提取物均能不同程度抑制炎症细胞释放NO,具有潜在的抗炎活性.综上所述,DJE和DCE均具有良好的抗氧化、降血糖以及抗炎活性,但蕨类植物的化学成分复杂,具体的功效成分尚不明确,本实验研究为今后更深入地研究重齿鳞毛蕨和假边果鳞毛蕨的有效成分和作用机制提供了实验依据.

