3 种花色类型滇黄精的遗传关系研究
谢蕾,肖良俊,吴涛,李贤忠,苏包顺,刘志彤
(1.西南林业大学,云南 昆明 650224;2.云南省林业和草原科学院,云南 昆明 650201;3.大理市林韵生物科技开发有限责任 公司,云南 大理 671000;4.巍山彝族回族自治县农业农村局园艺工作站,云南 大理 671000)
滇黄精Polygonatum kingianum又名云南黄精,在2020 年版《中华人民共和国药典》中与黄精P.sibiricum、多花黄精P.cyrtonema一起作为中药黄精的基源品种[1]。黄精具有抗衰老、抗肿瘤、降血糖、提高免疫力、改善记忆、防止老年痴呆等功能[2]。黄精属Polygonatum植物全球约有60 种,分类十分困难,其中有的种分布范围很广、形态变异很大,先是归于百合科Liliaceae[3]或更窄的铃兰科Convallariaceae[4]或是假叶树科Ruscaceae[5],最近又根据核基因和叶绿体DNA 片段的系统分类证据归并到天门冬科Asparagaceae[6-8]。《中国植物志》中记载的黄精属植物广泛分布于北温带,我国有31 种,目前尚未进行全面研究,仅依据其表型差异和分布特征划分为不同的“种”[3]。滇黄精部分分布在越南和缅甸,主产于中国的云南、四川、贵州、广西等省(自治区)[9]。云南滇中、滇西北等地滇黄精产量较大,是滇黄精的重要分布区。
《云南植物志》中记载的滇黄精花被颜色类型有紫红色、绿色、黄绿色和白色,并且以紫红色和白色最为常见[10]。作者在大理州大理市挖色镇进行滇黄精资源收集和扩繁过程中发现,花被白色类型的滇黄精资源种植区内出现白花带紫斑类型的滇黄精,并对其进行收集扩繁。滇黄精花被颜色类型繁多且鉴定困难,新发现的白花带紫斑类型具有花被白色和紫红色的特征,查阅文献和实地走访并未找到相关记载,紫红花、白花和白花带紫斑3 种类型滇黄精的遗传关系尚不清楚。
近年来,分子标记技术在黄精属植物的种源鉴定、遗传多样性分析、亲缘关系等方面的研究中得到了广泛应用[11-14]。周晔等[15]运用ISSR 分子标记方法对黄精属植物进行遗传多样性分析,筛选出可以有效辨别野生黄精、人工栽培黄精以及市面上黄精伪品的引物,还利用RAPD 手段对中药黄精及主要掺伪品长梗黄精P.filipes进行鉴别,确保中药使用的安全有效[16]。张家曾[17]通过对不同产地的黄精与多花黄精进行遗传学的系统研究,获得了用于鉴定不同品种黄精及其遗传多样性的psbA-trnH序列。此外,陈友吾等[18]基于转录组测序数据鉴别和分析多花黄精EST-SSR 位点,为多花黄精遗传多样性分析和遗传图谱构建提供了大量有价值的候选标记。这些工作为滇黄精资源鉴定和遗传多样性研究提供了很好的补充手段,本研究基于ISSR 分子标记技术,以差异较大的花色为研究目标分析了滇黄精的遗传关系,以期为滇黄精资源的遗传多样性研究和分类鉴别提供依据。
1 材料与方法
1.1 采样地概况
采样地点位于云南省大理州大理市挖色镇,地处大理市中东部,地理坐标为100°27′80″ E,25°95′05″ N,海拔为2 400 m,年平均气温为15℃,年降水量为1 100 mm。土壤红色,属亚热带季风气候,气候温和,常年无酷热严寒,少风霜,四季如春。
1.2 试验材料
2019 年7 月,试验所需材料采自云南省大理市挖色镇滇黄精种植基地本。白花滇黄精(P1)为认定良种‘林韵1 号’,白花带紫斑滇黄精(P2)为新发现扩繁植株,紫红花滇黄精(P3)为认定良种‘普洱1 号’,见图1。将3 种不同花色类型滇黄精资源(P1、P2、P3)各采集16 个单株(编号分别为A1-A16、B1-B16、C1-C16)。取各植株的健康成熟叶片放入滤纸取样袋中,置于装有硅胶的收纳盒中保存备用。

图1 三种花色滇黄精照片Figure 1 P.kingianum with different flower color
1.3 试验方法
1.3.1 DNA 提取 采用新型植物基因组DNA 提取试剂盒DNAsecure Plant Kit(天根生化科技有限公司)提取滇黄精叶片的DNA。用产自美国Thermo Fisher Scientific 的ND 2000 检测DNA 的含量和纯度,用2%琼脂糖凝胶检测DNA 质量。将DNA 浓度调整至20~ 40 ng·μL-1,―20℃保存备用。
1.3.2 PCR 扩增及引物筛选 从96 条ISSR 引物中筛选出条带清晰、重复性高的11 条引物(表1)。PCR 扩增反应体系总体积为20 μL,包括MIX 10 μL、Primer 4 μL、Template 0.5 μL、H2O 5.5 μL。ISSR-PCR 扩增程序为:94℃预变性2 min;94℃变性30 s;52℃退火30 s;72℃延伸30 s,40 个循环;最后72℃延伸5 min。扩增产物取8 μL,用DL 2000 作为Markers,用2%琼脂糖凝胶在150 V 下电泳22 min,EB 染色后用凝胶成像分析仪拍照保存。
1.4 数据统计与分析
采用人工计带法判读电泳图谱中的扩增产物,相同迁移位置上条带有或无分别计为“1”和“0”,构成“0,1”矩阵。用POP-GENE 32 软件计算多态性位点百分比(P)、观测等位基因数(Na)、有效等位基因数(Ne)、多样性指数Shannon-Wiener 指数(H′)、基因多样性指数Nei’s 指数(H)、遗传相似系数(I)、Nei’s 遗传距离(D)等遗传参数;利用NTSYS-pc 2.10e 软件的SAHN 程序进行UPGMA 聚类分析,通过Tree plot 模块生成聚类图。
2 结果与分析
2.1 ISSR 扩增结果及多态性分析
用11 条引物对3 种不同花色类型的48 份滇黄精样品进行ISSR 标记,总共扩增出103条清晰条带,其中多态性条带有99 条(表1)。平均每个引物扩增出9 个多态位点,其中8 条ISSR 引物包括引物840、887、889、826、880、886、890 和810 的多态性比率达100%,平均多态百分数为96.1%。其中,用引物826 扩增得到的总条带数量和多态性条带数量都是最多的,均为16 条。用引物887 和889 扩增得到的总条带数量最少,均为5 条。引物868 对48株滇黄精单株的ISSR-PCR 扩增结果见图2。

表1 48 株滇黄精单株的ISSR 扩增结果Table 1 Results of 48 P.kingianum individuals amplified with ISSR primers

图2 引物868 对48 株滇黄精单株的ISSR-PCR 扩增结果Figure 2 Amplification results of 48 P.kingianum individuals with the ISSR primer 868
2.2 遗传关系
由表2 可知,基于ISSR 标记,3 种不同花色类型滇黄精多态位点百分率的变异范围为54.4%~ 65.1%,平均为60.8%,其中,紫红花滇黄精(P3)的多态位点百分率最小,白花滇黄精(P1)的最大。观测等位基因数、有效等位基因数、Shannon-Wiener 指数的范围分别为1.54~ 1.65 个、1.26~ 1.30 个和0.25~ 0.29,3 个不同花色类型滇黄精的平均Nei’s 指数为0.17,其中,白花滇黄精(P1)的Nei’s 指数相对较高,这表明白花滇黄精存在丰富的遗传多样性,变异水平较大,白花带紫斑滇黄精(P2)的多态位点百分率介于白花滇黄精(P1)与紫红花滇黄精(P3)之间。
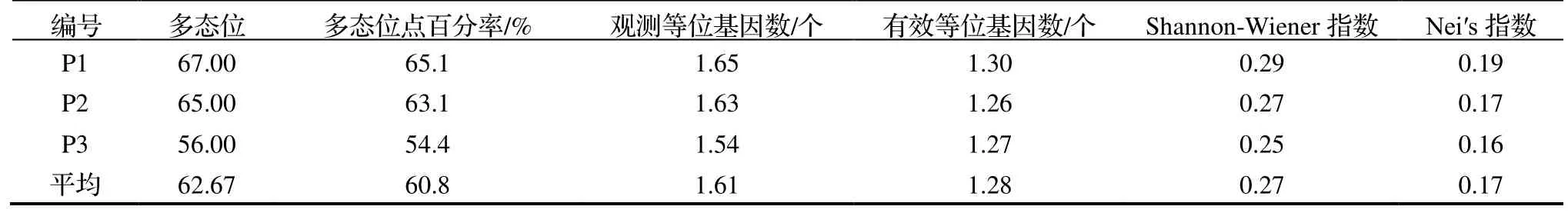
表2 3 种不同花色类型滇黄精的遗传关系Table 2 Genetic relationship of P.kingianum with three flower color
2.3 遗传距离及聚类分析
由表3 可知,3 种不同花色类型滇黄精的遗传一致度为0.89~ 0.91,均值为0.90;遗传距离为0.10~ 0.12,平均遗传距离为0.11,说明3 种花色类型滇黄精之间的遗传差异不大,其中白花带紫斑滇黄精(P2)和紫红花滇黄精(P3)之间具有相对较小的遗传距离(0.10)和最大的遗传一致度(0.91)。利用UPGAM 聚类法对48 份滇黄精样品进行分析,基于遗传一致度构建遗传聚类图。当遗传一致度为0.69 时,聚为三组——白花滇黄精(P1,A1-A16)、白花带紫斑滇黄精(P2,B1-B16)和紫红花滇黄精(P3,C1-C16)(图3)。
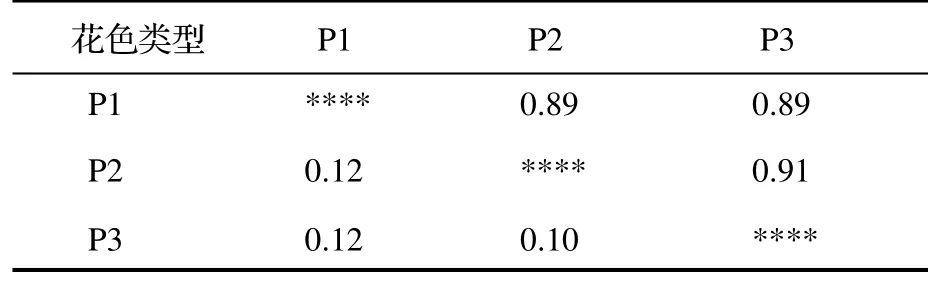
表3 3 种不同花色类型滇黄精的遗传一致度和遗传距离Table 4 Genetic identity and genetic distance of P.kingianum with different flower color

图3 基于遗传一致度的UPMGA 聚类图Figure 3 UPGMA dendrogram based on genetic identity
3 讨论
本试验采样的3 种不同花色类型滇黄精均来自同一块基地,它们的空间距离较近,自然条件下通过虫媒等影响各花色类型之间的花粉传播,加强了基因交流。故推测白花带紫斑滇黄精可能是紫红花滇黄精和白花滇黄精的过渡类型,或者是白花滇黄精和紫红花滇黄精自然授粉后,所产生的子代的一种杂合状态。由于滇黄精栽培历史较短、地域性差异较大,对其植物学特征和生物学特性的研究尚不充分的原因,导致了对同一个物种的形态学、物候期等基本生物学特性描述不一致的现象[19]。紫红花滇黄精(P3)为野外常见类型,分布范围广,也是目前人工驯化栽培面积最大的类型,其块茎芽头少,但芽头大,须根多,产量低;白花滇黄精(P1)主要分布在云南大理、禄丰一带,植株较紫红花滇黄精矮小、抗性强、芽头多、须根少、产量高;白花带紫斑滇黄精(P2)为在大理州大理市挖色镇进行滇黄精资源收集和扩繁过程中新发现的类型,植株表现在株型、块茎等方面与白花滇黄精(P1)基本一致,目前,关于白花带紫斑滇黄精的资料记载和报道较少。黄精属种间甚至种内的形态特征有明显的交错过渡,其中不少种类在地理分布上存在重合,变异复杂,常伴有种间杂交现象,种与种之间的界限相当模糊,致使该属的系统分类与种的鉴定不甚明确[20]。近年来,有通过生药学鉴别[21-22]、花粉鉴别[23-24]、叶表皮及种皮鉴别[25-26]并通过细胞学[27-28]对黄精属进行分类鉴别研究的报道,但这些传统植物形态学分类方法并不能保证黄精属鉴别分类的可靠性。
随着分子生物学科研究的完善与深入,先后出现了多种基于DNA 水平的分子鉴定技术,这些技术加速了黄精属相关领域的研究并取得了较为丰硕的成果。目前,ISSR 技术被广泛应用于黄精属种质资源的鉴定、遗传多样性及亲缘关系分析、指纹图谱构建[29]。多花黄精和长梗黄精P.filipes为福建省市场上常见的易混黄精属植物,徐惠龙等[30]利用ISSR 分子标记技术对这两种植物进行了种质资源鉴别,发现这两种植物种质间分化差异较大,多花黄精种质与长梗黄精种质均能单独聚为一类;杨青等[31]通过ISSR 分子标记方法对武夷山及周边地区的五份黄精属植物进行了有效区分;卜静等[32]通过对野生居群玉竹P.odoratum与栽培居群玉竹的ISSR 分析比较发现,野生居群玉竹的遗传多样性高于栽培玉竹的,地理来源相同的野生居群与栽培居群亲缘关系更加接近。以上研究表明ISSR 技术可为黄精属种质鉴别提供新的方法与参考依据。本研究利用ISSR 分子标记对3 种花色类型滇黄精进行了遗传关系研究。但采用ISSR 标记方法获得的遗传多样性信息较为简单,下一步将在分子标记的基础上结合滇黄精的表型特征、药用功效及品质评价对其进行深入研究,从而获得的更为丰富的遗传多样性信息,为滇黄精的资源分类及良种选育奠定基础。
4 结论
在滇黄精DNA 数据较为匮乏的限制条件下,利用ISSR 分子标记方法对3 种不同花色类型滇黄精的48 份样品进行了遗传关系研究。白花滇黄精(P1)的多样性指数为0.19,相对白花带紫斑滇黄精(P2)和紫红花滇黄精(P3)这两种类型较高。从多态性和遗传聚类结果看,白花滇黄精(P1)、白花带紫斑滇黄精(P2)与紫红花滇黄精(P3)均可以很好地各自独立聚为一组,其中白花带紫斑滇黄精与紫红花滇黄精的亲缘关系相对更近。新发现的滇黄精类型增加了分类鉴别的难度,但其丰富的变异为选育优质、高产、抗逆的滇黄精新品种提供丰富的育种材料。

