北江荛花茎段离体快速繁殖与叶片再生体系构建
雷佩雯,干诗颖,孙家怡,彭思娴,栾牧,高培军
(1.浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300;2.浙江农林大学 林业与生物技术学院,浙江 杭州 311300)
开化纸因产自浙江省开化县而得名,有纸寿千年、中国手工纸皇冠上的明珠之美誉。开化纸始于唐宋,盛于明清,风靡朝野,是明清时期古籍印刷的御用纸,纸色洁白雅致、质地柔软坚韧,其以荛花属Wikstroemia植物韧皮纤维为主要原料制作[1]。清末,因战乱、造纸核心原料枯竭等原因,造纸技艺中断百年。古籍修复是古籍保护工作中的一项重要内容,我国古籍修复纸主要依赖日本进口,而随着开化纸造纸工艺的复原,这种依赖进口的境况将得到极大改善,对于发明造纸术的我国来讲,不仅有极高的经济价值,更有重大的政治意义。目前,国内外尚未开展荛花属植物的人工林培育,开化纸造纸原料主要依靠采挖野生资源及从菲律宾进口干料来完成,已严重影响开化纸的产业化发展,荛花属植物人工林培育迫在眉睫。因此,需要快速繁殖大量荛花属植物种苗来全面满足人工林营造的生产需求。
北江荛花W.monnula为瑞香科Thymelaeaceae 荛花属多年生落叶灌木[2],具有泻水逐饮,消坚破积之功效[3];其枝条细长,韧皮纤维发达,可造纸。北江荛花主要生长在浙江衢州等地区,可作为开化纸的制作原料,取材方便。目前,关于北江荛花的组织培养和快速繁殖尚未见报道,仅有关于北江荛花同属植物南岭荛花W.indica的组织培养研究[4]。南岭荛花与北江荛花都是主要生长在南方的荛花属植物,生长习性相似,因此,可参考前人的研究内容设计北江荛花组织培养试验方案。
本研究以北江荛花幼嫩叶片和茎段为材料,开展不定芽诱导、增殖与壮苗的研究,以期构建最适宜北江荛花组培快繁的育苗体系,实现北江荛花的离体快速繁殖。
1 材料与方法
1.1 试验材料
2018 年11 月,从浙江省衢州市开化县引种30 株2 年生北江荛花裸根苗,苗高约为1.56 m,地径约为1.45 cm。采用塑料花盆(38 cm×28 cm),盆内栽培基质为泥炭、珍珠岩和蛭石,按1∶1∶1 的体积比混合,栽培于浙江农林大学智能温室,3 个月后供试验用。
MS 培养基、WPM 培养基、α-萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)购自PhytoTech,蔗糖、活性炭(AC)购自上海沪试实验室器材股份有限公司,植物凝胶(Gelrite)购自Sigma 公司,聚乙烯吡咯烷酮(PVP)购自上海源叶生物科技有限公司,试剂NaClO、噻苯隆(TDZ)、二氯苯氧乙酸(2,4-D)购自浙江卡尔生物技术有限公司。
1.2 外植体的选择和消毒方法
取生长健壮的北江荛花盆栽苗当年生枝条,截取枝条前端15 cm 左右,在流水下冲洗2 h 后,先用75%酒精消毒30 s,无菌水洗3~ 5 遍后再用0.50% NaClO 溶液浸泡消毒10 min,无菌水洗5~ 7 遍。在无菌条件下,剪取叶腋上0.5 cm、叶腋下0.5 cm 幼嫩茎段和靠近叶柄端的叶片,用无菌滤纸吸干试材表面水分后接种至未添加任何激素的培养基中。每隔3 d 观察1 次污染情况,30 d 后统计污染数量和未污染且能萌发的外植体数量。以污染数与总接种数的比值为污染率,以未污染但褐死的外植体与总接种数的比值为褐死率。结果表明,以幼嫩叶片为外植体,污染率为37.82%,褐死率为26.8%;以幼嫩茎段为外植体,污染率为33.66%,褐死率为29.85%。
1.3 直接器官发生途径诱导不定芽试验
取无菌幼嫩茎段外植体接种至附加了3 种不同浓度6-BA(0.01、0.10、1.00 mg·L-1)的MS 培养基和WPM培养基中[5]。试验共设置6 个处理,每个处理的接种数为50 个茎段,3 次重复,30 d 后观察萌发情况并计算芽诱导率。
1.4 间接器官发生途径诱导不定芽试验
取无菌幼嫩叶片外植体接种至附加不同浓度2,4-D(0、0.2、2.0 mg·L-1)和TDZ(0.4、4.0、8.0 mg·L-1)的MS 培养基中[6]。试验共设置9 个处理,每个处理接种50 个外植体,3 次重复,培养30 d 后观察愈伤组织诱导情况和芽生长情况并计算出愈伤组织诱导率和芽诱导率。
1.5 增殖培养试验
挑选无污染、长势一致的无菌苗接种至培养基中进行增殖培养,增殖培养基以WPM 培养基为基本培养基,添加不同浓度的6-BA(0.1、1.0、3.0 mg·L-1)和NAA(0、0.01、0.10 mg·L-1)[8]。试验共设置9 个处理,每个处理接种50 株无菌苗,3 次重复,30 d 后观察并记录丛芽的生长状况和增殖情况。
1.6 壮苗培养试验
将增殖后长势良好的组培苗接种至增殖培养基上。壮苗培养分别采用附加聚乙烯吡咯烷酮(PVP:500、1 000 mg·L-1)和活性炭(AC:1 000、2 000 mg·L-1)的增殖培养基以及未附加上述物质的增殖培养基作为对照。试验共设置5 个处理,每个处理接种50 株组培苗,3 次重复,30 d 后观察并记录丛芽的生长状况和增殖情况。
1.7 其它条件
本试验中若无特殊说明,均在培养基中加入30 g·L-1蔗糖,pH 调节至5.7,以3.5 g·L-1Gelrite 为凝固剂,灭菌条件为121℃、215 KPa,灭菌时间为10 min。无菌外植体的培养条件为光照强度2.5×103lx,每天的光照时间为16 h,环境温度为(25±2)℃,空气相对湿度为60%~ 90%。
1.8 数据分析
所有数据均为3 次重复的平均值±标准误。使用SPSS 22.0 软件进行数据处理及统计分析,方差分析采用Duncan’s 新复极差法。
2 结果与分析
2.1 不同6-BA 浓度和培养基对腋芽诱导的影响
由腋芽诱导试验结果表明(表1),在MS 培养基中的组培苗均出现玻璃化现象,在添加0.01 mg·L-16-BA的培养基中,大部分组培苗出现玻璃化,随着6-BA 浓度的增加,叶片的玻璃化程度加深;在WPM 培养基中,添加0.01 mg·L-16-BA 处理的组培苗未发生玻璃化,生长状况最好,腋芽诱导率达45.3%,随着6-BA 浓度的增加,叶片玻璃化程度逐渐加深,芽诱导率呈先上升后下降趋势,但各处理间的芽诱导率无显著差异,这表明最佳的北江荛花腋芽诱导培养基是WPM+0.01 mg·L-16-BA(图1A)。

表1 不同6-BA 浓度和培养基对北江荛花腋芽诱导的影响Table 1 Effect of different 6-BA concentration and medium on axillary bud induction
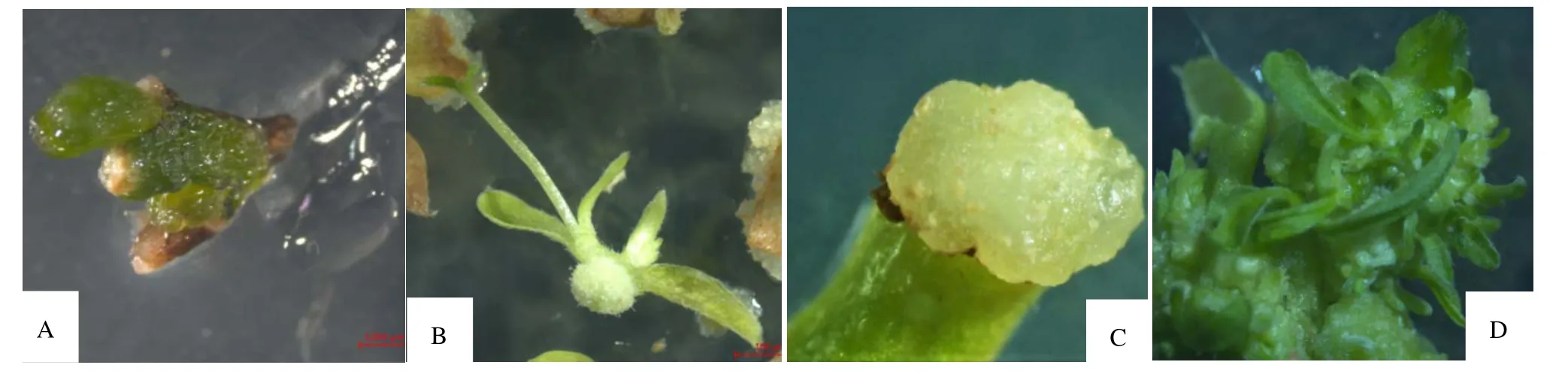
图1 北江荛花组织培养过程的不同阶段Figure 1 Different stages of tissue culture of W.monnula
2.2 不同浓度2,4-D 和TDZ 对愈伤组织诱导和芽诱导的影响
2.2.1 对愈伤组织诱导的影响 由愈伤组织诱导试验结果表明(表2),在MS 培养基中未添加2,4-D 处理,对愈伤组织诱导率较低;添加2,4-D 后,随着2,4-D 浓度的升高,愈伤组织诱导率呈上升趋势。在2,4-D 浓度一定时,随着TDZ 浓度的升高,愈伤组织诱导率呈先上升后下降趋势。处理8(2.0 mg·L-12,4-D+4.0 mg·L-1TDZ)的愈伤组织诱导率最高,达65.1%,与处理2(4.0 mg·L-1TDZ)相比,愈伤组织诱导率增加了6.5 倍。处理2的芽诱导率最高,与处理8 相比,芽诱导率增加了2.8 倍。
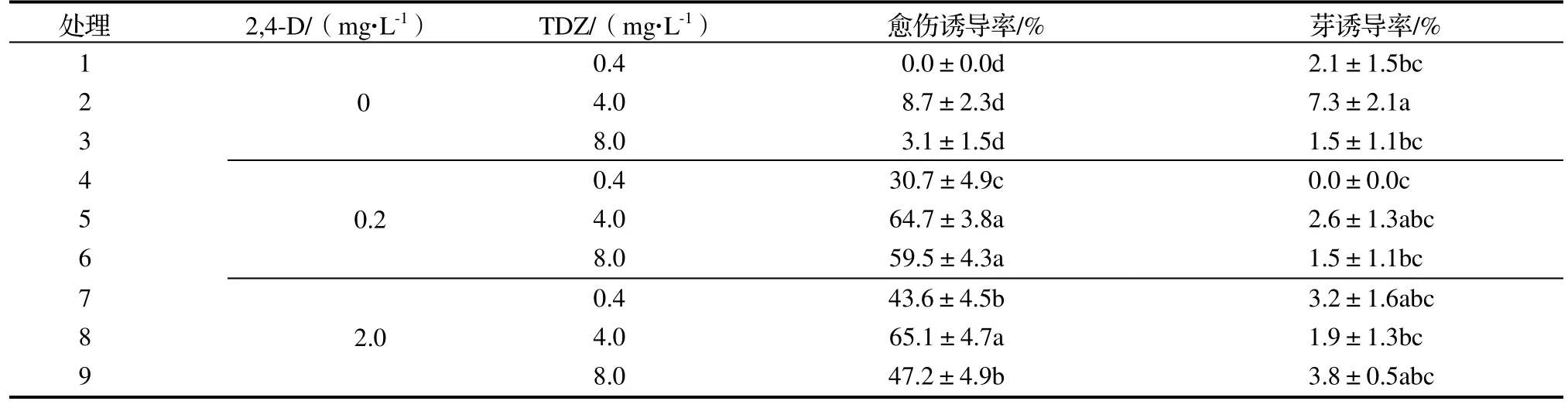
表2 不同浓度2,4-D 和TDZ 对愈伤组织诱导和芽诱导的影响Table 2 Effect of different concentrations of 2,4-D and TDZ on callus and bud induction
F检验结果表明(表3),TDZ 和2,4-D 对愈伤组织诱导均呈现出极显著性差异,TDZ 和2,4-D 的交互作用差异显著。因此,最适宜的愈伤组织诱导培养基是MS +2 mg·L-12,4-D+4 mg·L-1TDZ。
长期以来对数学实用性的误解层出不穷,很多数学家也认为数学应该追求纯粹的知识,即使是阿基米德那样的伟大人物也反对站在实用的角度研究知识,这也是古希腊文明一度沉寂的原因。历史已经证明,联系现实世界才是数学的出路,高职学生要学好数学,唯一的途径只能是开发便于理解,方便记忆,随时应用现实世界的课程。
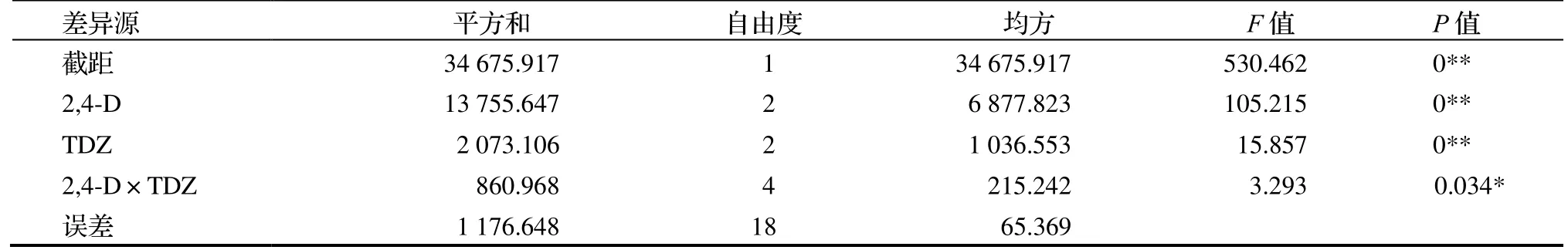
表3 不同激素处理对愈伤组织诱导影响的方差分析Table 3 ANOVA on effect of different hormone treatments on callus induction
2.2.2 对芽分化率的影响 由表4 可知,未添加NAA 时,随着TDZ 浓度的升高,愈伤组织的芽分化率呈先上升后下降趋势;添加NAA 后,随着TDZ 浓度的升高,芽分化率呈上升趋势。处理6(1.0 mg·L-1NAA+2.5 mg·L-1TDZ)的芽分化率与其他处理均存在显著差异(P<0.05),在该处理下芽分化率最大,达64.9%,较处理4(1.0 mg·L-1NAA+0.4 mg·L-1TDZ)增加了60%。
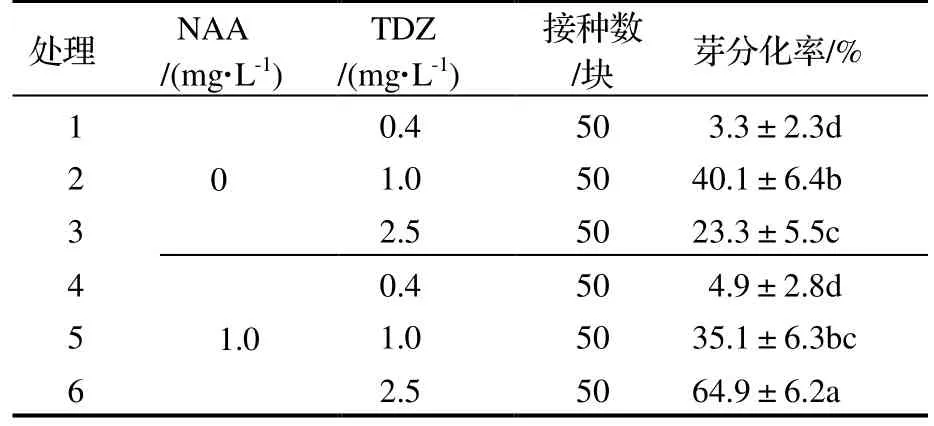
表4 不同浓度TDZ 和NAA 对芽分化率的影响Table 4 Effect of different concentrations of TDZ and NAA on bud differentiation rate
F 检验结果表明(表5),TDZ、TDZ 和NAA 的交互作用对芽分化率的影响差异极显著(P<0.01)。因此,最佳的愈伤组织分化培养基为WPM+1 mg·L-1NAA +2.5 mg·L-1TDZ(图1D)。

表5 不同处理对芽分化率影响的方差分析Table 5 ANOVA of effect of different treatments on bud differentiation rate
2.3 不同浓度6-BA 和NAA 对无菌苗不定芽增殖的影响
由增殖试验结果(表6)表明,未添加NAA 时,增殖系数偏低;添加NAA 后,随着6-BA 浓度的升高,增殖系数呈下降趋势,组培苗叶色逐渐变黄,褐化逐渐加重。在6-BA 浓度一定时,随着NAA 浓度的升高,增值系数呈上升趋势。处理3(0.1 mg·L-16-BA+0.1 mg·L-1NAA)的增殖系数最高,达4.84,且无菌苗的生长状况良好(图2A),较处理9(3.0 mg·L-16-BA+0.10 mg·L-1NAA)的增殖系数增加了近1 倍。

表6 不同浓度6-BA 和NAA 对增殖的影响Table 6 Effect of different concentrations of 6-BA and NAA on multiplication

图2 增殖培养Figure 2 Multiplication culture
F检验结果表明(表7),6-BA 和NAA 对无菌苗不定芽增殖均呈现出极显著性差异(P<0.01),6-BA 和NAA 的交互作用差异不显著。因此,最适宜北江荛花增殖的培养基为WPM+0.1 mg·L-16-BA+0.1 mg·L-1NAA。

表7 不同处理对增殖影响的方差分析Table 7 ANOVA on effect of different treatments on multiplication
2.4 不同浓度PVP 和AC 对组培苗生长的影响
在组培增殖过程中,许多植物会出现玻璃化现象,不利于后续的培养发育,所以需要对组培苗进行壮苗培养[9]。由表8 试验结果表明,与对照相比,添加500 mg·L-1PVP 后增殖系数显著增加,为4.94,当PVP 浓度升高至1 000 mg·L-1时,增值系数增加到5.42,但2 种PVP 浓度处理的增殖系数无显著差异,植物叶片颜色变浅,叶形不变,茎变粗(图2B);与对照相比,添加1 000 mg·L-1AC 后增殖系数增加,为3.98,当AC 浓度升高至2 000 mg·L-1时,增值系数下降到2.78,叶片颜色保持浓绿,叶形由卵圆形转变为披针形,部分植株叶片出现黄化现象,且低浓度AC 处理,植株高生长较快(图2C)。从后续生产角度考虑,添加1 000 mg·L-1PVP 处理增殖系数最高,可获得更多生长健壮的幼苗。综合以上试验结果可知,最适宜北江荛花壮苗的培养基为WPM+0.1 mg·L-16-BA+0.1 mg·L-1NAA+1 000 mg·L-1PVP。

表8 不同类型添加物和不同添加量对北江荛花生长状况的影响Table 8 Effect of different concentrations of PVP and AC on tissue cultured seedling growth
3 讨论
组培快繁是实现种苗规模化生产的有效途径之一[10]。随着组培快繁技术的不断成熟,该技术在珍稀濒危、资源紧缺的植物资源保护方面发挥着重要作用。Yadav[11]等使用三角叶杨Populusdeltoids的叶片、根系、茎节等器官进行组培研究,获得了完整植株。武梦瑶[12]以米槁Cinnamomum m igao带芽茎段和叶片为外植体,通过不定芽及愈伤组织的诱导、不定芽增殖培养、生根培养及炼苗移栽的过程,成功获得再生植株。
3.1 直接器官发生途径诱导不定芽
瑞香科植物茎段常采用6-BA 诱导不定芽[13]。本研究结果表明,6-BA 浓度过高会抑制不定芽的形成,并且芽苗质量差,叶片玻璃化严重,这与张虎等[14]对芫花Daphne genkwa茎段的诱导试验结果相似;北江荛花对基本培养基类型较敏感,高无机盐含量的MS 培养基不利于不定芽诱导,中等无机盐含量的WPM 培养基更适宜茎段直接诱导不定芽[15]。
3.2 间接器官发生途径诱导不定芽
植物生长调节剂能促进愈伤组织的形成和不定芽的产生[16],TDZ 对木本植物的再生非常有效,而且需要较高浓度才能促进木本植物器官发生[17]。沈苗苗[18]研究发现TDZ 对芍药Paeonia lactiflora愈伤组织诱导起到关键作用,与2,4-D 结合能更好地诱导外植体愈伤组织形成。本研究发现,单独使用TDZ 对愈伤组织诱导率较低,加入2,4-D 后对愈伤组织诱导率显著增加,TDZ 浓度过高时对愈伤组织诱导产生抑制作用[19]。这可能是由于TDZ对愈伤组织诱导的促进作用具有一定的浓度区间,在适宜的含量区间内效果显著[20]。植物在不同阶段所需激素种类与浓度不尽相同,2,4-D 是植物脱分化的重要激素,因而在分化过程中不应添加,而NAA 有利于植株分化[21]。张娇等[22]在华北绣线菊Spiraea fritschiana试验中选择TDZ 与NAA 组合诱导不定芽,植株分化后不定芽生长健壮。本试验结果表明,以TDZ 和NAA 为外源激素,通过浓度及配比的不同,产生交互作用,对植株的分化能力产生促进作用[23]。
本研究发现,以茎段诱导腋芽培养、叶片愈伤组织诱导培养2 种途径对北江荛花进行不定芽诱导,2 种培养途径均有各自优势,茎段诱导不定芽培养途径用时短,但芽生长势较弱,易玻璃化,后续需壮苗培养;愈伤组织诱导培养途径培养方式用时较长,但芽诱导率高、生长势良好。因此,对比发现,茎段诱导培养可作为北江荛花不定芽诱导的最佳途径。
3.3 增殖培养
有研究表明,单独使用细胞分裂素不利于丛生芽增殖和生长,与生长素组合有利于丛生芽的诱导和增殖[24]。在瑞香科植物中,徐强兴等[25]对土沉香Aquilaria s inensis、江洪如等[26]对金边瑞香Daphne od ora采用6-BA 和NAA 组合进行增殖试验,增殖系数最高达4.1。本研究结果表明,6-BA 和NAA 组合对北江荛花不定芽增殖效果较好,增殖系数最高达到4.84,增殖系数高于二人所得实验结果;6-BA 浓度要在较低水平才能获得理想的增殖率和生长势,提高浓度会导致组培苗生长状况变差[27]。从研究结果初步推断,高浓度6-BA 处理可能会破坏植物体内的激素平衡水平,从而抑制了芽的生长[28]。因此,在以6-BA 诱导芽增殖时应选择合适的激素配比。
4 结论与展望
北江荛花幼嫩叶片和茎段分别采用两种方式进行不定芽诱导,以茎段为外植体诱导不定芽时,最佳诱导培养基为WPM+0.01 mg·L-16-BA,腋芽诱导率为45.3%,诱导得到的芽生长状况良好,叶片舒展,颜色较浅,无玻璃化;以叶片为外植体诱导愈伤组织时,最佳诱导培养基为MS+4 mg·L-1TDZ+2 mg·L-12.4-D,愈伤组织诱导率为65.1%;将诱导得到的愈伤组织转入分化培养基中培养,最佳分化培养基为WPM+2.5 mg·L-1TDZ+1 mg·L-1NAA,芽分化率为64.9%。以6-BA 与NAA 诱导北江荛花不定芽的增殖,不定芽的最佳增殖培养基为WPM+0.1 mg·L-16-BA+0.1 mg·L-1NAA,增殖系数为4.84。将长势较好的组培苗接入壮苗培养基中继续培养,在培养基WPM+0.1 mg·L-16-BA+0.1 mg·L-1NAA+1 000 mg·L-1PVP 中,增殖系数达到5.42。
后续北江荛花组织培养的研究重点主要在以下两方面:一是对北江荛花无菌苗生根技术进行研究,二是对生根苗进行炼苗与移栽,从而建立一套北江荛花无菌苗再生体系,实现北江荛花产业化育苗。

