AB-8 树脂纯化竹叶黄酮工艺及其抗氧化活性研究
姚林娜,张瑞华,张爱莲,陈亚薄,陈永健,俞雪兰
(1.浙江省特色中药资源保护与创新利用重点实验室,浙江农林大学,浙江 杭州 311300;2.杭州市临安区青山湖街道办事处,浙江 杭州 311305;3.浙江圣氏生物科技有限公司,浙江 安吉 313399)
竹又名竹子,是禾本科Poaceae 和竹亚科Bambusoideae 多年生常绿植物,热带和副热带是其生长的主要地区[1]。中国竹资源充裕,目前成熟的竹子产业主要是在竹材加工、竹笋消费及竹化工等方面,是备受重视的绿色环保产业[2]。然而,涉及竹叶的相关产品较少,大部分作为废弃物燃烧丢弃[3]。竹叶入药的历史早有记载,是我国传统药材之一。竹叶中含有大量的次生代谢产物,其中黄酮类化合物是主要有效物质,是一种天然食品抗氧化剂。竹叶黄酮(Bamboo Leaf Flavonoids,BLF)是指从刚竹属Phyllostachys竹的叶片中分离出来的黄酮类制剂,具有多种功效,如抗氧化、清除自由基、抗炎、抑菌等,在化妆品、保健品等领域有着较大的应用潜力,于2014 年被国家卫生和计划生育委员会批准作为“新食品原料”使用[4]。竹叶黄酮的原料为竹叶,具有大量的资源和成熟的制备工艺[5]。
大孔吸附树脂因其相对低的成本及易再生的特点而被应用于富集多酚化合物、类黄酮等活性成分[6]。虽然有文献报道过采用大孔树脂分离和纯化竹叶黄酮,但一些研究局限于评价树脂的静态性能,缺少对于树脂的动态吸附和解吸行为的了解,不利于竹叶黄酮的分离和纯化[7]。本实验拟考察AB-8 大孔树脂吸附-解吸特性以及用于竹叶总黄酮分离纯化的最佳工艺条件,运用紫外分光光度法对竹叶黄酮含量进行检测;以清除DPPH 自由基、·OH 的能力为指标,对纯化前后竹叶总黄酮的抗氧化能力进行了研究,为减少竹叶资源浪费,加快竹叶黄酮产业化提供一定的参考。
1 材料与方法
1.1 仪器与材料
实验样品与化学试剂:竹叶黄酮初样品(浙江圣氏生物科技有限公司)、芦丁(合肥博美生物科技有限公司)、无水乙醇、乙酸乙酯(国药集团化学试剂有限公司)、浓硫酸、过氧化氢(永华化学股份有限公司)、磷酸二氢钠、磷酸氢二钠、邻菲罗啉、1,1-二苯基-2-苦基肼(上海源叶生物科技有限公司)、硫酸亚铁(上海阿拉丁生化科技股份有限公司)、亚硝酸钠、硝酸铝、氢氧化钠(天津市永大化学试剂有限公司)、盐酸(上海凌峰化学试剂有限公司)、AB-8 大孔吸附树脂(郑州和成新材料科技有限公司)等。
实验仪器:电热恒温水浴锅(DK-S24,上海精宏实验设备有限公司)、电子分析天平(FA2204,力辰科技公司)、超声波清洗仪(D5-7510DTH,上海生析超声仪器有限公司)、旋片式真空泵(2XZ-2,上海雅谭真空设备有限公司)、真空干燥箱(DZF-6020,上海精宏实验设备有限公司)、酶标仪(EPOCH2,美国伯腾公司)、超纯水仪(D24UV,彤迪科学仪器(上海)有限公司)、旋转蒸发装置(R-201,上海申胜生物技术有限公司)、普通层析柱(13 mm×150 mm,温州奥利生物医学仪器厂)。
1.2 实验方法
1.2.1 AB-8 大孔树脂预处理 结合相关文献与预实验结果,选取AB-8 大孔树脂进行后续实验。用95%(体积分数,下同)乙醇浸泡过夜,用高纯水洗至无醇味,用5%盐酸溶液漂洗4 h,再用高纯水洗脱,洗至pH 值为中性后,用5%氢氧化钠溶液漂洗4 h,然后用高纯水洗至pH 值为中性,浸泡于95%乙醇中备用,使用前用高纯水洗一段时间,直到洗脱液无醇味[8]。
1.2.2 标准曲线的绘制 精密称量芦丁标准品4.5 mg,用50%乙醇定容至10 mL 容量瓶中,摇匀得浓度为0.45 mg·mL-1的标准溶液。分别准确吸取芦丁标准溶液0.5、0.75、1.0、1.25、1.5、2.0 mL 于10 mL 容量瓶中,加入5%亚硝酸钠溶液0.3 mL,静置6 min,再加入10%硝酸铝0.3 mL,静置6 min,最后加入4%氢氧化钠4 mL,加入50%乙醇至刻度,摇匀。放置15 min,于510 nm 波长处测得各个芦丁质量浓度的吸光度,记录数值[9]。设置吸光度为纵坐标、芦丁质量浓度为横坐标,以此绘制标准曲线,得到的线性标准回归方程为:
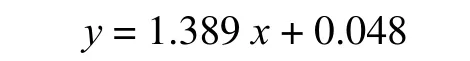
式中,x为芦丁质量浓度,y为510 nm 处的吸光度。相关系数R2=0.999 7。
1.2.3 样品的测定 取待测洗脱液2.0 mL 于10 mL 容量瓶中,按“1.2.2”项下操作,测定吸光度,根据标准曲线,计算样品中总黄酮的质量浓度。
1.3 动态优化AB-8 大孔树脂吸附-解吸竹叶总黄酮
选用规格为13 mm×150 mm 的层析柱。在室温下,根据其膨胀系数及柱体积将13 mL 处理好的AB-8 大孔树脂湿法上柱,设置梯度上样液质量浓度、体积、上样流速以及洗脱剂的体积分数和体积,分别探究各个条件对AB-8 大孔树脂吸附率、解吸率的影响。合理分析每次所得数据,筛选并确定最优工艺条件。

1.3.1 上样液质量浓度对吸附效果的影响 精密称量竹叶黄酮初样品0.12 g,在容量瓶中用水定容至100 mL,配制成浓度分别为0.8、1.6、2.4、3.2、4.0 mg·mL-1的供试品溶液,以2 BV·h-1(BV:柱体积,下同)流速上样,收集各洗脱液,测定洗脱液中黄酮的质量浓度,求得AB-8 大孔树脂的吸附率[10]。
1.3.2 上样流速对吸附效果的影响 保持体积100 mL、竹叶黄酮初样品质量浓度为1.2 mg·mL-1不变,分别以1、2、3、4、5 BV·h-1的流速上样,且在3 BV·h-1流速下,收集各个洗脱液,测定洗脱液中黄酮的质量浓度[11-12],绘制AB-8 大孔树脂柱动态吸附穿透曲线,找出泄漏点,最终确定最佳的竹叶总黄酮流速。
1.3.3 上样体积对吸附效果的影响 保持流速为3 BV·h-1、竹叶黄酮初样品质量浓度为1.2 mg·mL-1不变,分别以10、20、30、40、50、60、70、80、90、100 mL 体积上样,且在3 BV·h-1流速下,以10 mL 为一体积单位在试管中收集,测定洗脱液中黄酮的质量浓度,绘制AB-8 大孔树脂柱动态吸附穿透曲线,找出泄漏点,最终确定最佳上样体积。
1.3.4 洗脱液体积分数对解吸率的影响 恒定流速为3 BV·h-1,用100 mL 体积分数分别为50%、60%、70%、80%、90%的乙醇洗脱,收集各洗脱液,测定洗脱液中黄酮的质量浓度,根据上述检测数据计算得到AB-8 大孔树脂在各洗脱体积分数下的动态解吸率。
1.3.5 洗脱体积对解吸率的影响 保持70%乙醇,3 BV·h-1的流速不变,分别以10、20、30、40、50、60、70、80、90、100 mL 体积洗脱,每10 mL 收集一次[13],测定洗脱液中黄酮的质量浓度,得到最佳洗脱液的体积。
1.3.6 不同洗脱流速对洗脱效果的影响 根据所得的最佳上样条件上柱,洗脱时,分别用60 mL 的70%乙醇以1、2、3、4、5 BV·h-1的流速进行洗脱。收集各洗脱液,测定洗脱液中黄酮的质量浓度,计算解吸率,得到最佳洗脱流速[14]。
1.4 抗氧化活性测定
1.4.1 清除DPPH 自由基能力的测定
(1)分别取25 mg 竹叶黄酮样品,用无水乙醇定容至25 mL,得到浓度为1 mg·mL-1的竹叶黄酮供试品溶液;分别取2、4、6、8 mL 上述溶液各用无水乙醇稀释至10 mL 容量瓶,得到0.2、0.4、0.6、0.8、1.0 mg·mL-1浓度的供试品溶液。
(2)将已配制成0.1 mmol·L-1的DPPH 乙醇溶液,分别吸取不同梯度质量浓度的竹叶黄酮样品溶液及DPPH溶液各100 μL于96 孔板小孔内;室温避光反应30 min,在517 nm波长处测定吸光度[15],测定3 次取平均值(A1);准确吸取不同质量浓度的竹叶黄酮样品溶液和乙醇溶液各100 μL 共置于96 孔板小孔内,避光放置反应30 min,在517 nm 波长处测定吸光度(A2);准确吸取DPPH 溶液和乙醇溶液100 μL 共置于96 孔板小孔内,避光放置反应30 min,在517 nm 波长处测定吸光度(A0)[16]。利用下列公式计算不同质量浓度竹叶黄酮样品对DPPH 自由基的清除率:
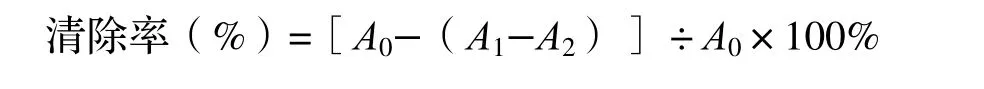
1.4.2 清除·OH 能力测定
(1)分别取25 mg 竹叶黄酮样品,用水定容至25 mL,得到浓度为1 mg·mL-1的竹叶黄酮供试品溶液;分别取2、4、6、8 mL 上述溶液各用水稀释至10 mL 容量瓶,得到0.2、0.4、0.6、0.8、1.0 mg·mL-1的供试品溶液。
(2)取5 支试管,在试管中分别加入pH=7.4 的磷酸盐缓冲液2 mL、0.75 mmol·L-1邻菲罗啉无水乙醇溶液1 mL 及0.75 mmol·L-1硫酸亚铁溶液1 mL,每加一管后立即混匀,再向其中加入不同浓度梯度的1 mL 竹叶黄酮样品溶液,混匀,最后加入1%双氧水溶液1 mL,于37℃下水浴保温1 h,在510 nm 波长处测定吸光度(A2)[17]。重复上述步骤,另外再做损伤管和未损伤管,其中损伤管A1中加入1%的双氧水溶液和蒸馏水各1 mL,未损伤管A0以2 mL 蒸馏水代替双氧水溶液和样品溶液作为空白对照[18]。计算清除率,其计算公式为:
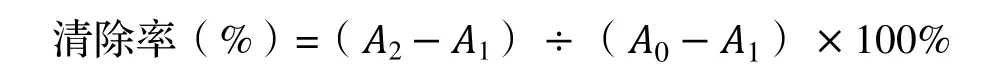
1.5 数据处理
利用Excel 软件对所得数据进行分析,求得不同条件下竹叶黄酮的吸附率和解吸率,DPPH 自由基清除率以及·OH 清除率。
2 结果与分析
2.1 不同工艺条件对AB-8 大孔树脂吸附-解吸竹叶总黄酮的影响
2.1.1 上样液质量浓度对竹叶总黄酮吸附效果的影响 由图1 可知,随着上样液质量浓度的增加,AB-8 大孔树脂对竹叶总黄酮的吸附率逐渐降低。当上样液浓度为0.8 mg·mL-1时,AB-8 大孔树脂对竹叶总黄酮的吸附率为94.1%,而当上样液浓度为1.6 mg·mL-1时,AB-8 大孔树脂对竹叶总黄酮的吸附率降低为71.1%。这说明在一定浓度范围内,上样液质量浓度越高,单位表面积与大孔树脂接触量也越大,传质速率越慢,大孔树脂表面吸附越容易趋于饱和,导致吸附率逐渐下降。当上样液质量浓度较小时,树脂的利用率比较低,综合考虑黄酮的吸附率与树脂的利用率,选择0.8 和1.6 mg·mL-1的平均浓度1.2 mg·mL-1作为最佳上样浓度。
2.1.2 上样流速和上样体积对竹叶总黄酮吸附效果的影响 本实验通过控制树脂床的流速考察不同流速下的吸附效果,上样流速对树脂的吸附效率及所用时间均有着一定的影响。由图2 可知,随着上样流速的增加,AB-8大孔树脂对竹叶总黄酮的吸附率逐渐降低。在低流速下,AB-8 大孔树脂对竹叶总黄酮的吸附效果相对较好,但是随之所耗时间会变长。综合两者来看,选择2 BV·h-1作为上样流速为宜。
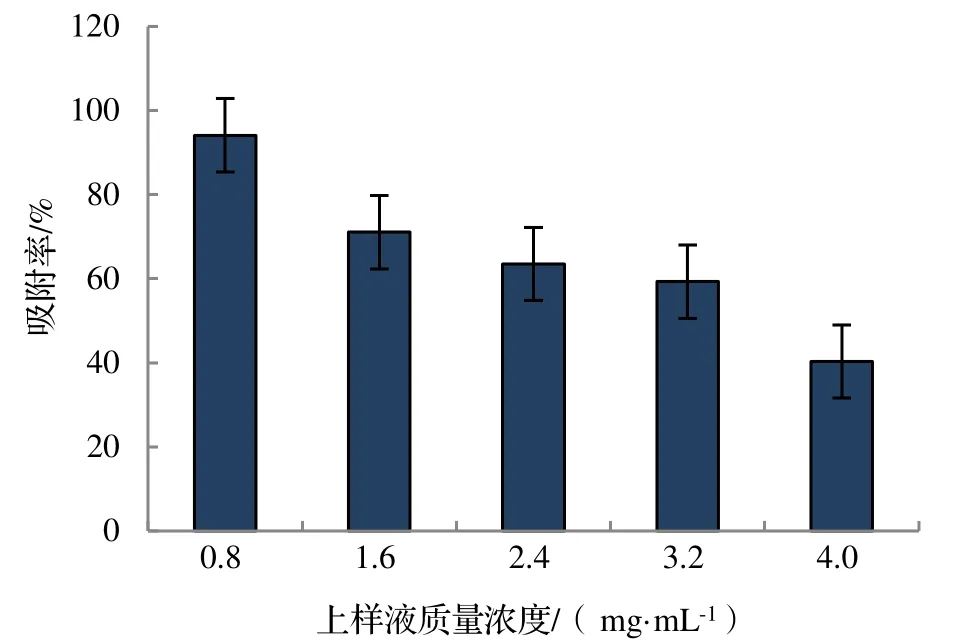
图1 上样液质量浓度对竹叶总黄酮吸附效果的影响Figure 1 Influence of mass concentration of loading solution on adsorption effect
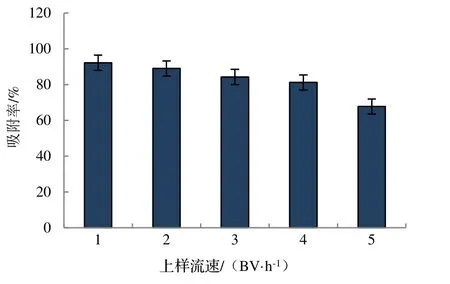
图2 上样流速对竹叶总黄酮吸附效果的影响Figure 2 Influence of loading flow rate on adsorption effect
由图3 可知,随着上样体积的增加,竹叶黄酮的吸附率逐渐降低。当上样体积较大时,竹叶黄酮单位表面积与大孔树脂接触量也越大,大孔吸附越容易趋于饱和,会降低吸附率;当上样体积较小时,树脂的利用率比较低。综合考虑两者,选择60 mL 作为上样体积最为合适。
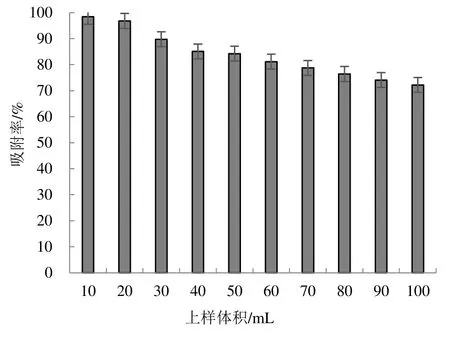
图3 上样体积对竹叶总黄酮吸附效果的影响Figure 3 Influence of loading volume on adsorption effect
2.1.3 洗脱体积分数对竹叶总黄酮解吸率的影响 乙醇溶剂具有安全、廉价、易回收等优点,因此用其做实验最佳。由图4 显示,竹叶黄酮解吸率随着乙醇体积分数的增加呈先增高后降低,当使用70%乙醇洗脱时,竹叶黄酮的解吸率最高,为77.0%;若乙醇体积分数继续增大,则竹叶黄酮的解吸率呈下降趋势。考虑到在实际工业生产中乙醇浓度过小会导致解吸不完全;乙醇浓度过大导致会杂质过多,因而采用70%乙醇洗脱效果最好。
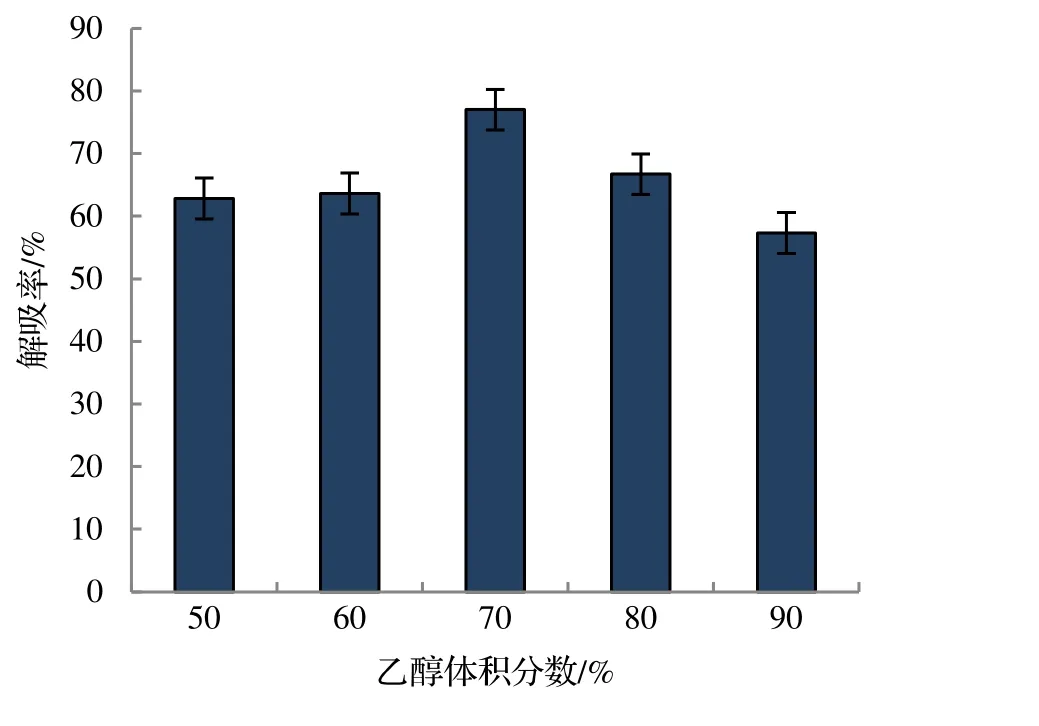
图4 洗脱液体积分数对竹叶总黄酮解吸率的影响Figure 4 Influence of volume fraction of eluent on desorption rate
2.1.4 洗脱体积对竹叶黄酮解吸率的影响 按照最优上样条件进行吸附,用100 mL70%乙醇洗脱剂以2 BV·h-1的流速进行洗脱,结果如图5。由图5 可知,当70%乙醇的洗脱体积在10~20 mL 时,竹叶黄酮的解吸率随着洗脱剂洗脱体积的增加迅速增加,继续增加洗脱剂的洗脱体积则竹叶黄酮的解吸率呈现断崖式减小,表明大部分竹叶黄酮在洗脱剂的洗脱体积为10~ 20 mL 时被洗脱。当洗脱剂的洗脱体积达到60 mL 时,其后的解吸率则几乎不再变化,且总解吸率达到99.46%,几乎解吸完全。综合考虑洗脱液的利用率及生产效率,选择60 mL70%乙醇为最佳洗脱体积。
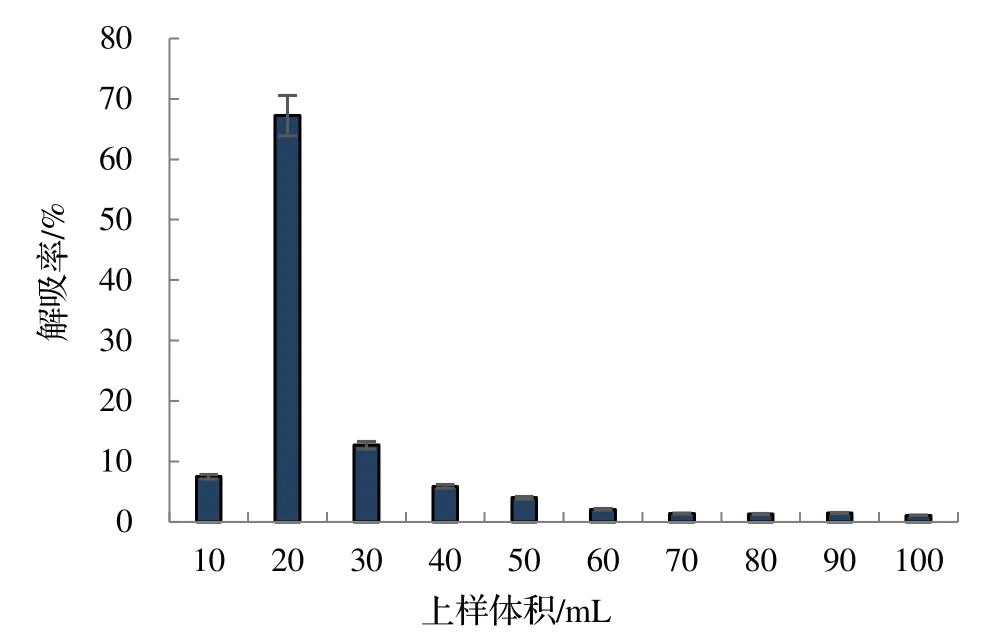
图5 洗脱体积对竹叶总黄酮解吸率的影响Figure 5 Influence of elution volume on desorption rate
2.1.5 不同洗脱流速对竹叶黄酮洗脱效果的影响 由图6 可知,竹叶黄酮的解吸率随着洗脱流速的增大呈现先升高后降低的趋势,当洗脱流速从1 BV·h-1增加到3 BV·h-1,AB-8 大孔树脂吸附的竹叶黄酮的解吸率随之升高;在洗脱流速超过3 BV·h-1时,竹叶黄酮的解吸率随之减小。总体来说,不同洗脱流速对解吸效果的影响不大,3 BV·h-1为最适合洗脱流速。
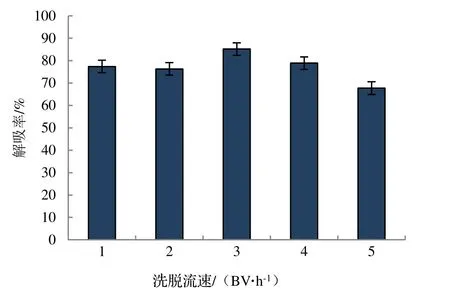
图6 不同洗脱流速对竹叶总黄酮洗脱效果的影响Figure 6 Influence of different elution flow rates on elution
2.2 A B-8 大孔树脂纯化竹叶黄酮工艺验证实验
采用AB-8 大孔树脂纯化竹叶黄酮,考察各因素对吸附-解吸性能的影响,由此得到的最佳工艺条件为:上样质量浓度为1.2 mg·mL-1、上样流速为2 BV·h-1、上样体积为60 mL;洗脱剂乙醇的体积分数为70%、洗脱体积为60 mL、洗脱流速为3 BV·h-1。在此条件下对竹叶黄酮进行纯化,将收集到的洗脱液浓缩干燥,测得其纯度由28.39%提高至77.42%,约为纯化前的2.7 倍,纯化效果显著。回收率为101.27%,可能存在其他黄酮类物质的干扰。
2.3 竹叶黄酮清除DPPH 自由基能力的测定
竹叶黄酮纯化前后都对DPPH 自由基有明显的消除作用,其清除能力随着竹叶黄酮浓度的升高而增强(如图7),在0.2~1.0 mg·mL-1范围内,初样品对DPPH 自由基的清除能力比纯化后的稍弱,随着浓度的不断升高,其消除能力仍与纯化后的竹叶黄酮存在着不小的差异。综合测定结果分析,在竹叶黄酮质量浓度为1.0 mg·mL-1时,初样品的清除率到达了93.52%,而纯化后供试品的清除率达到了96.68%,具有非常优异的清除作用。从总体上看,上样液中总黄酮含量越高,其抗氧化效果越好。以上结果说明经过纯化工艺过后的竹叶黄酮提取液相比粗提物具有更好的抗氧化活性,为进一步研究提供了参考。
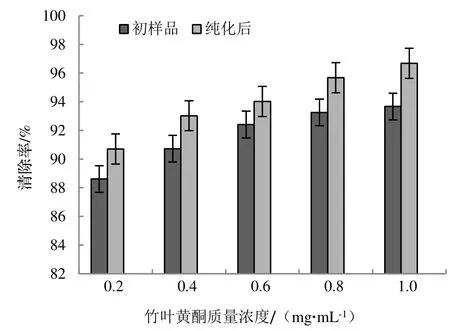
图7 竹叶黄酮对DPPH 自由基的清除能力Figure 7 Scavenging ability of BLF to DPPH
2.4 竹叶黄酮清除·OH 能力的测定
由图8 可知,纯化前后的竹叶黄酮对·OH 的清除效果与对DPPH 自由基的清除效果相似,对·OH 的清除率均随着竹叶黄酮质量浓度的升高而增强。纯化后竹叶黄酮对·OH 的清除能力普遍高于纯化前,而且二者随着质量浓度的增加,其对·OH 的清除能力差异越来越大,在浓度为1.0 mg·mL-1时,纯化后竹叶黄酮的·OH 清除率达到了29.41%。从·OH 清除能力测定结果显示,竹叶黄酮的粗提物含较多杂质,因而对·OH 的清除效果相对较弱一些,AB-8 树脂纯化工艺进一步提高了竹叶黄酮的纯度,并增强了其对·OH 的清除能力。
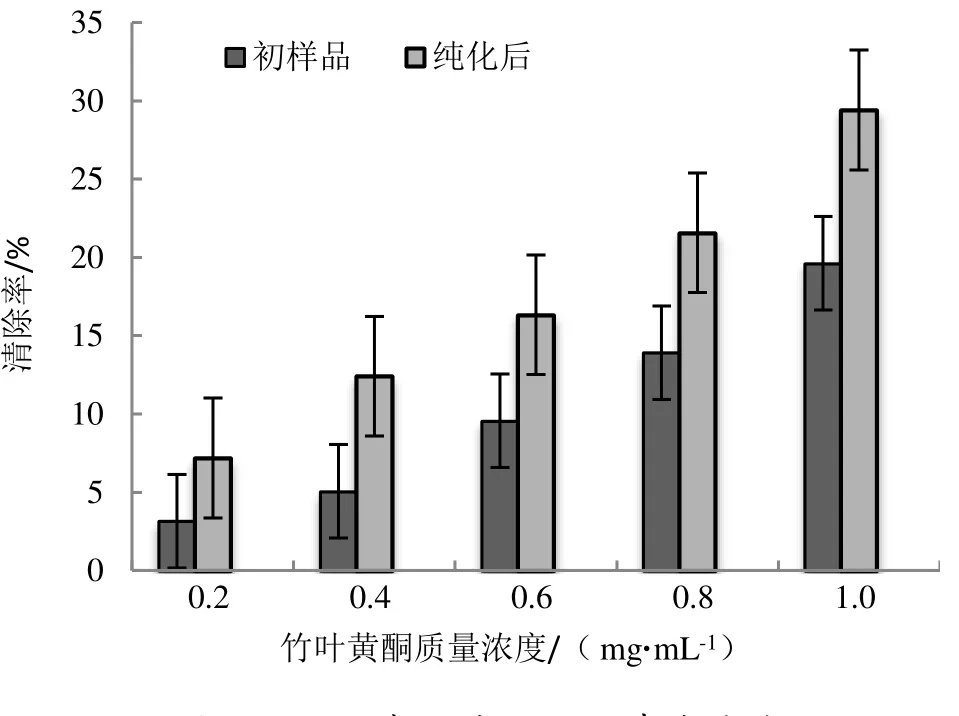
图8 竹叶黄酮对·OH 的清除能力Figure 8 Scavenging ability of BLF to hydroxyl radical
3 结论与讨论
本研究采用AB-8 大孔树脂吸附法对竹叶黄酮进行纯化,探讨了AB-8 大孔树脂的吸附及解吸的动力学特性,并对其动态吸附-解吸的工艺进行了优化,确定了竹叶黄酮柱层析纯化的最佳工艺条件为:上样液质量浓度为1.2 mg·mL-1、上样体积为60 mL、上样流速为2 BV·h-1条件下上柱吸附;乙醇洗脱剂体积分数为70%、洗脱体积为60 mL、洗脱流速为3 BV·h-1的条件下进行洗脱。在此工艺条件下对竹叶黄酮进行纯化,其纯度由28.39%提高到77.42%,约为纯化前的2.7 倍,竹叶黄酮对DPPH 自由基以及·OH 都具有较好的清除作用,其抗氧化活性随着样品浓度的增加而增强。通过研究得知,纯化后得到的竹叶黄酮清除能力普遍较纯化前强。该方法操作简单,使用单一树脂对竹叶黄酮进行纯化,与混合树脂相比,简化了操作流程。
增加对树脂的动态吸附和解吸行为的了解,相比较树脂的静态吸附,更具有研究意义。后续的抗氧化实验为该纯化工艺的延伸,再次验证了纯化工艺的可行性,表明该实验可为竹叶黄酮进一步产业化提供参考依据。此外,本研究仅从总黄酮含量的角度研究,存在一定的干扰,后续实验可以黄酮碳苷含量为检测指标进行深入研究。大孔树脂对竹叶黄酮的纯化存在一定的局限性,可结合其他柱色谱进行二次纯化。

