银杏蜜环口服溶液对大鼠心肌微血管内皮细胞血管新生能力的影响
韩 笑,姚明江,任建勋,付建华,任钧国,金 龙,郭 浩,赵步长,王益民,刘建勋∗
(1.中国中医科学院西苑医院基础医学研究所,北京市中药药理重点实验室,北京 100091;2.西安步长中医心脑病医院,西安 710082)
血管新生在胚胎发育、组织修复、心室重构、肿瘤等生理病理过程中具有重要作用。近年来缺血性血管疾病的防治从单纯改变病变血管供血,转向如何促进侧支循环的建立,因而促血管新生成为缺血性血管疾病的治疗新方向[1]。心肌微血管内皮细胞是心肌与血液交换能量的主要屏障,可合成多种细胞因子和活性物质,维持正常心肌的功能,参与心肌缺血后血管新生[2]。很多中药可以促进血管新生、促进侧支循环,在治疗缺血性心脑血管疾病方面具有良好的应用前景[3]。
银杏蜜环口服溶液主要由银杏叶提取物和天麻蜜环菌组成,银杏叶提取物有活血化瘀通络之功,蜜环菌可镇静安神,临床用于治疗冠心病、心绞痛、缺血性脑血管疾病,可改善心脑缺血性症状[4-5]。药理研究显示,银杏蜜环口服溶液可保护急性心肌缺血大鼠[6]和犬[7],减轻脑缺血再灌注大鼠脑梗死[8],对缺氧复氧损伤脐静脉内皮细胞[9]、脑微血管内皮细胞损伤[10]具有保护作用,但是对血管新生方面的研究尚未见报道。本研究旨在观察银杏蜜环口服溶液对大鼠心肌微血管内皮细胞血管新生能力的影响,发掘银杏蜜环口服溶液治疗缺血性心血管疾病的药效机制。
1 材料和方法
1.1 细胞
大鼠心肌微血管内皮细胞CMECs(Cat NO.C645,ATCC)。
1.2 主要试剂与仪器
银杏蜜环口服溶液(每10mL含30mg银杏叶提取物和1000mg蜜环菌粉,邛崃天银制药有限公司提供,批号190721);DMEM培养基(GIBCO,8119352);胎牛血清(Biowest,S14735S1820);胰蛋白酶消化液(Solarbio,T1300);青霉素-链霉素SP(Gibco,1894156);CCK-8试剂盒(Dojindo,CK04);Matrigel基质胶(Corning,356237);RIPA细胞裂解液(Solarbio,R0010);BCA蛋白浓度测定试剂盒(Solarbio,20191229);5×SDS-PAGE蛋白上样缓冲液(KeyGEN BioTECH,20160712);10×电泳缓冲液、10×电转移缓冲液、10×封闭洗涤液、封闭专用脱脂奶粉(北京普利来基因技术有限公司);化学发光检测试剂盒(Thermo Scientific,UI291092);VEGF抗体(Abcam,A3098);CD31抗体(Abcam,ab24590);βactin抗体(Proteintech,66009-1);辣根过氧化物酶标记山羊抗兔IgG(YUABIO,127760);辣根过氧化物酶标记山羊抗小鼠IgG抗体(YUABIO,203700113)。
活细胞工作站(Olympus,IX81);酶标仪(BioTek SYNERGY4);电 泳 仪(BIO-RAD,Power Pac Univeral);凝胶成像仪(BIO-RAD,ChemiDocTMXRS+)。
1.3 实验方法
1.3.1 CMECs细胞培养
CMECs细胞以DMEM高糖培养基(含10%FBS和1%青/链霉素)培养,细胞生长至80%融合时,胰蛋白酶消化液消化传代,取对数生长期的细胞进行实验。
1.3.2 分组及给药
分组:对照组、银杏蜜环口服溶液高剂量组(2.6mg/mL,简称银蜜高)、中剂量组(1.3mg/mL,简称银蜜中)、低剂量组(0.6mg/mL,简称银蜜低)。对照组用DMEM培养基培养;银蜜高、中、低组适时(给药时间因实验不同而不同,具体见下)吸弃旧培养基,加入含药DMEM培养基。
1.3.3 CMECs增殖检测
细胞增殖实验用CCK-8法。细胞以1×105/mL的密度接种于96孔板,待细胞充分贴壁后,弃旧培养基,对照组换成DMEM培养基(每孔100μL),银蜜高、中、低剂量组分别换成含银蜜2.6、1.3、0.6 mg/mL的DMEM培养基(每孔100μL),将细胞放回培养箱继续培养。24h后取出加入CCK-8溶液每孔10μL,孵育3h,酶标仪测定450nm处的吸光度OD值,OD值大小与活细胞的数量成正比。细胞增殖率(%)=(给药组OD值-对照组OD值)/对照组OD值×100%
1.3.4 CMECs迁移检测
细胞迁移率借助细胞划痕法,比较各组细胞划痕面积愈合百分比(%),评价银杏蜜环口服液对CMECs迁移能力的影响。CMECs以每孔5×105cells的密度接种于6孔板内,待形成完全融合的单层细胞层后,用200μL无菌枪头在孔中画“井”字型划痕无菌PBS洗细胞3次,去除划下的脱落细胞碎片,确保划线后留下的间隙清晰可见。此时,对照组加入DMEM培养基,银蜜高、中、低剂量组分别换成含银蜜2.6、1.3、0.6mg/mL的DMEM培养基,放回培养箱培养。于划痕后即刻(0h)、划痕后6h、划痕后24h显微镜观察横竖划痕交叉点四周的固定检测点,拍照,Image J软件计算划痕面积。细胞迁移率(%)=(原划痕面积-残留面积)/原划痕面积×100%。
1.3.5 CMECs体外成管实验
将Matrigel基质胶、24孔板、枪头提前预冷。向预冷的24孔板中加入Matrigel基质胶(每孔250 μL),放入培养箱30min固化成胶。将CMECs接种于Matrigel基质胶包被好的24孔板中,放回培养箱待细胞贴壁后,对照组换成DMEM培养液,银蜜高、中、低剂量组分别换成含银蜜2.6、1.3、0.6mg/mL的DMEM培养基继续培养3h。3h后倒置显微镜下观察细胞成管情况,每孔随机选取5个视野拍照。Image J图像分析软件分析,以网眼数、网眼面积、交叉点数表示各组CMECs的成管能力。网眼和交叉点示意图见图1。

图1 体外成管实验主要检测指标示意图Figure1 Schematic diagram of main detection indexes in vitro tube forming experiment
1.3.6 CMECs CD31、VEGF蛋白免疫印迹检测
CMECs经药物处理后预冷的RIPA裂解液冰上超声裂解细胞,13000r/min,4℃离心后取上清测蛋白浓度。取等量蛋白上样,SDS-PAGE分离后,将蛋白转印至PVDF膜,5%脱脂奶粉室温摇床封闭1h,CD31、VEGF一抗(1∶1000),4℃冰箱孵育过夜。TBST洗膜3次,辣根过氧化物酶标记山羊抗兔IgG(1∶20000)室温孵育2h,TBST洗涤3次后,增强型化学发光试剂(ECL)显色,Image Lab3.0系统成像软件采集凝胶成像图片,分析条带灰度值。
1.4 统计学方法
2 结果
2.1 银杏蜜环口服溶液对CMECs增殖的影响
与对照组相比,银蜜高、中、低剂量可显著促进CMECs增殖,具有统计学差异(P<0.05~0.001);银蜜高促进细胞增殖生长的作用优于银蜜中、低组(P<0.001);银蜜中剂量与低剂量组相比,未见统计学差异。结果提示银杏蜜环口服溶液对CMECs具有显著的增殖效应,见表1。
表1 银杏蜜环口服溶液对CMECs增殖的影响(±s,n=6)Table1 Effect of YM(Yinxing Mihuan oral solution)on proliferation of CMECs

表1 银杏蜜环口服溶液对CMECs增殖的影响(±s,n=6)Table1 Effect of YM(Yinxing Mihuan oral solution)on proliferation of CMECs
注:与对照组比较,∗P<0.05,∗∗∗P<0.001;与银蜜中组比较,△△△P<0.001;与银蜜低组比较,▲▲▲P<0.001。Note.Compared with control group,∗P<0.05,∗∗∗P<0.001.Compared with YM medium dose group,△△△P<0.001.Compared with YM low dose group,▲▲▲P<0.001.
组别Groups剂量Dose增殖率(%)Proliferation rate对照组Control group / 0±0银蜜高组YM high dose group2.6mg/mL 34.0±4.9∗∗∗△△△▲▲▲银蜜中组YM medium dose group1.3mg/mL 10.5±5.2∗银蜜低组YM low dose group 0.6mg/mL 8.6±4.5∗
2.2 银杏蜜环口服溶液对CMECs迁移的影响
结果显示,6h时间点,银蜜高组细胞迁移率显著高于对照组,具有统计学差异(P<0.001),银蜜中、低组CMECs迁移率大于对照组,但无统计学差异(P>0.05);在24h时间点,银蜜高、中、低组细胞迁移率明显高于对照组,具有统计学差异(P<0.001),且银蜜高组迁移率显著高于银蜜中、低组(P<0.001);银蜜中组迁移率高于银蜜低组(P<0.001)。提示银蜜可促进CMECs迁移,且促进CMECs迁移的能力随着银蜜剂量的增加而增强、随时药物作用时间的延长而增加。见表2,图2。
表2 银杏蜜环口服溶液对CMECs迁移率(%)的影响(±s,n=6)Table2 Effect of YM on CMECs mobility rate

表2 银杏蜜环口服溶液对CMECs迁移率(%)的影响(±s,n=6)Table2 Effect of YM on CMECs mobility rate
注:与对照组比较,∗∗∗P<0.001;与银蜜中组比较,△△△P<0.001;与银蜜低剂量组比较,▲▲▲P<0.001。Note.Compared with control group,∗∗∗P<0.001.Compared with YM medium dose group,△△△P<0.001.Compared with YM low dose group,▲▲▲P<0.001.
组别Groups剂量Dose 6h迁移率(%)6h mobility rate 24h迁移率(%)24h mobility rate对照组Control group / 6.5±5.7 22.1±6.0银蜜高组YM high dose group 2.6mg/mL 15.1±3.3∗∗∗ 57.7±5.5∗∗∗△△△▲▲▲银蜜中组YM medium dose group 1.3mg/mL 13.0±8.8 44.9±5.6∗∗∗▲▲▲银蜜低组YM low dose group 0.6mg/mL 11.7±4.7 31.4±2.9∗∗∗

图2 银杏蜜环口服溶液对CMECs迁移能力的影响Figure2 Effect of YM on migration ability of CMECs
2.3 银杏蜜环口服溶液对CMECs成管的影响
CMECs细胞接种于Matrigel基质胶孔中后,刚开始呈圆形或卵圆形,30min后基本贴壁,1h后细胞逐渐伸展并伸出突起,3h后突起相互连接形成小管样结构。银蜜有良好的促进CMECs成管作用,且促CMECs成管的能力随药物剂量的增加而增强,见图3、表3。
表3 银杏蜜环口服溶液对CMECs网眼数、网眼面积、交叉点数的影响(±s,n=3)Table3 Effect of YM on meshes number,meshes area and junctions of CMECs

表3 银杏蜜环口服溶液对CMECs网眼数、网眼面积、交叉点数的影响(±s,n=3)Table3 Effect of YM on meshes number,meshes area and junctions of CMECs
注:与对照组比较,∗P<0.05,∗∗P<0.01,∗∗∗P<0.001;与银蜜中组比较,△△△P<0.001;与银蜜小组比较,▲P<0.05,▲▲▲P<0.001。Note.Compared with control group,∗P<0.05,∗∗P<0.01,∗∗∗P<0.001.Compared with YM medium dose group,△△△P<0.001.Compared with YM low dose group,▲P<0.05,▲▲▲P<0.001.
组别Groups剂量Dose网眼数(个)Nb meshes(NO.)网眼面积(像素)Meshes area(PX)交叉点数(个)Nb junctions(NO.)对照组Control group / 2±2 9585±8034 30±11银蜜高YM high dose group 2.6mg/mL 10±6∗∗▲ 112307±96316∗∗▲ 60±16∗∗∗△△△▲▲银蜜中YM medium dose group 1.3mg/mL 5±3∗ 35283±28857∗ 41±12∗银蜜低YM low dose group 0.6mg/mL 4±3 22072±13128∗ 39±14

图3 银杏蜜环口服溶液对CMECs小管形成的影响Figure3 Effect of YM on tubule formation of CMECs
网眼数及网眼面积结果显示,与对照组相比银蜜高、银蜜中组网眼数显著增多(P<0.01,P<0.05)、网眼面积更大(P<0.01,P<0.05),其中银蜜高组网眼的数量及面积与银蜜低组相比具有统计学差异(P<0.05)。银蜜低组网眼数量增多,但与对照组相比无统计学差异(P>0.05),网眼面积显著大于对照组(P<0.05)。交叉点数结果显示:银蜜高组细胞网状结构的交叉点显著多于对照组、银蜜中、低剂量组(P<0.001);银蜜中、低组交叉点数高于对照组,银蜜中组与对照组相比有统计学差异(P<0.05)。
2.4 银杏蜜环菌口服溶液对CMECs CD31、VEGF蛋白表达的影响
结果显示,与对照组相比,银蜜高、银蜜中组CD31、VEGF蛋白表达量均显著升高(P<0.05~0.001),银蜜低组CD31和VEGF表达有升高趋势,但统计学意义(P>0.05);银蜜高组CD31、VEGF表达量显著高于银蜜中、低组(P<0.001),见图4。
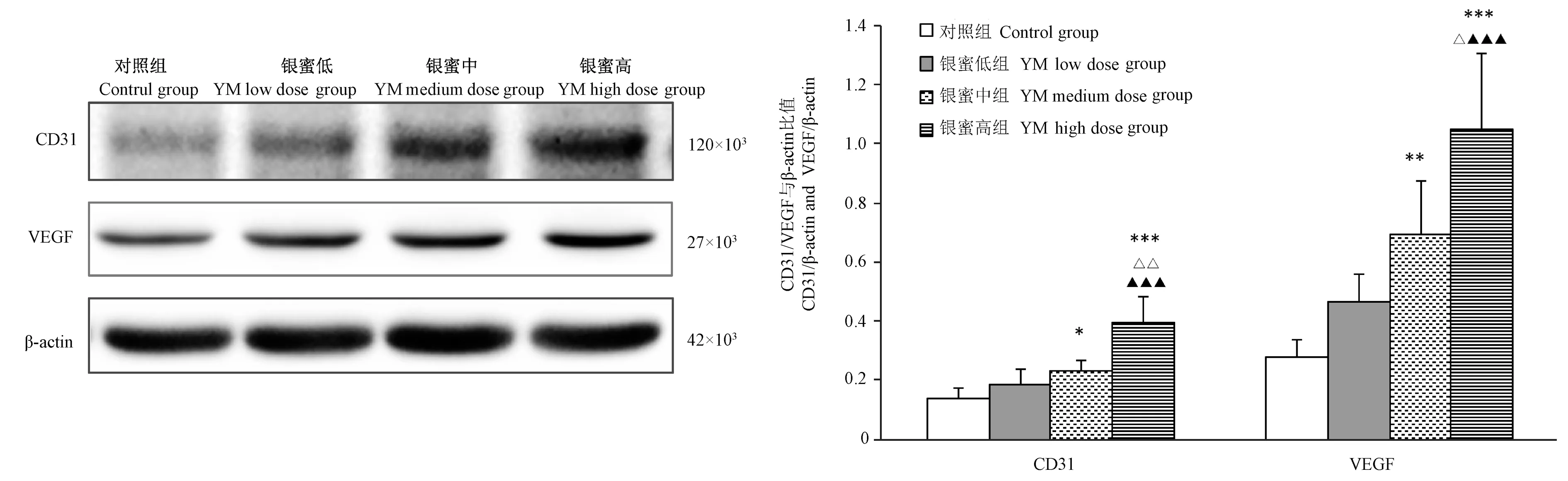
图4 银杏蜜环口服溶液对CMECs CD31、VEGF表达的影响Figure4 Effect of YM on the expression of CD31、VEGF in CMECs
3 讨论
冠心病的死亡率呈逐年上升态势,建立有效的冠状动脉侧支循环可以在一定程度上缓解心肌缺血症状,降低患者的病死率[11-12],而侧支循环的形成有赖于新生血管,血管新生能力是侧支循环建立的基础和关键[13]。治疗性血管新生成为缺血性心脏病治疗的新途径[14]。
银杏蜜环口服溶液主要有效物质为银杏叶提取物和天麻蜜环菌,其有银杏叶具有活血、化瘀、通络之功效,银杏叶提取物具有保护线粒体、抑制细胞凋亡、抗氧化、抗炎、扩张血管、改善血液循环的作用[15];天麻蜜环菌与天麻共生,与天麻有相似的药理作用和临床疗效[16],具有抗炎、抑制细胞凋亡、抑制血小板活化、抗血栓等药效[17],与化瘀通络功效相似。银杏蜜环口服溶液临床用于治疗缺血性心血管疾病,但机制是否与促进心肌缺血区血管新生的作用少见报道。
血管生成是一个复杂过程,涉及激活期血管基底膜降解;血管内皮细胞的激活、增殖、迁移;重建形成新的血管和血管网等环节[18]。血管生成受机体多种因素如CD31和VEGF的调节。CD31又称为血小板-内皮细胞粘附分子,存在于血管内皮细胞紧密连接处,CD31胞内结构域的酪氨酸残基磷酸化,启动丝裂原活化蛋白激酶/细胞外调节蛋白激酶信号通路,调控细胞的增殖、分化、迁移和凋亡,促进血管生成[19]。VEGF是血管内皮细胞的特异性有丝分裂剂,促进血管内皮细胞的增殖和迁移,抑制内皮细胞凋亡,增加血管的渗透性[20-21],使血浆蛋白溢出凝结形成凝胶体,成为血管生成的临时基质,为内皮细胞迁移提供纤维网络,在促血管生成的调控中发挥重要作用[22-25]。
本研究观察银杏蜜环口服溶液对体外培养CMECs增殖、迁移及血管样管腔形成的影响;同时检测与血管生成密切相关的CD31、VEGF蛋白表达情况,综合评价银杏蜜环口服溶液体外促血管新生的能力及机制。实验结果提示,银蜜高、中、低剂量具有显著促进CMECs增殖、迁移和成管的药效,且药效随着银蜜实验剂量的增加而增强。同时,银蜜还可明显上调CD31和VEGF的蛋白表达,银蜜剂量越高,内皮细胞CD31和VEGF的蛋白表达量越高。
依据上述细胞学研究结果,可以推测银蜜促进细胞增殖的作用将为血管生成提供足够多的细胞、促进细胞迁移的能力则把增殖的内皮细胞迁移至需要生成血管的部位,为血管生成提供物质基础,之后银蜜促成管的作用将帮助机体利用输送过来的增殖细胞,组建管样网状结构。同时,银蜜刺激内皮细胞CD31和VEGF的表达,二者协同内皮细胞增殖、迁移、成管过程,并为血管网的生成提供临时基质和纤维网络,最终形成管腔样结构。
在Matrigel基质胶成管实验中,银蜜高剂量组网眼数量、网眼面积、交叉点数量都显著高于对照组、银蜜中、银蜜低剂量组。网眼数量越多,网眼面积越大,代表可能形成血管管腔越多,血管管径可能越粗,大口径的新生血管将有可能为缺血组织提供更多的血供,更为有效地发挥缺血代偿作用。交叉点越多,血管网状结构就越牢固越成熟。可见,银蜜高剂量显示出更好的促进CMECs体外成管的药效。
综上所述,银杏蜜环口服溶液可促CMECs增殖、迁移、成管,并能上调细胞CD31和VEGF的表达,具有良好的体外促血管新生的能力,其活血、化瘀、通络的功效及其治疗缺血性心脏病的药效机制与其促血管新生的作用具有一定相关性。促血管生成更深入的机制将在细胞及心肌缺血动物模型上进行。

